E2B試験の設定
Veeva EDC とサードパーティのSafetyシステム間のSafety統合は、AS2 ゲートウェイを介した E2B XML (R3 バージョン) の交換に基づいています。適切な統合構成により、必要なすべての安全関連 EDC データと補足的な安全関連 EDC データが安全性ケースとして安全システムに送信されます。移管につながる可能性のある例としては、重篤な有害事象、特に注目すべき有害事象、治験中の予期外妊娠などが挙げられます。
スタディデザインに対する統合設定により、施設が安全性ケース開始の基準を満たすイベントを作成するたびに、Veeva EDC は自動的に初回送信を生成し、データを安全性システムに転送します。
関連データを安全性ケースに挿入するには、それらのデータを次のいずれかの安全性データ タイプに分類します。
- 治験薬(臨床治験で治験される製品)
- 併用薬
- 病歴
- 薬歴
- 検査結果
- 患者特性
- 死亡例
- システム別報告者 / 送信者コメント
安全性ケースの開始データまたは関連データが更新されると、指定された時間間隔で安全システムに送信されるフォローアップ送信が自動的に生成されます。
試験設計者は、EDC 試験設計 項目 を E2B R3 要素にマッピングすることで、この統合を構成します。マップされたケースブック要素を安全性ケースに含めるかどうかは、構成された包含ルールによってさらに決まります。包含ルールでは、マッピングされた アイテム を被験者のすべてのケースブック フォーム に含めるか、施設によって安全性ケースの開始フォームにリンクされているもの、または開始イベントに関連して選択された日付範囲に該当するものを含めるかを選択できます。
安全性ケースは、単一のイベントにより作成される場合もあれば、複数のイベントで構成される場合もあります。これは、施設 リンクや日付ベースの包含ルールを使用して構成されます。
システムは、Safetyシステムからの確認応答 (「ACK ファイル」) を受け入れ、データが正しく受信され解析されたことを確認します。この返却情報では、ケースのステータス、メッセージのステータスを確認し、必要に応じてエラーの詳細を提供します。
統合の状態と健全性を確認するための概要情報は、Safety Cases (V4) レポートおよび Safety Messages - E2B (V4) レポートで参照できます。Safetyの統合では、最初の転送を開始した基準が当てはまらなくなった場合に実行される自動無効化転送もサポートされます。例としては、フォームのリセット(入力ミス)やイベントのダウングレードなどが挙げられます。無効化の項をご参照ください。
安全性管理者は、最初の送信のタイミングとフォローアップの頻度、および統合のその他の運用設定を設定します。詳細については、 「Safety 統合の管理」の「Safety 設定」 を参照してください。
前提条件
標準の CDMS スタディ デザイナー または CDMS ライブラリアン スタディ ロールを持つユーザは、安全性構成の表示と編集の両方を行うことができます。組織がカスタム治験の役割を使用する場合、ロールには以下の権限が付与されている必要があります:
| タイプ | 権限ラベル | 制御 |
|---|---|---|
| 標準タブ | Studio タブ | Studio タブへのアクセス権限 |
| 標準タブ | ライブラリタブ | ライブラリタブへのアクセス権限 |
| 機能権限 | 治験デザインの表示 | 治験デザインへの閲覧のみのアクセス |
| 機能権限 | 治験のデザイン | Studio から治験デザイン定義と治験スケジュールを作成する権限 |
| 機能権限 | 安全設定の管理 | Study の安全性統合を設計および構成する権限。これには、どの フォーム が関係しているか、それらの フォーム のどの 項目 が安全システムに送信されるか、どの 組入基準 が 安全性ケースにフォーム データを含めるか範囲外 (Out)するかを規定するかを決定することが含まれます。 |
| 機能権限 | ライブラリの表示 | Studio>ライブラリからライブラリコレクションとそのデザインを表示する権限 |
| 機能権限 | ライブラリの設計 | Studio>ライブラリからコレクションの治験デザイン定義と治験スケジュールを作成する権限 |
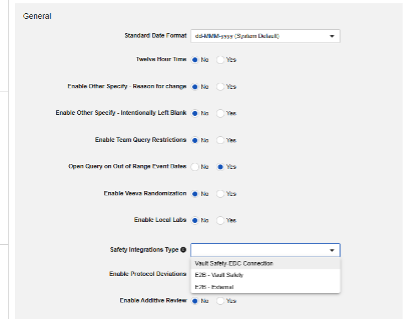
安全性統合タイプ
Veeva EDC の安全性統合を構成する最初のステップは、研究設定の 安全性統合タイプ の値です。
安全性統合タイプ 設定は、空でない値を持つ場合、読み取り専用になります。これは、E2B スタイルの統合と Safety-EDC 接続試験の性質によるものです。2 つを切り替える必要がある場合は、サポートと計画について Veeva の担当者にお問い合わせください。
Safety-EDC 接続を使用したSafetyの統合の詳細については、「 Safety-EDC 接続スタディの構成」を参照してください。
全体的な統合タイプが保存されると、スタジオ ナビゲーション メニューの [Safety設定] と [フォーム構成] に追加のオプションが表示されます。
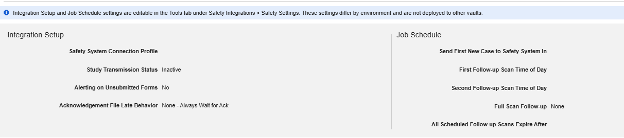
Safety設定
設定の更新
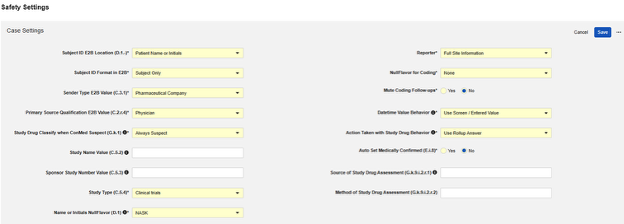
スタジオ のメイン スタディ設定で適切な Safety 統合タイプを設定したら、次のステップはSafetyケース設定を構成することです。これらの設定は試験内のすべてのSafetyケースに影響し、試験ごとに異なる場合があります。
注:「Safety設定」ページの下部にある追加設定は、スタジオ 内で管理されません。これらは、展開されたスタディのリマインダーとして、つまり本番環境またはその他のダウンストリーム環境で スタジオ を操作するときに表示されます。これらの調査運用設定は、 「ツール」→「Safety性統合」 でSafety性管理者によって管理されます。詳細については、 「Safety 統合の管理」の「Safety 設定」 を参照してください。
利用可能な設定
| 設定 | デフォルト値 | 説明 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| E2B における被験者 ID の場所 (D.1. | 患者名またはイニシャル | 現在の試験の Veeva EDC 被験者 ID が転送される E2B の場所を選択します。
|
||||||||||||||||||||||||
| E2B における被験者 ID のフォーマット | 被験者のみ | Vault が EDC 被験者 ID を Safety システムに転送するために使用する形式を選択します。
|
||||||||||||||||||||||||
| 送信者タイプ E2B の値 (C.3.1) | 製薬会社 | EDC から Safety システムに Safety ケースを送信する組織のタイプを選択します。この値は C.3.1 を介して渡されます。次の組織タイプから選択できます:
|
||||||||||||||||||||||||
| プライマリソース評価 E2B 値 (C.2.r.4) | 医師 | C.2.r.4 は、Safety ケースの各有害事象に関連するため、試験薬または治療法を評価する者の分類を示します。次の分類タイプから選択できます:
|
||||||||||||||||||||||||
| ConMed 候補の場合のスタディ薬分類 (G.k.1) | 常に候補 | 選択利用可能:
この設定は、データ入力ユーザーが「併用薬」と分類されたフォームを「Safety性ケース開始イベント」にリンクし、「併用」(E2B 値「2」)のデフォルト分類を上書きできるように試験が設定されている場合にのみ適用されます。 例: ユーザーが薬剤をリンクするときに SUSPECT を選択した場合、Always Interacting を使用すると、転送中のすべての試験薬がシステムによって Suspect と判断されていた場合でも、Interacting に転送されます。 |
||||||||||||||||||||||||
| 研究名の値 (C.5.2) | オプション: E2B ファイルで _Study Name_ の値を設定します。空欄の場合、E2B の内容から省かれます。 | |||||||||||||||||||||||||
| スポンサー試験番号の値 (C.5.3) | オプション: スタディ番号を入力して、E2B ファイルの値を上書きします。空の場合、既存のスタディラベルが使用されます。 | |||||||||||||||||||||||||
| 研究の種類 (C.5.4) | 試験 | 試験タイプを選択します(C.5.4)。以下から選択します:
|
||||||||||||||||||||||||
| 名前またはイニシャル E2B NullFlavor (D.1) | NASK |
この設定は、E2B の 場所 D.1 の名前またはイニシャルで null フレーバ値を設定する場合に使用します。ただし、この場所がスタディ設定 Subject E2B Location (D.1.*)。選択肢は次のとおりです:
|
||||||||||||||||||||||||
| 報告者 | 全サイト情報 | 選択肢から選択してください:
E2B のレポーターの施設は、Veeva EDC の サイト の情報設定に基づいて入力されます。 |
||||||||||||||||||||||||
| コーディングのためのヌルフレーバー | なし |
MedDRA コーディング値がない場合に、コーディングの欠損値を処理する方法を選択します。この設定は、コーディングを行うように構成し、Safety性転送用の E2B 場所を適用した Veeva EDC スタディデザイン内の場所にのみ適用されます。以下のオプションから選択してください。
E2B でのコーディングの場所は次のとおりです。
|
||||||||||||||||||||||||
| コーディングフォローアップをミュート | いいえ |
この設定を はい に設定すると、Veeva EDC でコード化された医療用語 (イベント、病歴、死亡原因) に新しいコードまたは異なるコードが割り当てられただけの変更があった場合に、Veeva EDC によるフォローアップの送信が停止されます。Safetyケースの一部であるデータに対するその他の変更は、引き続きフォローアップ送信を開始します。 いいえに設定すると、Veeva EDC は、医学用語のコーディングの変更など、Safetyケースの一部であるデータに対するすべての変更について、フォローアップを送信します。 スタディが Safety システムで主にコーディングを実行する場合、Vault は、Safety システムへの不必要なフォローアップを防ぐために、このオプションをはいに設定することを推奨します。 |
||||||||||||||||||||||||
| 日時値の動作 | 画面 / 入力値の使用 | EDC フォームの日時フィールドに対して安全データを構成する場合、このオプションは送信する値を示します。「画面/入力値を使用」を選択すると、サイトで入力された値をそのまま使用できます。また、「正規化された (UTC) 値を使用」を選択すると、サイトのタイムゾーンに基づいた画面上の値に対し UTC に正規化した日時値を使用できます。 | ||||||||||||||||||||||||
| 試験薬の服薬行動で行なわれた処置 | 主要 SAE 回答を使用 | この設定は、試験設計で 1つのSafetyケースで複数のイベントが許可されている場合にのみ適用されます。Safetyケースを開始した主要イベントとの追加イベントの転送は、それぞれの包含ルールを使用して設定できます ( 試験薬包含基準 を参照)。このような状況では、Safetyケースは、試験薬に対して取られた措置に対する複数の回答から構成されます。そのため、E2B 転送で回答を使用する方法が必要となります。選択肢から選択してください:
ロールアップ回答を使用する場合、Safetyケースに含まれるイベントのすべての回答が考慮されます。最も厳しい措置は、G.k.8 を介してSafetyシステムに転送されます。優先順位は次のとおりです。
たとえば、2 つのイベントがあり、1 つは用量減量、もう 1 つは用量変更なしと答えた場合、全体的な答えは用量減量となります。 |
||||||||||||||||||||||||
| 医学的に確認された自動設定 (E.i.8) | いいえ | この設定は、Safetyケースに「医療従事者による医学的確認」(E.i.8) を含めるかどうかを決定します。含める場合、はいを選択します。いいえを選択した場合、E.i.8 は E2B XML から省略されます。Safetyケースが臨床施設/試験者から発信されるため、これに対する最も一般的な使用法は はいです。 | ||||||||||||||||||||||||
| 試験薬の評価ソース (G.k.9.i.2.r.1) | 評価ソース (G.k.9.i.2.r.1) と評価方法 (G.k.9.i.2.r.2) に、すべてのケースに適用する静的値を入力します。評価の結果 (G.k.9.i.2.r.3) は、施設ユーザ用の回答フィールドで、試験薬タイプに設定されています。この設定で最もよく使用される値は 医療専門家です。 | |||||||||||||||||||||||||
| 試験薬の評価方法 (G.k.9.i.2.r.2) | 試験薬の評価方法 (G.k.9.i.2.r.2) では、すべてのケースに適用する静的な値を入力します。この設定で最もよく使用される値は グローバル検査です。 | |||||||||||||||||||||||||
| 二次イベントサイトへのリンクを症例に含める | はい | この設定に [はい] を使用すると、主安全性症例開始イベントだけでなく、症例の二次イベントにリンクされた関連先データも含まれます。 |
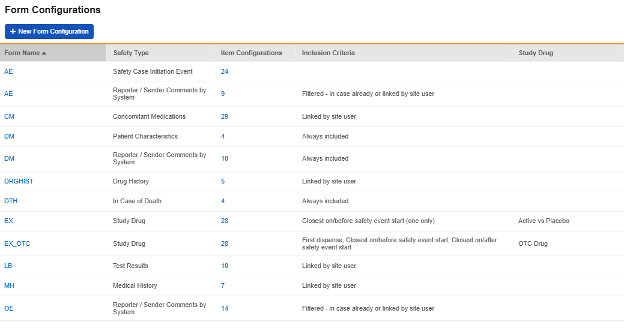
フォーム設定
メインの Safety設定 (前のセクション) を更新した後、次のステップでは、完全なスタデデザインのどの特定のフォームがSafety統合に参加するかを構成します。これらは スタジオ> フォーム構成で設定されます。
「新しいフォーム設定」ボタンは、 Safety設定の構成後にのみアクティブになることに注意してください。
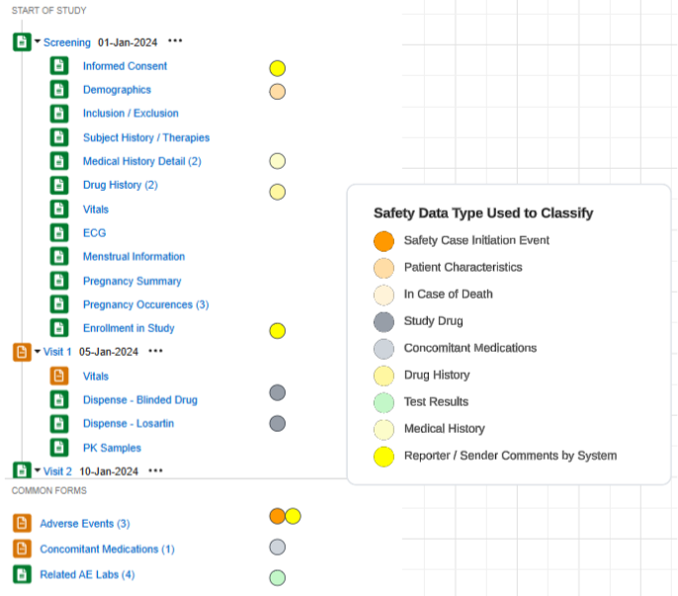
治験の設定済みフォームの概要リストの例:
安全性データタイプ
各フォームは、 安全性データタイプ を含む安全性統合用に設定されています。これらの型は、あらゆる安全性システムの標準データ モデル/型を表します。
Veeva EDC のSafety性構成タイプは次のようにまとめられます。
| タイプ | E2B (R3) 場所 | メモ |
|---|---|---|
| 安全性ケース開始イベント | E.* |
|
| 治験薬 | G.* |
|
| 併用薬 | G.* |
|
| 病歴 | D.7.* |
|
| 薬歴 | D.8.* |
|
| 検査結果 | F.* |
|
| 患者特性 | D.1からD.6 |
|
| 死亡例 | D.9.* |
|
| システム別報告者 / 送信者コメント | H.2またはH.4 |
|
フォーム設定を作成する方法
新しいSafetyフォーム構成を作成するには:
Safety性統合構成の更新権限があるにもかかわらず、ボタンが表示されない場合は、まず Safety設定 が保存されていることを確認してください。
オプション フォーム プロパティ、 アイテム設定、および 包含基準 については、このドキュメントの後のセクションでSafetyタイプ別に詳しく説明します。
各ステップで、 [保存] ボタンをクリックすると、次のステップに進まずにその情報が保存されます。[保存して次へ] ボタンをクリックすると、情報が保存され、次のステップに進みます。
フォーム設定の削除
単一の フォーム設定 または すべての フォーム設定 を一度に削除してやり直すことができます。 フォーム設定に関連付けられた安全性ケースがある場合、Vault は該当する削除オプションを無効化します。
単一のフォーム設定を削除するには:
- スタディ のStudio > フォーム設定 に進みます。
- フォーム設定の名前にカーソルを合わせると、アクションメニューが表示されます。
- 削除を選択します。
- 確認ダイアログで、削除をクリックします。
Safetyフォーム構成を削除しても、EDC フォームのデザイン自体にはまったく影響しません。研究からSafety性フォームへのマッピングに使用された EDC フォームを削除すると、それに関連付けられたSafety性フォームの構成も削除されます。
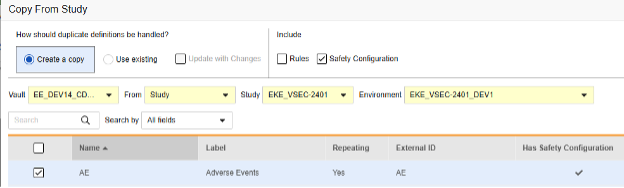
フォーム設定のコピー
現在のリリースでは、安全性フォームの設定情報をコピーする唯一の方法は、「フォームのコピー」を使用することです。その他のコピー レベル (コピー イベント グループとコピー イベント) では、フォーム レベルの安全性構成のコピーはサポートされていません。
ソース ライブラリ/スタディから イベント グループ または イベント がコピーされ (フォーム を含む)、それらの フォーム に安全性フォームの設定情報が含まれている場合は、後続のアクションとして「 既存の使用 / 変更を加えて更新 」オプションを指定して [フォームのコピー] を使用します。
フォーム のコアコピーを実行するときに安全性フォーム設定をコピーすることは任意です。
含める セクションで、 安全性構成 を選択して、以前に設定した設定をコピーする必要があります。
コピー中に既存の安全性構成を取り込むシナリオ:
-
後でコピー: これは、以前に フォーム でコピーした場合 ( イベント グループのコピー または イベントのコピー を使用)、または最初に安全性構成を含めずに フォームのコピー を使用した場合に実行されます。変更を加えて更新 をチェックする必要があります。このシーケンスは、フォーム調整の場合など、「適合するもの」をコピーします。ここで、AE フォームはターゲットスタディにすでに存在します。
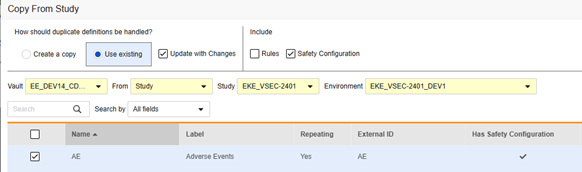
フォームの安全性構成をコピーするには:
- Stutio>フォームへ移動します。
- 試験からコピーをクリックします。
- 必要に応じて、 コピーを作成 または 既存のものを使用/変更を加えて更新 を選択します(上記の例を参照)。
- フォームに関連付けられた安全性構成の設定もコピーするには、安全性構成チェックボックスを選択します。Vault は、ダイアログの [安全設定あり] 列に、どのフォームに安全設定があるかを示します。これには、安全設定の管理権限を持つスタディロールが必要です。ソース スタディとターゲット スタディの安全性構成が一致しない場合は、 安全性構成 チェックボックスは 無効 になります。両方で設定されていて、同じ 安全性統合タイプを使用している必要があります。
- Vault を選択します。
- 試験からコピーの場合、コピー元を選択します (他の試験からまたはライブラリから。)
- コピー元となる試験環境を選択します。
- 検索またはスクロールして、コピーしたい フォーム定義 を探します。
- コピーしたい フォーム を選択します。
- フォームをコピーをクリックします。Vault は、試験に対してフォーム定義のコピーを開始します。
- 任意の作業: 試験からコピーダイアログで以下を行います:
- サマリーを表示をクリックして、コピー済みのフォームおよびコピーのステータスを確認します。
- コピーした フォーム が 20 個以下の場合、ログを表示 をクリックすると、コピーした各オブジェクトレコードの詳細なステータス情報が表示されます。
- フォームを 20 個以上コピーした場合、Vault は完了時にログファイルをダウンロードするためのリンクをメールで通知します。
- 終わったら、閉じるをクリックします。閉じるをクリックすると、サマリーまたはログファイルにアクセスできなくなります。
- コピー後は必ずコピーしたフォームの安全フォーム設定を参照してください。マッピング/値の変換の調整が必要になる場合があります。
コピーフォームの詳細については、「 デザインのコピー」を参照してください。
ソース スタディとターゲット スタディのSafety性設定が一致しない場合は、 Safety性設定 チェックボックスは 無効 になります。両方で設定されていて、同じ Safety性統合タイプを使用している必要があります。
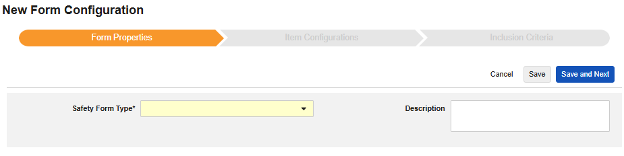
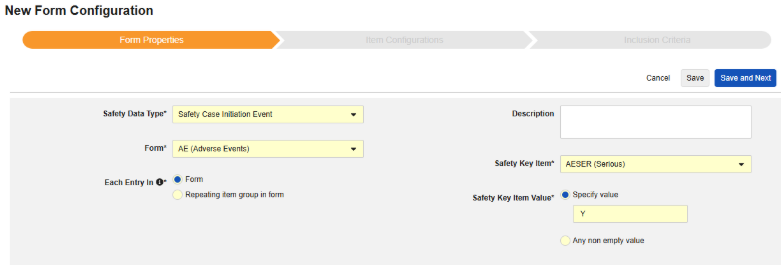
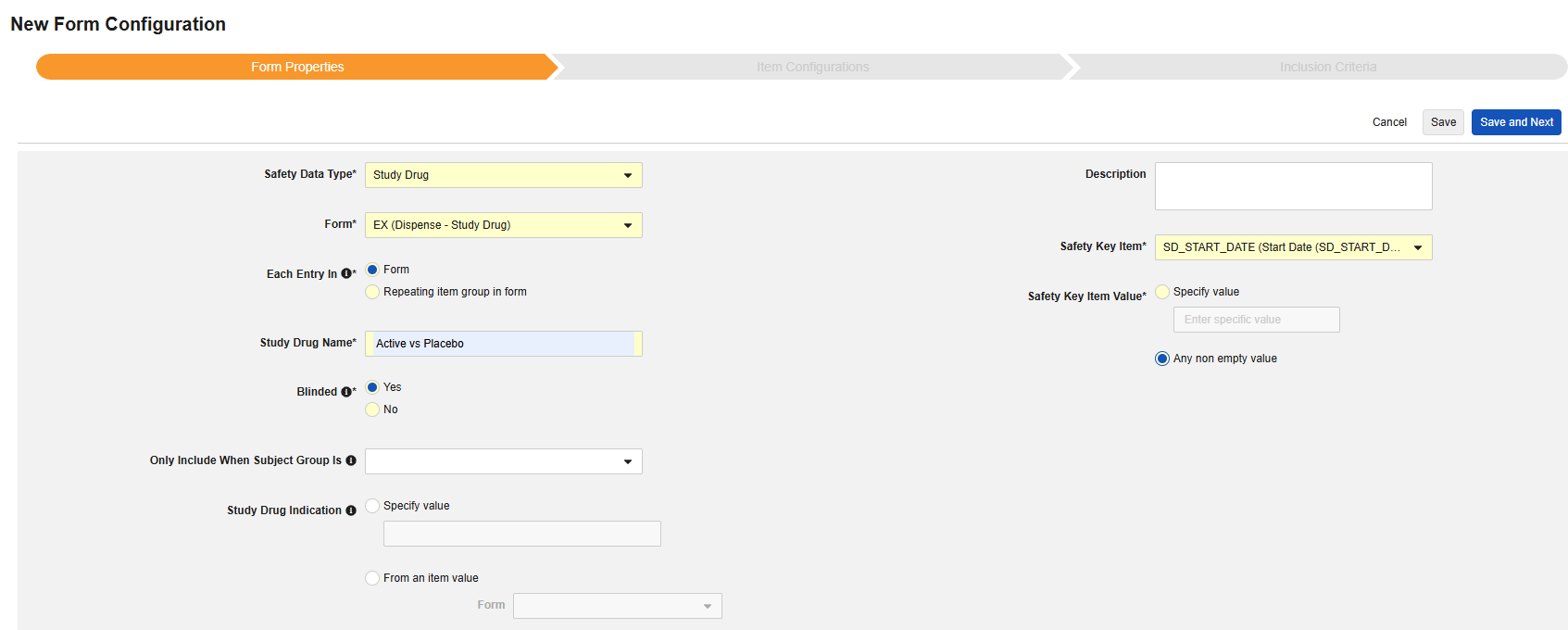
フォームのプロパティ
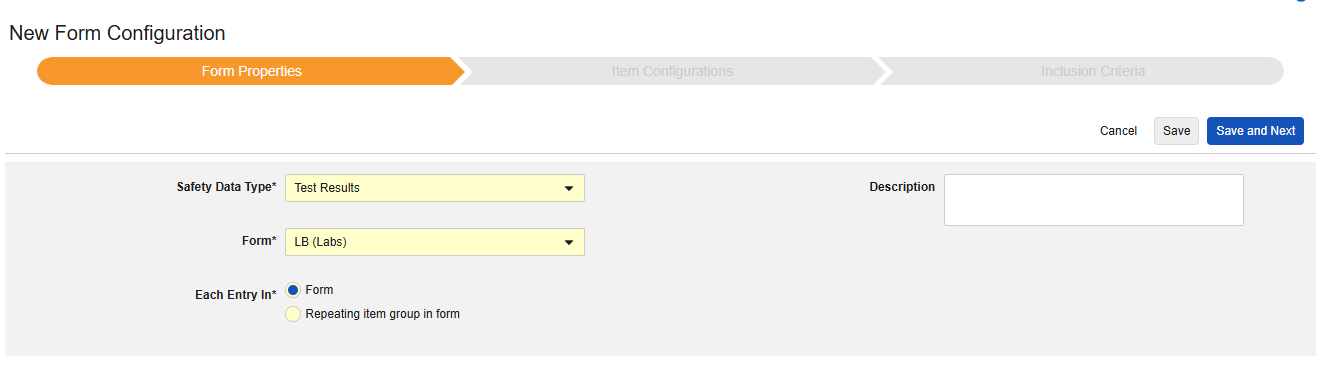
Safetyフォーム構成の最初のステップは、 フォームのプロパティです。ドロップダウンから Safety Type を選択すると、構成に関する一般的なプロパティが適用されます。使用可能なプロパティはSafety Typeによって異なります。
| 安全性データタイプ | プロパティ | |||||
|---|---|---|---|---|---|---|
| フォーム | Safety キーアイテム | 各エントリイン | 製品情報 | システムコメントの宛先 | 説明 | |
| 安全性ケース開始イベント | * | * | * | |||
| 治験薬 | * | * | * | * | ||
| 併用薬 | * | * | ||||
| 病歴 | * | * | ||||
| 薬歴 | * | * | ||||
| 検査結果 | * | * | ||||
| 患者特性 | * | |||||
| 死亡例 | * | |||||
| システム別報告者 / 送信者コメント | * | * | ||||
|
* このプロパティが Safety Data Type に必須であることを示します。 このプロパティが Safety Data Type にオプションであることを示します。 |
||||||
- フォーム では、安全性関連項目へのマッピングのために EDC フォームを選択する必要があります。
- 安全性キーアイテム は、他の基準よりも先にフォームがケースの開始または包含の対象として考慮されるかどうかを評価する特別なプロパティです。Safety Case 開始イベント タイプの場合、ケース全体の初期送信 (または後の無効化) を駆動します。研究薬 タイプの場合、これは他の日付ベースの基準が評価される前の、包含するための初期基準です。
- 各エントリイン は、EDC フォームの設計に基づいて情報をさまざまな安全性データタイプにグループ化するための設定を示します。例と詳細については次のセクションを参照してください。適切な安全性構成のためには、これを理解することが非常に重要です。
- 製品情報 は、試験の既知の治験薬、名前、盲検化(または非盲検化)、適応症、適用される研究グループに関する情報です。
- システム コメントの送信先 は、標準化された方法で、システムによる報告者/送信者コメント経由の EDC データの転送にのみ適用されます 。
- 説明 は、スタディデザイナーにとって役立つオプションのテキストです。
各エントリイン - 設計上の考慮事項
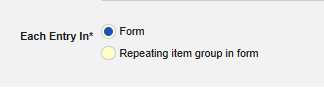
定義
安全性フォーム設定の フォーム プロパティ における 「各エントリイン」 の概念は、データ転送の設定の鍵となります。 これは、Veeva EDC に対して、(繰り返し)フォーム上のデータまたはフォーム上の繰り返しアイテムグループのデータを考慮するように具体的に指示します。このオプションには 2つの選択肢があります。
- フォーム: 繰り返しのないアイテム グループのフォームに入力されたデータは転送対象として考慮されます。フォームは、たとえば調査で複数のイベントを許可するなどのために繰り返すことができますが、フォーム上のアイテムグループは繰り返すことはできません。
- フォーム内の繰り返しアイテムグループ: フォーム上の繰り返しアイテムグループに入力されたデータは転送対象として考慮されます。この場合、複数のイベントはフォームの繰り返しではなく、アイテム グループの各繰り返しによって表されます。
フォーム上の一部の項目構成では、各エントリイン フォーム プロパティから利用可能な選択肢が異なります。 このタイプのほとんどのアイテム構成は「単一エントリ」として意図されていますが、一部の外れ値は非繰り返しのみ、または制限なし(繰り返しアイテムまたは非繰り返しアイテム)である必要があります。外れ値の詳細については、このドキュメントの後半にあるタイプ別のサブセクションを参照してください。アイテム構成については を参照してください。
各エントリイン: フォーム
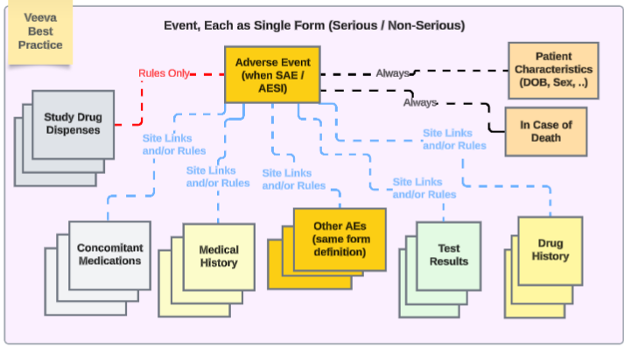
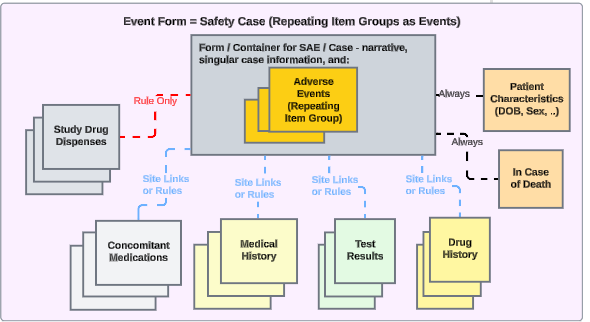
安全性統合によるスタディデザインに関する Veeva のベスト プラクティスでは、さまざまな安全性タイプ全体で繰り返しフォームを使用することが推奨されています。
この例では、
- 有害事象フォーム は、重篤でなくても重篤であっても、同じフォーム デザインを使用します。これにより、施設 ユーザのアップグレード/ダウングレードの問題が回避され、ある場所 (非重篤な AE フォーム) から別の場所 (重篤な SAE フォーム) に移動する必要がなくなり、その逆も回避されます。
- 複数の安全性事例を EDC ユーザが管理する必要がある場合は、日付ルールや特定の施設 リンクを使用して、他の重大または非重大なイベントをプライマリイベントに含めるようにします。
-
その他のSafety性データ タイプは、単一の回答情報 (患者特性 および 死亡の場合) を除き、それぞれ繰り返し形式です。この意味での「繰り返し形式」とは、次のいずれかであることに注意してください。
- フォームは繰り返しとして定義されます(例:ログフォーム)
- または、試験訪問スケジュール全体で使用される非反復形式です(例: 試験薬 が訪問1、次に訪問2で使用されるなど)。
- 治験の必要性に応じて、施設の意見(リンク)や日付に基づく包含ルールに、さまざまなタイプにわたる適切な関連データを含めることができます。
この設定を使用した治験例と、スタディデザインのフォームに適用される安全性データタイプ:
各エントリイン: 繰り返しアイテムグループ対フォーム
この試験を、 各エントリイン の両方のオプションを使用する例として考慮してください。
-
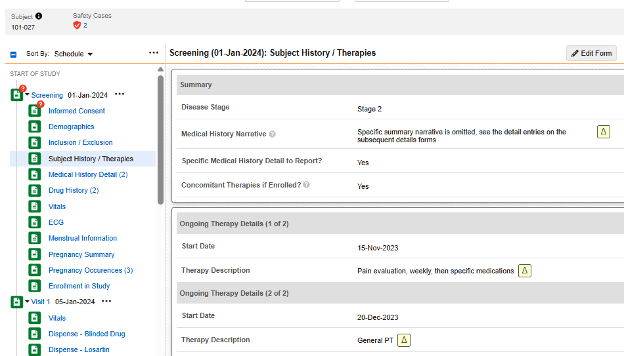
フォーム 被験者の履歴/治療法 では、最初の項目グループで、繰り返しのない質問がいくつか尋ねられます。
- 「報告する特定の病歴の詳細はありますか? 」という質問に はい と回答すると、フォーム送信時の動的ルールによってスケジュールの次のフォームである病歴の詳細 が開きます。そこに入力されたフォームには、フォームごとに病歴のエントリが含まれます。
- 「 登録されている場合、併用Medical療法はありますか? 」に「 はい 」と回答すると、プログレッシブ表示を使用して、同じフォーム上に繰り返しアイテムグループが表示されます。病歴のエントリは、必要に応じて、同じフォーム内の繰り返しアイテムグループとしてそれぞれ入力されます。
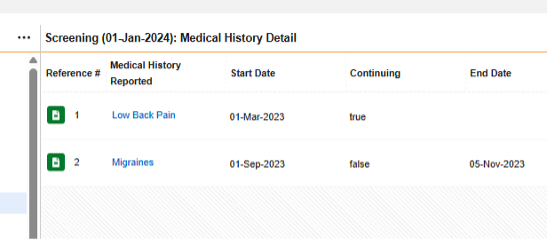
-
フォーム 病歴の詳細 は繰り返しますが、繰り返しのないアイテムグループ/質問はすべてそのデザインに含まれているため、 各エントリ = フォーム
-
上に示した例では、Safetyケースに 4つの病歴があるとみなされるSafety構成は次のとおりです。
- フォーム CTHERAPY (被験者の病歴/治療法):
- タイプ = 病歴
- エントリイン = フォーム内の繰り返しアイテムグループ
-
フォーム MH (病歴の詳細):
- タイプ = 病歴
- 各エントリイン = フォーム
- フォーム CTHERAPY (被験者の病歴/治療法):
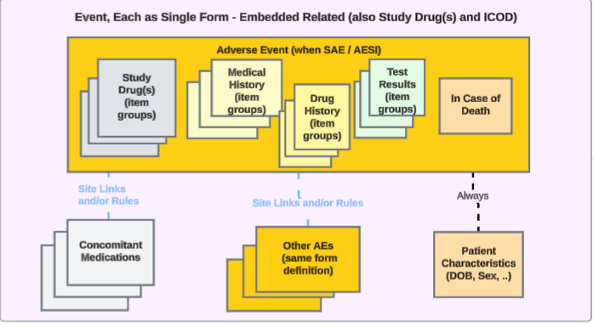
各エントリ: イベントフォームに埋め込まれた関連Safetyデータ
Safetyケース開始イベント フォームにイベント関連のSafetyデータが埋め込まれている研究の場合、アプローチは次のようになります。
イベント フォームに埋め込まれた項目グループは、繰り返し項目グループとして研究薬の調剤、薬物履歴、病歴、または検査結果をカバーし、非繰り返し項目グループとして死亡の場合をカバーできます。この場合、この埋め込みデータのスタディデザインではスタンドアロンフォームは設定されません。
施設ユーザーが関連情報を入力できるような研究設計で、イベントが安全性ケースを開始する場合に安全性関連データを転送するには、 安全性ケース開始イベント データ タイプにすでにマップされている EDC フォームを、 併用薬、 病歴、 薬歴、 研究薬、 検査結果、 死亡時などの他の安全性データ タイプにマップすることができます。
- 安全性ケース開始イベント または 患者特性 安全性データ タイプには埋め込みデータを構成できないことに注意してください。システムごとの報告者/送信者コメントデータタイプは、安全性症例開始イベントデータタイプでの二重使用をすでにサポートしています。
- 安全性症例開始イベントデータタイプにすでにマッピング済みの EDC フォームが別の安全性データタイプにマッピングされる場合、各入力エントリフィールドが、フォーム内の繰り返し項目グループを自動選択するようになりました。
- 死亡の場合、患者特性、およびシステムごとの報告者/送信者コメントの各入力エントリフィールドは、このフィールドに対してフォームオプションのみが許可されます。
各エントリ: 繰り返しアイテムグループ対フォーム
1 つの EDC フォーム設計で安全性ケース内の複数のイベントを追跡する研究の場合、アプローチは次のようになります。
- 安全性ケースは、イベントを含むフォームが存在するだけで開始されます。
- このスタディデザインでは、各エントリイン を フォーム内の繰り返しアイテムグループ に設定する必要があります。
セーフティキーアイテム / 値
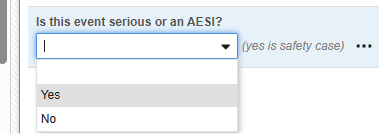
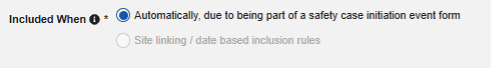
フォーム プロパティ 設定の セーフティキーアイテム および セーフティキーアイテム値 は、ケースの開始またはケースへのフォームの組み込みを評価します。これらは次の安全性タイプに適用されます:
- 安全性ケース開始イベント - システム評価が 真の場合、安全システムへの最初の転送が開始されます。逆に、システムが評価を 偽 と判断し、性ケースが送信されていた場合、 無効化 が安全システムに送信されます。
- 治験薬 - システム評価が 真の場合、フォーム上の調剤情報はケースに含めるのに適格であるとみなされます。治験薬の組入基準をさらに評価することで、安全性ケースとのデータ転送が最終的に決定されます。
Safetyキー項目値 を コードリスト に参照するには、コードリスト ラベルではなく、コードリスト コードの指定が必要になることに注意してください。
安全性ケース開始イベント タイプの一般的な例をいくつか示します。
例 1:
-
Safetyキー項目 は コードリスト項目 「AESER」を参照し、 コードリストコード 「Y」によってSafetyケースが開始されることを期待します。
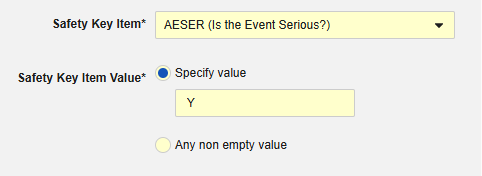
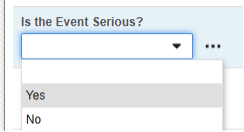
Safetyキー項目 とは、AE フォームの次の項目を指します。Safetyキー項目値 には コードリスト コード が必要ですが、サイト ユーザーは コードリスト ラベルから選択することに注意してください。
- この規定の回答を記載したフォームを最初に 送信 すると、フォームと関連データの安全な転送が可能となります。
- 転送は、運用調査設定で設定されたタイミングで実行されます。詳細については こちらを参照してください。
- さらに、転送を続行するには、E2B フィールド E.i.1.1a (一次情報源によって母国語で報告された反応/イベント) のフォームにも空でない値が設定されている必要があります。
- この例では、有害事象フォームの 重大な質問 を使用して、安全性ケースを送信するかどうかを決定します。このフィールドは、どの調査/フォーム設計でも、通常はE2Bロケーション E.i.3.1 (報告者によって強調表示された用語)にマッピングされます。
最初に安全性システムに送信されてからしばらく経つと、これらの条件のどちらも満たされなくなります。(例: Serious = No、またはイベント レポーター/イベント Term 値がない)。そうであれば、システムは自動的に安全システムに 無効化 フォローアップを送信し、安全ケースとして適格ではなくなったことを示します。施設 ユーザがフォーム データを変更すると、安全性の統合に関して特別な施設 アクションは必要ありません。
例 2:
- 最初の例では、E2B の場所 (E.i.3.1) を Safetyキー項目 として使用しました。ただし、E2B フィールドにマッピングするために使用されていないフィールドであっても、任意のフィールドをこの目的に使用できます。
- この例では、代わりに AE フォームからのより一般的な質問を使用します。
これはフォーム上の主要な重大な質問ではありませんが、重大な有害事象と「特に注目すべき有害事象」(AESI) の両方について安全性ケースを開始することができます。これらの有害事象は重大ではない可能性がありますが、それでも安全性システムにデータを送信する必要があります。
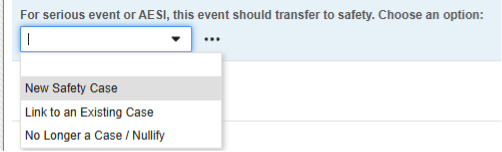
例 3:
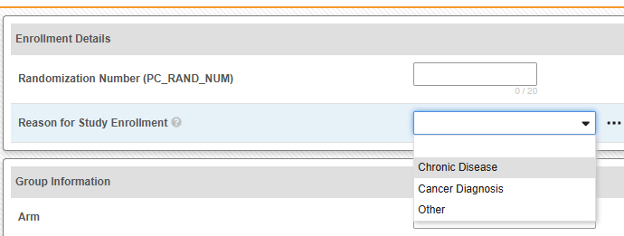
- 次の例では、1 つの Safetyキー項目値を使用しながら、Safetyケースの開始と無効化がサイトユーザーにとってより透過的になっています。
-
このコードリストの選択肢:
- 「新しいSafetyケース」(そのコードリスト コード) は、 Safetyキー項目値に使用されます。したがって、この選択によってのみ安全性ケースが開始されます。
- 「既存のケースへのリンク」- 回答すると、このコードは Safety キー項目値 を false として評価されます。したがって、フォームはスタンドアロン/追加のケースを開始しません。代わりに、Studio ルールを使用して、サイト ユーザーが現在のフォームを、安全性ケースを開始した別のイベントにリンクしていることを確認します。
- 「対象外..」- 以前は安全性ケースの対象となっていたが、転送されたイベントに使用されます。サイト ユーザーがダウングレードまたは無効化を示す場合、EDC システムはこの選択のコードリスト コードを false と評価します。これにより、以前に開始された安全性ケースの 無効化 フォローアップが行われます。
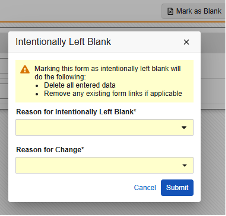
無効化
安全性ケース内のデータに変更が発生するたびに、Veeva EDC からフォローアップが複数送信されます 。無効化 は、次のような特性を持つ特別な種類のフォローアップです。
-
これは、次のいずれかが該当する場合に発生します。
- 安全性キー項目および安全性キー項目値の評価が偽になります
- または、EDCフォームの E.i.1.1a の項目の値が 空になる
- これは 無効化 型E2Bメッセージとして記録されます
- これは 安全システムへの安全ケースの最後の送信です
- 注: このケースの最初の送信は以前に発生しました。Veeva EDC は、最初の送信時 (つまり、最初の送信タイマーの後) に上記の 2 つの条件を再評価し、安全性システムに送信せずに安全性ケースを直ちに無効化します。これは、最初の送信のタイマーが終了する前に、施設 ユーザがミスをしたり、フォームをリセットしたりした場合に最もよく発生します。
- E2B では、このような転送には無効化の理由が必要です。試験は、施設ユーザに情報を求めるように設定できます。サイト回答が設定されていない場合、またはサイトが回答に失敗した場合、システムはデフォルトの理由を使用します:「ケースは、最初に送信されたときの条件を満たさなくなりました。」これには、現在では重大ではないイベントに格下げされたイベントや、ユーザー操作によってすべてのイベントが削除されることが含まれます。"
無効化の一般的な例:
-
「ダウングレード」、例えば、以前は Safety キー項目/値を介して安全性ケースを満たしていた状況は、もはや満たされていないが、イベントは依然として継続している。
Veeva EDC で安全性ケースの無効化が発生すると、アクティブな安全性ケースには戻りません。 同じフォームを変更して、 Safetyキー項目/値 を true にし、 E.i.1.1a の値が空でないようにすると、新しい安全性ケースが作成され、送信されます。元の安全性ケースは再開されません。
安全性データタイプによる
安全性ケース開始イベント
この安全性データ タイプのフォーム設定は、安全性ケースの転送プロセスを開始するために重要です。その後、他のすべての安全性データ タイプは、設定されたルールに従ってケースに組み込まれます。
このタイプの新しいSafetyフォーム構成を作成するには:
- スタディの スタジオ >> フォーム設定 に進みます。
- + 新規フォーム設定をクリックします。
- 安全性データタイプに対して、安全性ケース開始イベントを選択します。
- この構成タイプに適用する ためのフォーム を選択します。
- 各エントリに適切な選択肢を選択します。この選択はフォームのデザインによって異なります。詳細情報と例については、 「設計上の考慮事項」の各項目 を参照してください。
- オプションで 説明を指定します。
- 適切な Safetyキー項目 / Safetyキー項目値を指定します。注意: コードリスト項目の定義では、 コードリスト コード を指定する必要があります。
- 保存して次へをクリックします。
Safetyデータ タイプ、 フォーム、 各エントリ設定 は、保存後は編集できなくなります。[アイテム構成] タブと [包含基準] タブでの追加構成は、これらの設定に依存します。これらの設定のいずれかを変更するには、フォーム構成を削除して再度作成する必要があります。
治験薬
この安全性データ タイプは、臨床試験で被験者に対してテストされている治験薬の投与量 / 調剤情報を追跡するために使用されます。情報は、安全性ケースの製品/医薬品セクションに送られます。(E2BのG.*セクション)。このタイプでは複数のフォームを使用できます。
このタイプの新しいSafetyフォーム構成を作成するには:
- スタディの スタジオ >> フォーム設定 に進みます。
- + 新規フォーム設定をクリックします。
- Safetyデータタイプのスタディ薬を選択します。
- この構成タイプに適用する フォーム を選択します。
- 各エントリに適切な選択肢を選択します。この選択はフォームのデザインによって異なります。詳細情報と例については、 「設計上の考慮事項」の各項目 を参照してください。
- 注意: 安全ケース開始イベントにすでにマップされている EDC フォームが選択されている場合、 「各エントリイン」 はデフォルトで 「フォーム内の繰り返し項目グループ」になります。
- 試験薬名を記入してください。重要: この値は通常、対象の安全性システムで薬剤が命名されている方法と直接一致する必要があります。E2B の G.* 位置における試験薬の転送の処理方法については、対象安全性システムのドキュメントを参照してください。
-
試験において、試験薬が 盲検化 されているか(またはされていないか)を示します。このプロパティは単なる指標であり、レポート目的でのみ使用されます。EDC のデータに制限が適用されている場合でも、すべてのデータは安全性システムに非盲検で転送されます。
-
オプションで、この研究薬のみが適用されるスタディデザイン内の 被験者グループ を選択します。この設定により、グループに含まれない被験者については、研究薬が安全性移管から除外されます。
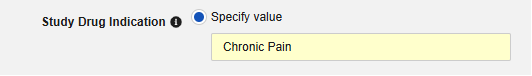
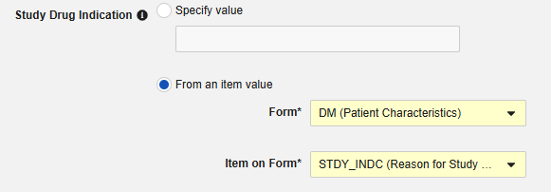
- オプションで、被験者のすべてのケースに適用する 試験薬の適応 を指定します。次の 2つを選択できます:
- オプションで 説明を指定します。
- 適切な Safetyキー項目 / Safetyキー項目値を指定します。研究薬の種類については、評価はデータ移行に含めるのに適格なフォーム/調剤を検討するために使用されます。安全性ケースに適切な試験薬の調剤を含めるために、追加の包含基準( 試験薬包含基準を参照)も評価されます。
- 保存して次へをクリックします。
Safetyデータ タイプ、 フォーム、 各エントリ設定 は、最初に保存された時点での読み取り専用となります。[アイテム構成] タブと [包含基準] タブでの追加構成は、これらの設定に依存します。これらの設定のいずれかを変更するには、フォーム構成を削除して再度作成する必要があります。
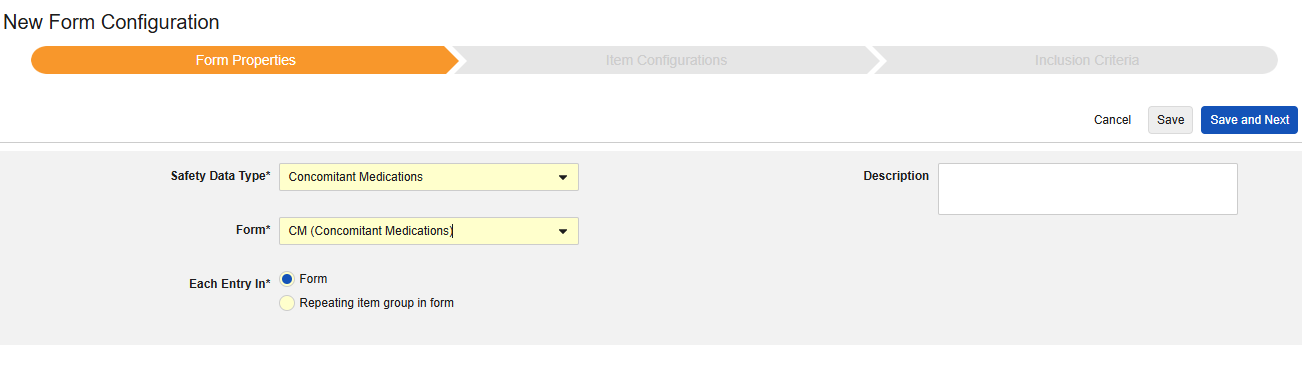
併用薬
このタイプの安全性構成は、治験の併用薬形態に適用されます。情報は、安全性ケースの製品/医薬品セクションに送られます。(E2B の G.* セクション) タイプでは複数の形式を使用できます。
このタイプの新しいSafetyフォーム構成を作成するには:
- スタディの スタジオ >> フォーム設定 に進みます。
- + 新規フォーム設定をクリックします。
- Safetyデータタイプの併用薬を選択します。
- この構成タイプに適用する フォーム を選択します。
- 各エントリに適切な選択肢を選択します。この選択はフォームのデザインによって異なります。詳細情報と例については、 「設計上の考慮事項」の各項目 を参照してください。
- 注意: 安全ケース開始イベントにすでにマップされている EDC フォームが選択されている場合、 「各エントリイン」 はデフォルトで 「フォーム内の繰り返し項目グループ」になります。
- オプションで 説明を指定します。
- 保存して次へをクリックします。
Safetyデータ タイプ、 フォーム、 各エントリ設定 は、最初に保存された時点での読み取り専用となります。[アイテム構成] タブと [包含基準] タブでの追加構成は、これらの設定に依存します。これらの設定のいずれかを変更するには、フォーム構成を削除して再度作成する必要があります。
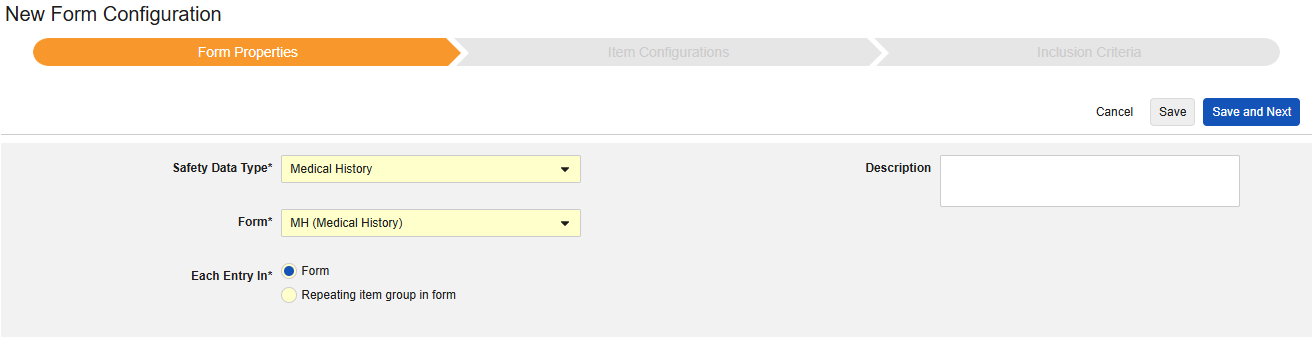
病歴
このタイプの安全性構成は、研究の併用薬形態に適用されます。情報は、安全性ケースのE2B D.7セクションに送られます。このタイプでは複数のフォームを使用できます。
このタイプの新しいSafetyフォーム構成を作成するには:
- スタディの スタジオ >> フォーム設定 に進みます。
- + 新規フォーム設定をクリックします。
- 安全性データタイプの治療歴を選択します。
- この構成タイプに適用する フォーム を選択します。
- 各エントリに適切な選択肢を選択します。この選択はフォームのデザインによって異なります。詳細情報と例については、 「設計上の考慮事項」の各項目 を参照してください。
- 注意: 安全ケース開始イベントにすでにマップされている EDC フォームが選択されている場合、 「各エントリイン」 はデフォルトで 「フォーム内の繰り返し項目グループ」になります。
- オプションで 説明を指定します。
- 保存して次へをクリックします。
Safetyデータ タイプ、 フォーム、 各エントリ設定 は、最初に保存された時点での読み取り専用となります。[アイテム構成] タブと [包含基準] タブでの追加構成は、これらの設定に依存します。これらの設定のいずれかを変更するには、フォーム構成を削除して再度作成する必要があります。
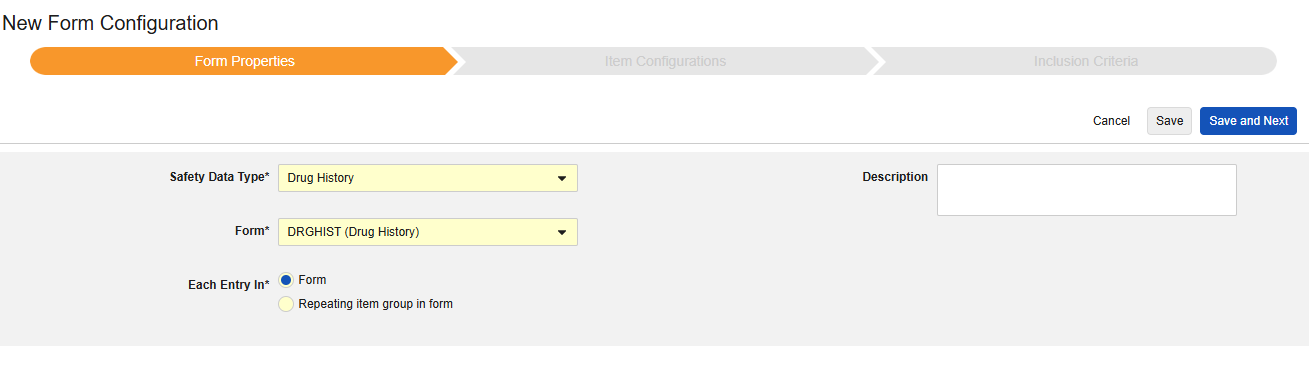
薬歴
このタイプの安全性構成は、治験の薬歴フォームに適用されます。情報は、安全性ケースの E2B D.8セクションに送られます。
このタイプの新しいSafetyフォーム構成を作成するには:
- スタディの スタジオ >> フォーム設定 に進みます。
- + 新規フォーム設定をクリックします。
- Safetyデータタイプで薬歴を選択します。
- この構成タイプに適用する フォーム を選択します。
- 各エントリに適切な選択肢を選択します。この選択はフォームのデザインによって異なります。詳細情報と例については、 「設計上の考慮事項」の各項目 を参照してください。
- 注意: Safetyケース開始イベントにすでにマップされている EDC フォームが選択されている場合、 各エントリイン はデフォルトで フォーム内の繰り返し項目グループになります。
- オプションで 説明を指定します。
- 保存して次へをクリックします。
Safetyデータ タイプ、 フォーム、 各エントリ設定 は、最初に保存された時点での読み取り専用となります。[アイテム構成] タブと [包含基準] タブでの追加構成は、これらの設定に依存します。これらの設定のいずれかを変更するには、フォーム構成を削除して再度作成する必要があります。
検査結果
このタイプの安全性構成は、治験のラボ / 検査結果フォームに適用されます。情報は、SafetyケースのE2B F.*セクションに送られます。このタイプでは複数のフォームを使用できます。
現在、システムは E2B 試験のローカル ラボ モジュール フォーム (ラボ パネル) へのマッピングをサポートしていません。
このタイプの新しいSafetyフォーム構成を作成するには:
1.スタディの スタジオ >> フォーム設定に進みます。
- + 新規フォーム設定をクリックします。
- Safety データ タイプとしてテスト結果を選択します。
- この構成タイプに適用する フォーム を選択します。
- 各エントリに適切な選択肢を選択します。この選択はフォームのデザインによって異なります。詳細情報と例については、 「設計上の考慮事項」の各項目 を参照してください。
- 注意: 安全ケース開始イベントにすでにマップされている EDC フォームが選択されている場合、 「各エントリイン」 はデフォルトで 「フォーム内の繰り返し項目グループ」になります。
- オプションで 説明を指定します。
- 保存して次へをクリックします。
Safetyデータ タイプ、 フォーム、 各エントリ設定 は、最初に保存された時点での読み取り専用となります。[アイテム構成] タブと [包含基準] タブでの追加構成は、これらの設定に依存します。これらの設定のいずれかを変更するには、フォーム構成を削除して再度作成する必要があります。
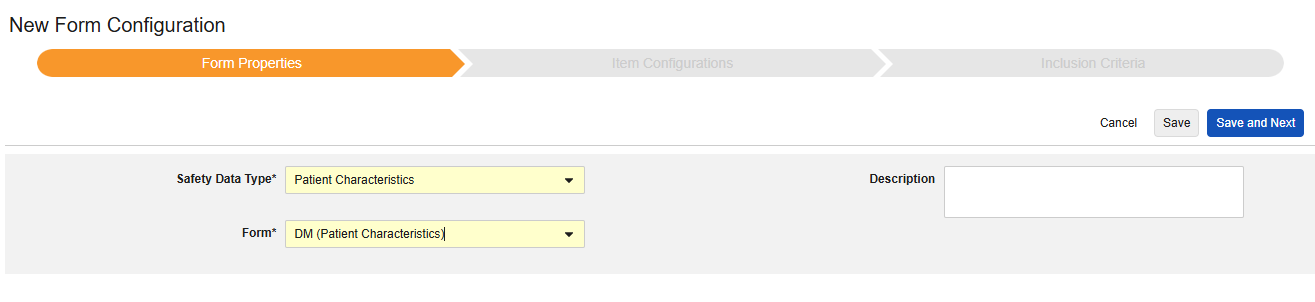
患者特性
このタイプの安全性構成は、対象に関する一般的な情報に適用されます。このタイプには、繰り返しのないアイテム グループのアイテムのみをマップできます。さらに、これらの値は安全性ケースごとに 1 回だけ使用されるため、対象のケースブック全体で複数回発生することはありません。タイプには複数のフォームを使用できます。たとえば、1つのフォームでは 性別 、別のフォームでは 生年月日 などです。
このタイプの新しいSafetyフォーム構成を作成するには:
1.スタディの スタジオ >> フォーム設定に進みます。
- + 新規フォーム設定をクリックします。
- 安全性データタイプの症例特性を選択します。
- この構成タイプに適用する フォーム を選択します。
- オプションで 説明を指定します。
- 保存して次へをクリックします。
Safetyデータ タイプ、 フォーム、 各エントリ設定 は、最初に保存されると一度だけ読み取り可能となります。[アイテム構成] タブと [包含基準] タブでの追加構成は、これらの設定に依存します。これらの設定を変更するには、フォーム構成を削除して再度作成する必要があります。「各エントリイン」はこのタイプではオプションではありません。
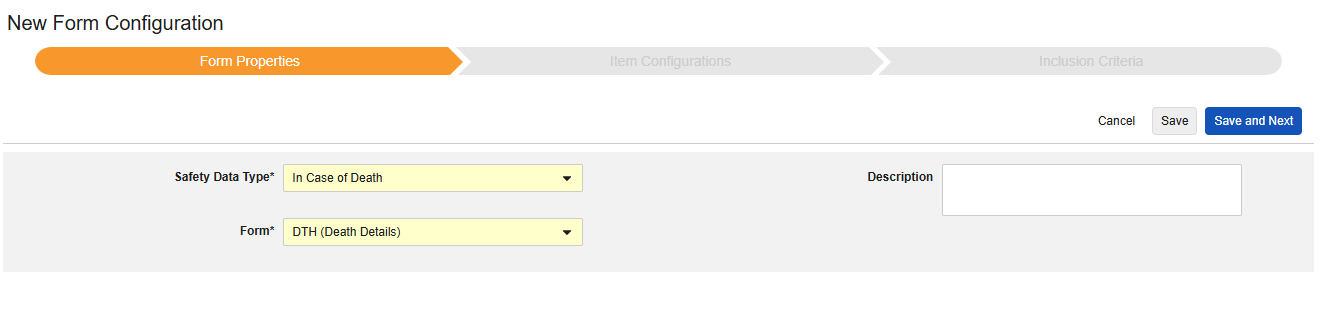
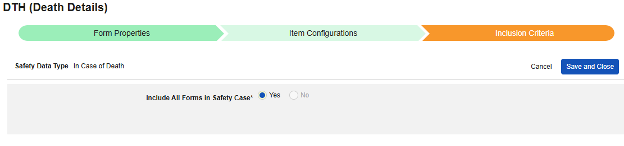
死亡例
このタイプの安全性構成は、対象者の死亡に関する詳細情報を含むフォームに適用されます。このタイプの一部のフィールドは繰り返し不可(例: 死亡日)ですが、その他のフィールドは繰り返しまたは非繰り返し(死因)にすることができます。タイプには複数のフォームを使用できます。たとえば、1つのフォームでは 性別 、別のフォームでは 死亡年月日 などです。
このタイプの新しいSafetyフォーム構成を作成するには:
1.スタディの スタジオ >> フォーム設定に進みます。
- + 新規フォーム設定をクリックします。
- Safetyデータタイプの死亡例を選択します。
- この構成タイプに適用する フォーム を選択します。
- 注意: 安全ケース開始イベントにすでにマップされている EDC フォームが選択されている場合、 「各エントリイン」 はデフォルトで 「フォーム」になります。
- オプションで 説明を指定します。
- 保存して次へをクリックします。
Safetyデータ タイプ、 フォーム、 各エントリ設定 は、最初に保存されると一度だけ読み取り可能となります。[アイテム構成] タブと [包含基準] タブでの追加構成は、これらの設定に依存します。これらの設定を変更するには、フォーム構成を削除して再度作成する必要があります。「各エントリイン」はこのタイプではオプションではありません。
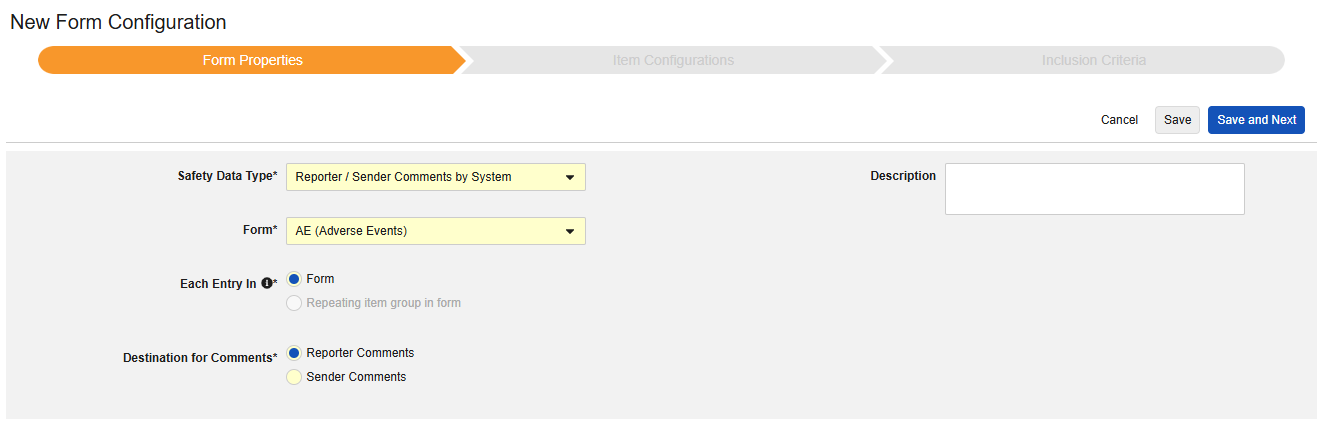
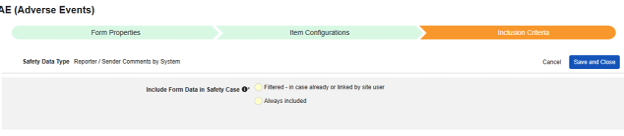
システム別報告者 / 送信者コメント
このタイプの安全構成は、ケースブック内の任意のフォームに適用できます。システムによる報告者/送信者コメント 機能は、E2B 形式のどこにも適合しないデータの転送用に特別に設計されています。
このタイプの新しいSafetyフォーム構成を作成するには:
- スタディの スタジオ >> フォーム設定 に進みます。
- + 新規フォーム設定をクリックします。
- 安全性データタイプでシステム別報告書/送信者コメントを選択します。
- この構成タイプに適用する フォーム を選択します。
- オプションで 説明を指定します。
- コメントの宛先を選択します。「報告者コメント」を選択すると、情報が E2B の H.2 の場所に送信されます。 送信者コメント は情報をE2B H.4 の場所に転送します。H.2とH.4は、安全ケース開始イベントフォームの項目に設定することもできます。その場合、サイトで入力された情報がシステムで生成された情報に先行し、明確に区別することができます。
. - 保存して次へをクリックします。
Safetyデータ タイプ、 フォーム、 各エントリ設定 は、最初に保存されると一度だけ読み取り可能となります。[アイテム構成] タブと [包含基準] タブでの追加構成は、これらの設定に依存します。これらの設定を変更するには、フォーム構成を削除して再度作成する必要があります。「各エントリイン」はこのタイプではオプションではありません。
項目設定
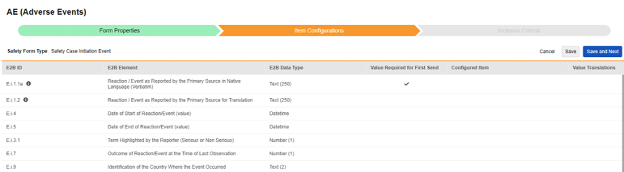
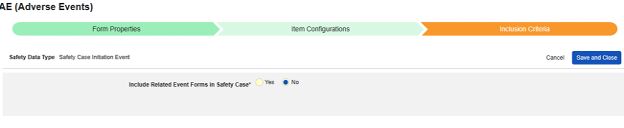
安全フォーム構成の 2 番目の手順は、 [アイテム構成] タブです。例として、この AE (有害事象) フォーム デザインは、 Safetyケース開始イベント タイプに分類されています。
このグリッドの目的は、フォーム デザイン (項目定義) からの回答を E2B 形式の適切な場所に割り当てることです。
グリッド内の列の概要:
| 列 | メモ |
|---|---|
| E2B ID | これは E2B(R3)の場所です。 |
| E2B 要素 | E2Bロケーションラベル |
| E2B アイテムタイプ | その E2B ロケーションのデータ型。
|
| 最初の送信に必須の値 |
|
| 設定済み項目 |
フォーム上の繰り返しアイテム グループを使用する場合は、エントリを構成するすべてのアイテム定義 (例: 病歴、検査など) が 同じ繰り返しアイテム グループ内にあることを確認してください。一部の E2B の場所は同じ繰り返しアイテム グループの外側にある場合もありますが、これはまれな例外です。これらの外れ値については、このセクションの後のタイプ別詳細を参照してください。 |
| # 値の翻訳 |
|
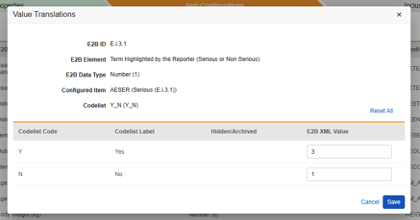
値の翻訳
E2B の場所にマッピングされる アイテム定義 がコードリストまたはブール値 (チェックボックス) データ型であり、E2B の場所に非常に具体的な E2B 値が必要な場合は、転送が正しく機能するように 値の翻訳 を設定する必要があります。
- 構成済みアイテム 列に アイテム定義 を指定します
-
構成済みアイテム 列の横にある 値の翻訳 列のセルをクリックします。値の翻訳を設定できる場合、セルにマウスを移動すると オレンジ色 で表示されます。
- コードリスト品目ごとに、フリーテキストフィールドにE2B XML 値を入力します。
- コードリスト コード が E2B ロケーションに対してすでに有効な場合は、 E2B XML 値を入力する必要はありません。
- 利用可能な E2B オプションよりも多くの コードリスト エントリが研究デザイン内に存在する場合、複数の コードリスト エントリを同じ E2B XML 値にマッピングできます。
- 無効な コードリスト コード が E2B XML 値に変換されない場合、スタジオ検証でエラーが表示されます。
- 終了したら、保存をクリックします。
- 値の翻訳が指定されると、構成された翻訳の数がセルに表示されます。
このアクションを実行すると、翻訳値は一時的にのみ保存されます。その後、タブ レベルで [保存] または [保存して次へ] を使用すると、翻訳が保存されます。
独自の標準に従って特定の値を必要とするすべての E2B ロケーションに対してこのアクションを繰り返します。Studio Validations ジョブは、これらのいずれかが欠落しているか、対象の E2B ロケーションに対して有効でない場合、エラー (デプロイメントの防止) を示します。これは、薬剤または検査結果の単位という 1つの例外を除き、厳密な E2B 値が既知/必要な場合に当てはまります。これらは、業界標準のユニットであっても、宛先の安全システムで特別な構成/プロファイルを必要とすることがよくあります。そのため、 Studio Validation ジョブは、ユニットである場所に対してのみ 警告 (実行ごとに)を報告します。
安全性データタイプによる
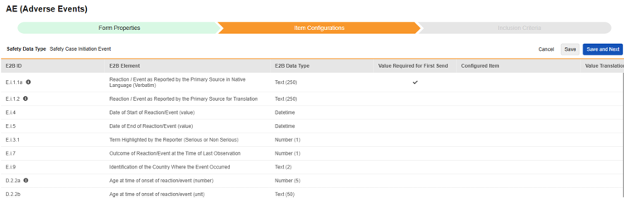
安全性ケース開始イベント
この安全タイプのアイテム構成を保存するには:
選択項目は通常、 各エントリ イン 設定が フォームのプロパティ> に保存されているかどうかに依存します (前の手順)。一部の E2B ロケーションには、繰り返しアイテム グループまたは非繰り返しアイテム グループのみで実行できる、あるいはその両方で実行できることを示す特別なルールがあります。それらの外れ値と、このタイプのすべての E2B 場所に関する重要な注意事項については、これらの手順の最後にある表を参照してください。
- スタディの スタジオ >> フォーム設定に進みます。
-
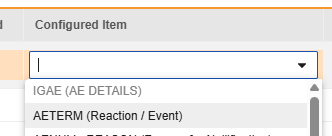
マッピングを意図する各行について、 構成アイテム 列のセルを使用して、 フォーム定義 の適切な アイテム定義を選択します。たとえば、E2B ロケーション E.i.1.1a において、フォームから AETERM 項目を選択します。
-
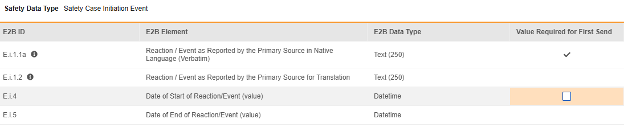
構成された各項目について、 初回送信に値が必要かどうかを指定します。すべての安全システムには空でない用語/値を持つイベントが少なくとも 1 つ必要なため、 E.i.1.1a は編集できません (チェックされています)。他の行/E2B ロケーションは通常このプロパティが設定されていません、デフォルトではチェックされていません。
- 選択したアイテムの アイテム定義 タイプと行の E2B ID に応じて、 値の翻訳 が必要になる可能性があります。値の翻訳を設定するための一般的な概要については、 こちらを参照してください。
- 「保存」 (ページに留まる場合)または 「保存して次へ」 (次のタブ「 包含基準」に進む場合)をクリックします。
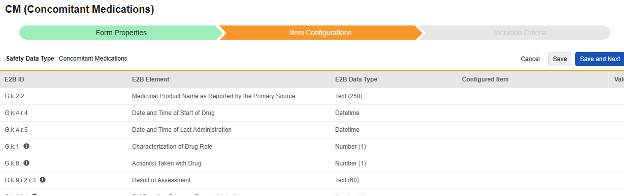
| E2B ID | E2B ラベル | E2B タイプ | メモ | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| E.i.1.1a | 一次情報源が母国語で報告した反応/出来事(逐語的に) | テキスト (250) |
|
||||||||||||||
| (E.i.2.1a) | 反応/イベントの MedDRA バージョン |
|
|||||||||||||||
| (E.i.2.1b) | 反応/イベント (MedDRA コード) |
|
|||||||||||||||
| E.i.1.2 | 翻訳の第一ソースで報告された反応/イベント | テキスト (250) |
|
||||||||||||||
| E.i.4 | 反応/イベントの開始日 (値) | 日時 |
|
||||||||||||||
| E.i.5 | 反応/イベントの終了日 (値) | 日時 |
|
||||||||||||||
| E.i.3.1 | 報告者が強調した用語(重大または非重大) | 数字 (1) |
|
||||||||||||||
| E.i.7 | 最終観察時点の反応/イベントの結果 | 数字 (1) |
|
||||||||||||||
| E.i.9 | イベントが起こった国の識別 | テキスト (2) |
|
||||||||||||||
| D.2.2a | 反応/イベント発現時の年齢 (数字) | 数字 (5) |
|
||||||||||||||
| D.2.2b | 反応/イベント発現時の年齢 (単位) | テキスト (50) |
|
||||||||||||||
| D.3 | 体重 (kg) | 数字 (6) |
|
||||||||||||||
| D.4 | 身長 (cm) | 数字 (3) |
|
||||||||||||||
| D.6 | 最終月経日 | 日時 |
|
||||||||||||||
| E.i.3.2a | 死亡に至る(Seriousness 基準) | ブーリアン |
|
||||||||||||||
| E.i.3.2b | 生命を脅かす(重篤度基準) | ブーリアン |
|
||||||||||||||
| E.i.3.2c | 入院の長期化(Seriousness基準) | ブーリアン |
|
||||||||||||||
| E.i.3.2d | 無力化/無能力化(重大性基準) | ブーリアン |
|
||||||||||||||
| E.i.3.2e | 先天異常(Seriousness Criteria) | ブーリアン |
|
||||||||||||||
| E.i.3.2f | その他の医学的に重要な状態(Seriousness Criteria) | ブーリアン |
|
||||||||||||||
| H.1 | 臨床経過、治療方針、転帰およびその他の関連情報を含むケース談話 | テキスト (100000) |
|
||||||||||||||
| H.2 | 報告者のコメント | テキスト (20000) |
|
||||||||||||||
| H.4 | 送信者のコメント | テキスト (20000) |
|
||||||||||||||
| C.1.11.2 | 無効化/修正の理由 | テキスト (2000) |
|
||||||||||||||
| E.i.6a | 反応/イベントの期間 (値) | 数字 (5) |
|
||||||||||||||
| E.i.6b | 反応/イベントの期間 (単位) | テキスト (50) |
|
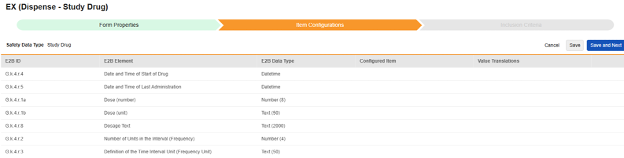
治験薬
現在、研究薬の名前 (G.k.2.2) は、Studio の [フォーム プロパティ] タブで設定されています。薬剤名の項目構成は、将来のリリースで利用可能になります。重要な G.k.1 (医薬品の分類) は、このタイプの EDC フォームにマッピングされている項目ではありません。代わりに、イベント開始日以前に少なくとも 1つの調剤フォームがある場合は、システムによって Suspect (E2B 値 1) が設定されます。調剤がない場合、システムによって 未投与 (E2B 値 4) が使用されます。
この安全タイプのアイテム構成を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
-
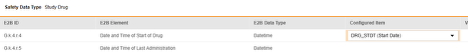
マッピングを意図する各行について、 構成アイテム 列のセルを使用して、 フォーム定義 の適切な アイテム定義を選択します。たとえば、E2B ロケーションG.k.4.r.4において フォームから DRG_STDT 項目を選択します。
- 選択したアイテムの アイテム定義 タイプと行の E2B ID に応じて、 値の翻訳 が必要になる場合があります。値の翻訳を設定するための一般的な概要については、 こちらを参照してください。
- 「保存」 (ページに留まる場合)または 「保存して次へ」 (次のタブ「 包含基準」に進む場合)をクリックします。
選択項目は通常、 各エントリ イン 設定が フォームのプロパティ> に保存されているかどうかに依存します (前の手順)。一部の E2B ロケーションには、繰り返しアイテム グループまたは非繰り返しアイテム グループのみで実行できる、あるいはその両方で実行できることを示す特別なルールがあります。これらの外れ値と、このタイプのすべての E2B 場所に関する重要な注意事項については、これらの手順の最後にある表を参照してください。
このタイプには、試験薬 と、それが安全性ケースおよびそのイベントとどのように関連しているかについての 3 つの重要な因果関係の質問 ( G.k.8 / G.k.9.i.2.r.3/ G.k.9.i.4 ) があります。これらの項目定義をマッピングするための選択肢は、 安全性ケース開始イベントにマッピングされた EDC フォームから取得されます。これらの質問への回答はケースごとに、イベントごとに異なり、イベント フォームで回答する必要があるためです。
| E2B ID | E2B ラベル | E2B タイプ | メモ | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| G.k.4.r.4 | 医薬品開始日時 | 日時 |
|
||||||||||||||||||||||||
| G.k.4.r.5 | 最終投与日時 | 日時 |
|
||||||||||||||||||||||||
| G.k.4.r.1a | 用量 (数字) | 数字 (8) |
|
||||||||||||||||||||||||
| G.k.4.r.1b | 一回用量 (単位) | テキスト (50) |
|
||||||||||||||||||||||||
| G.k.4.r.8 | 用量テキスト | テキスト (2000) |
|
||||||||||||||||||||||||
| G.k.4.r.2 | 間隔内の単位数(頻度) | 数字 (4) |
|
||||||||||||||||||||||||
| G.k.4.r.3 | 時間間隔単位(頻度単位)の定義 | テキスト (50) |
|
||||||||||||||||||||||||
| G.k.2.4 | 薬剤が取得された国の識別 | テキスト (2) |
|
||||||||||||||||||||||||
| G.k.4.r.10.1 | 投与経路 (自由テキスト) | テキスト (60) |
|
||||||||||||||||||||||||
| G.k.4.r.10.2a | 親投与経路 TermID バージョン日付/番号 | ISO IDMP に準ずる | |||||||||||||||||||||||||
| G.k.4.r.10.2b | 投与経路 TermID | 数字 (3) |
|
||||||||||||||||||||||||
| G.k.8 | 薬剤使用して行なわれた処置 | 数字 (1) |
|
||||||||||||||||||||||||
| G.k.9.i.2.r.3 | 評価結果 | テキスト (60) |
|
||||||||||||||||||||||||
| G.k.9.i.4 | 再投与で反応が再発した? | 数字 (1) |
|
||||||||||||||||||||||||
| G.k.10.r | 薬剤に関する追加情報 (コード化) (必要に応じて繰り返す) | 数字 (2) |
|
||||||||||||||||||||||||
| G.k.11 | 薬剤に関するその他の情報 (自由テキスト) | テキスト (2000) |
|
||||||||||||||||||||||||
| G.k.7.r.1 | 主なソースで報告された対象疾患 | テキスト (250) |
|
||||||||||||||||||||||||
| G.k.2.3.r.3a | 強度 (数字) | 数字 (10) |
|
||||||||||||||||||||||||
| G.k.2.3.r.3b | 強度 (単位) | テキスト (50) |
|
||||||||||||||||||||||||
| G.k.4.r.6a | 医薬品投与期間 (数字) | 数字 (5) |
|
||||||||||||||||||||||||
| G.k.4.r.6b | 医薬品投与期間 (単位) | テキスト (50) |
|
||||||||||||||||||||||||
| G.k.4.r.7 | バッチ/ロット番号 | テキスト (35) | |||||||||||||||||||||||||
| G.k.4.r.9.2a | 薬剤剤形 TermID バージョン日付/番号 | ISO IDMP に準ずる | |||||||||||||||||||||||||
| G.k.4.r.9.2b | 薬剤用量フォーム TermID | ISO IDMP に準ずる | |||||||||||||||||||||||||
| G.k.5a | 初回反応までの累積投与量 (数字) | 数字 (10) |
|
||||||||||||||||||||||||
| G.k.5b | 初回反応までの累積投与量 (単位) | テキスト (50) |
|
||||||||||||||||||||||||
| G.k.6a | 暴露時点の妊娠期間 (数字) | 数字 (3) | |||||||||||||||||||||||||
| G.k.6b | 暴露時点の妊娠期間 (単位) | テキスト (50) |
|
併用薬
この安全タイプのアイテム構成を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
-
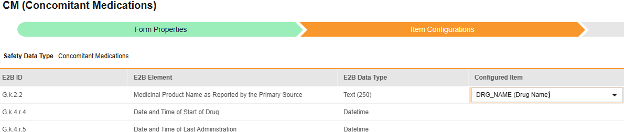
マッピングを意図する各行について、 構成アイテム 列のセルを使用して、 フォーム定義 の適切な アイテム定義を選択します。たとえば、E2B ロケーション G.k.2.2において フォームから CMTRT 項目を選択します。
- 選択したアイテムの アイテム定義 タイプと行の E2B ID に応じて、 値の翻訳 が必要になる場合があります。値の翻訳を設定するための一般的な概要については、 こちらを参照してください。
- 「保存」 (ページに留まる場合)または 「保存して次へ」 (次のタブ「 包含基準」に進む場合)をクリックします。
選択項目は通常、 各エントリ イン 設定が フォームのプロパティ> に保存されているかどうかに依存します (前の手順)。E2B の一部の箇所には、繰り返し項目グループまたは非繰り返し項目グループのみで実行できる、あるいはその両方で実行できることを示す特別なルールがあります。
さらに、併用薬と、それらが安全性ケースおよびそのケースに含まれるイベントとどのように関連しているかについての重要な因果関係の質問が 3 つあります (G.k.1 / G.k.8 / G.k.9.i.2.r.3 / G.k.9.i.4)。マッピングの項目定義の選択肢は、 安全性ケース開始イベントにマッピングされた EDC フォームから取得され、'項目からフォームへのリンク' タイプ 項目定義を含む繰り返し項目グループに存在するもののみになります。これは、サイトが関連する医薬品にリンクしているため、このような質問に対する答えはケースごとに、イベントごとに異なることがあります。これらの外れ値と、このタイプのすべての E2B 場所に関する重要な注意事項については、これらの手順の最後にある表を参照してください。
| E2B ID | E2B ラベル | E2B タイプ | メモ | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| G.k.2.2 | 主なソースで報告された Medicinal Product 名 | テキスト (250) |
|
||||||||||||||||||||||||
| G.k.4.r.4 | 医薬品開始日時 | 日時 |
|
||||||||||||||||||||||||
| G.k.4.r.5 | 最終投与日時 | 日時 |
|
||||||||||||||||||||||||
| G.k.1 | 薬剤ロールの特性解析 | 数字 (1) |
|
||||||||||||||||||||||||
| G.k.8 | 薬剤使用して行なわれた処置 | 数字 (1) |
|
||||||||||||||||||||||||
| G.k.9.i.2.r.3 | 評価結果 | テキスト (60) |
|
||||||||||||||||||||||||
| G.k.9.i.4 | 再投与で反応が再発した? | 数字 (1) |
|
||||||||||||||||||||||||
| G.k.4.r.1a | 用量 (数字) | 数字 (8) |
|
||||||||||||||||||||||||
| G.k.4.r.1b | 一回用量 (単位) | テキスト (50) |
|
||||||||||||||||||||||||
| G.k.4.r.8 | 用量テキスト | テキスト (2000) |
|
||||||||||||||||||||||||
| G.k.4.r.2 | 間隔内の単位数(頻度) | 数字 (4) |
|
||||||||||||||||||||||||
| G.k.4.r.3 | 時間間隔単位(頻度単位)の定義 | テキスト (50) |
|
||||||||||||||||||||||||
| G.k.2.4 | 薬剤が取得された国の識別 | テキスト (2) |
|
||||||||||||||||||||||||
| G.k.4.r.10.1 | 投与経路 (自由テキスト) | テキスト (60) |
|
||||||||||||||||||||||||
| G.k.4.r.10.2a | 親投与経路 TermID バージョン日付/番号 | ISO IDMP に準ずる | |||||||||||||||||||||||||
| G.k.4.r.10.2b | 投与経路 TermID | 数字 (3) |
|
||||||||||||||||||||||||
| G.k.10.r | 薬剤に関する追加情報 (コード化) (必要に応じて繰り返す) | 数字 (2) |
|
||||||||||||||||||||||||
| G.k.11 | 薬剤に関するその他の情報 (自由テキスト) | テキスト (2000) |
|
||||||||||||||||||||||||
| G.k.7.r.1 | 主なソースで報告された対象疾患 | テキスト (250) | |||||||||||||||||||||||||
| G.k.2.3.r.3a | 強度 (数字) | 数字 (10) |
|
||||||||||||||||||||||||
| G.k.2.3.r.3b | 強度 (単位) | テキスト (50) |
|
||||||||||||||||||||||||
| G.k.4.r.6a | 医薬品投与期間 (数字) | 数字 (5) |
|
||||||||||||||||||||||||
| G.k.4.r.6b | 医薬品投与期間 (単位) | テキスト (50) |
|
||||||||||||||||||||||||
| G.k.4.r.7 | バッチ/ロット番号 | テキスト (35) | |||||||||||||||||||||||||
| G.k.4.r.9.1 | 薬剤剤形 (自由テキスト) | テキスト (60) | |||||||||||||||||||||||||
| G.k.5a | 初回反応までの累積投与量 (数字) | 数字 (10) |
|
||||||||||||||||||||||||
| G.k.5b | 初回反応までの累積投与量 (単位) | テキスト (50) |
|
||||||||||||||||||||||||
| G.k.6a | 暴露時点の妊娠期間 (数字) | 数字 (3) | |||||||||||||||||||||||||
| G.k.6b | 暴露時点の妊娠期間 (単位) | テキスト (50) |
|
病歴
この安全タイプのアイテム構成を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
-
マッピングを意図する各行について、 構成アイテム 列のセルを使用して、 フォーム定義 の適切な アイテム定義を選択します。たとえば、E2B ロケーション D.7.r.1.5において フォームから MHTERM 項目を選択します。

- 選択したアイテムの アイテム定義 タイプと行の E2B ID に応じて、 値の翻訳 が必要になる場合があります。これらの値の翻訳を設定するための一般的な概要については、 こちらを参照してください。
- 「保存」 (ページに留まる場合)または 「保存して次へ」 (次のタブ「 組入基準」に進む場合)をクリックします。
選択項目は通常、 各エントリ イン 設定が フォームのプロパティ> に保存されているかどうかに依存します (前の手順)。一部の E2B ロケーションには、繰り返しアイテム グループまたは非繰り返しアイテム グループのみで実行できる、あるいはその両方で実行できることを示す特別なルールがあります。それらの外れ値と、このタイプのすべての E2B 場所に関する重要な注意事項については、これらの手順の最後にある表を参照してください。
| E2B ID | E2B ラベル | E2B タイプ | メモ | ||||||||||||
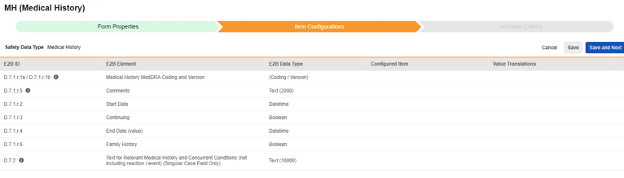
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| D.7.1.r.1a/D.7.1.r.1b | 治療歴 MedDRA コードおよびバージョン | (コード化 / バージョン) |
|
||||||||||||
| D.7.1.r.5 | コメント | テキスト (2000) |
|
||||||||||||
| D.7.1.r.2 | 開始日 | 日時 |
|
||||||||||||
| D.7.1.r.3 | 継続 | ブール値(またはNullFlavor) |
|
||||||||||||
| D.7.1.r.4 | 終了日 (値) | 日時 |
|
||||||||||||
| D.7.1.r.6 | 家族歴 | ブーリアン | |||||||||||||
| D.7.2 | 関連する既往歴および併存疾患に関する記載(反応/事象を含みません)(単一症例フィールドのみ) | テキスト (10000) |
|
薬歴
この安全タイプのアイテム構成を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
-
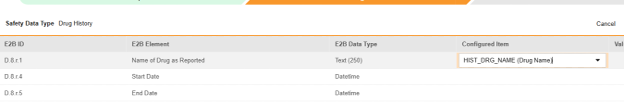
マッピングを意図する各行について、 構成アイテム 列のセルを使用して、 フォーム定義 の適切な アイテム定義を選択します。たとえば、E2B ロケーションD.8.r.1において フォームから HIST_DRG_NAME項目を選択します。
- 選択したアイテムの アイテム定義 タイプと行の E2B ID に応じて、 値の翻訳 が必要になる場合があります。これらの値の翻訳を設定するための一般的な概要については、 こちらを参照してください。
- 「保存」 (ページに留まる場合)または 「保存して次へ」 (次のタブ「 包含基準」に進む場合)をクリックします。
選択項目は通常、 各エントリ イン 設定が フォームのプロパティ> に保存されているかどうかに依存します (前の手順)。一部の E2B ロケーションには、繰り返しアイテム グループまたは非繰り返しアイテム グループのみで実行できる、あるいはその両方で実行できることを示す特別なルールがあります。それらの外れ値と、このタイプのすべての E2B 場所に関する重要な注意事項については、これらの手順の最後にある表を参照してください。
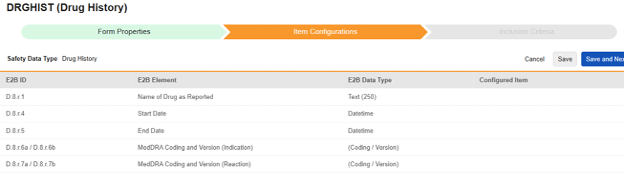
| E2B ID | E2B ラベル | E2B タイプ | メモ |
|---|---|---|---|
| D.8.r.1 | 報告された医薬品名 | テキスト (250) |
|
| D.8.r.4 | 開始日 | 日時 |
|
| D.8.r.5 | 終了日 | 日時 |
|
| D.8.r.6a/D.8.r.6b | MedDRA のコード化およびバージョン (効能) | (コード化 / バージョン) |
|
| D.8.r.7a/D.8.r.7b | MedDRA のコード化およびバージョン (反応) | (コード化 / バージョン) |
|
検査結果
この安全タイプのアイテム構成を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
-
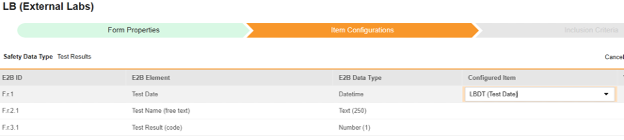
マッピングを意図する各行について、 構成アイテム 列のセルを使用して、 フォーム定義 の適切な アイテム定義を選択します。たとえば、E2B ロケーションF.r.1において フォームから LBDT 項目を選択します。
- 選択したアイテムの アイテム定義 タイプと行の E2B ID に応じて、 値の翻訳 が必要になる場合があります。これらの値の翻訳を設定するための一般的な概要については、 こちらを参照してください。
- 「保存」 (ページに留まる場合)または 「保存して次へ」 (次のタブ「 組入基準」に進む場合)をクリックします。
選択項目は通常、 各エントリ イン 設定が フォームのプロパティ> に保存されているかどうかに依存します (前の手順)。一部の E2B ロケーションには、繰り返しアイテム グループまたは非繰り返しアイテム グループのみで実行できる、あるいはその両方で実行できることを示す特別なルールがあります。それらの外れ値と、このタイプのすべての E2B 場所に関する重要な注意事項については、これらの手順の最後にある表を参照してください。
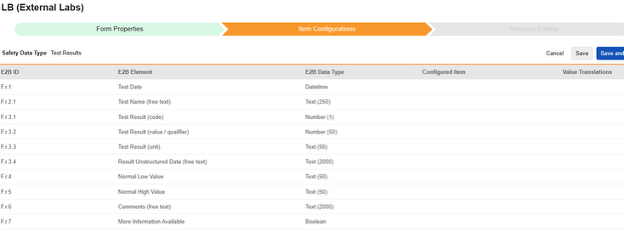
| E2B ID | E2B ラベル | E2B タイプ | メモ | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| F.r.1 | 検査日 | 日時 |
|
||||||||||
| F.r.2.1 | 検査名 (自由テキスト) | テキスト (250) |
|
||||||||||
| (F.r.2.2a) | テスト名のMedDRAバージョン |
|
|||||||||||
| (F.r.2.2b) | 検査名 (MedDRA コード) |
|
|||||||||||
| F.r.3.1 | 検査結果 (コード) | 数字 (1) |
|
||||||||||
| F.r.3.2 | 検査結果 (値/検査者) | 数字 (50) |
|
||||||||||
| F.r.3.3 | 検査結果 (単位) | テキスト (50) |
|
||||||||||
| F.r.3.4 | 非構造化結果データ (自由テキスト) | テキスト (2000) |
|
||||||||||
| F.r.4 | 正常範囲低値 | テキスト (50) | |||||||||||
| F.r.5 | 正常範囲高値 | テキスト (50) | |||||||||||
| F.r.6 | コメント (自由テキスト) | テキスト (2000) | |||||||||||
| F.r.7 | さらに情報が利用可能 | ブーリアン |
|
患者特性
このタイプを使用する場合、繰り返しのないアイテム グループのアイテムのみを選択できます。
この安全タイプのアイテム構成を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
-
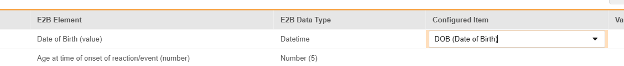
マッピングを意図する各行について、 構成アイテム 列のセルを使用して、 フォーム定義 の適切な アイテム定義を選択します。たとえば、 E2BのロケーションD.2.1において、 フォームから DOB 項目を選択します。
- 選択したアイテムの アイテム定義 タイプと行の E2B ID に応じて、 値の翻訳 が必要になる場合があります。これらの値の翻訳を設定するための一般的な概要については、 こちらを参照してください。
- 「保存」 (ページに留まる場合)または 「保存して次へ」 (次のタブ「 包含基準」に進む場合)をクリックします。
| E2B ID | E2B ラベル | E2B タイプ | メモ | ||||||||||||||
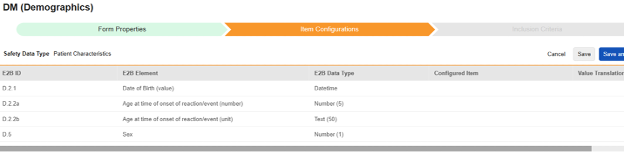
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| D.2.1 | 生年月日 (値) | 日時 |
|
||||||||||||||
| D.2.2a | 反応/イベント発現時の年齢 (数字) | 数字 (5) |
|
||||||||||||||
| D.2.2b | 反応/イベント発現時の年齢 (単位) | テキスト (50) |
|
||||||||||||||
| D.5 | 性別 | 数値(1)(またはNullFlavor) |
|
死亡例
このタイプの項目選択は、各 E2B ID に固有です。値がケース内で 1 回しか使用できない場合は、非繰り返しアイテムグループのアイテムのみが表示されます。複数の値が許可されるその他の場合は、繰り返しまたは非繰り返しの場所のいずれかからの選択肢が表示されます。
この安全タイプのアイテム構成を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
-
マッピングを意図する各行について、 構成アイテム 列のセルを使用して、 フォーム定義 の適切な アイテム定義を選択します。たとえば、E2B ロケーションD.9.1において フォームから DTHDT項目を選択します。
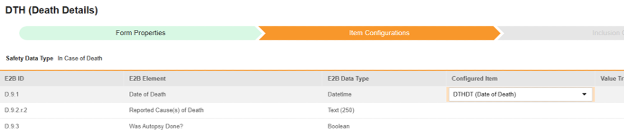
- 選択したアイテムの アイテム定義 タイプと行の E2B ID に応じて、 値の翻訳 が必要になる場合があります。これらの値の翻訳を設定するための一般的な概要については、 こちらを参照してください。
- 「保存」 (ページに留まる場合)または 「保存して次へ」 (次のタブ「 組入基準」に進む場合)をクリックします。
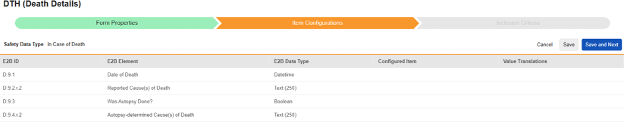
| E2B ID | E2B ラベル | E2B タイプ | メモ | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| D.9.1 | 死亡日 | 日時 |
|
||||||||||||
| D.9.2.r.2 | 報告された死因 | テキスト (250) |
|
||||||||||||
| (D.9.2.r.1a) | 報告された死因のMedDRA バージョン |
|
|||||||||||||
| (D.9.2.r.1b) | 報告された死因(MedDRA コード) |
|
|||||||||||||
| D.9.3 | 剖検は行われましたか? | ブール値(またはNullFlavor) |
|
||||||||||||
| D.9.4.r.2 | 解剖学的に決定された死因 | テキスト (250) |
|
||||||||||||
| (D.9.4.r.1a) | 解剖学的に決定された死因のMedDRA バージョン |
|
|||||||||||||
| (D.9.4.r.1b) | 解剖学的に決定された死因(MedDRA コード) |
|
システム別報告者 / 送信者コメント
システムは、非E2BリンクEDC項目値を 報告者コメント ( H.2)または送信者コメント ( H.4)に表示するための設定をサポートし、E2B XML経由で転送します。マッピング用に選択されたアイテムの値は、いずれかのコメントフィールドに標準的な方法で追加され、[メモ] としてリストされ、実際の報告者または送信者のコメントテキストに追加されます。
標準化されたメモを構成するには、フォームから 1 つ (または複数) の項目を選択してリストし、 報告者コメント (H.2) または 送信者コメント (H.4) に追加します。
繰り返しアイテム グループ、フォーム、またはイベントを選択して含めることもできます。報告者 または 送信者コメントを介して繰り返し情報を転送する準備がされている場合、転送されたデータを一意に追跡できるように、各リスト項目にシーケンス番号が表示されます。
他の Safety データ タイプ にマップされたフォームと項目は、さらに 報告者 または 送信者コメントにマップできます。
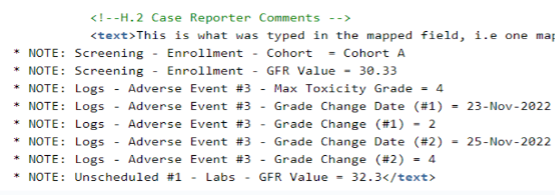
次の例では、主要な検査値、コホート、毒性グレード、および毒性グレードの変化が転送対象として選択されました。
追加の箇条書き情報は、 H.2 にマッピングされている実際の 報告者コメントに追加されることに注意してください。
注:
- コードリストのラベルがリストされています
- 日付/日時はサイトによって入力されたとおりに表示されます
- 項目が入力されていない場合は「値なし」が表示されます
追加で選択した項目が H.2 または H.4 フィールドの文字数制限を超える場合、追加された情報は最大 19,975 文字で切り捨てられます。
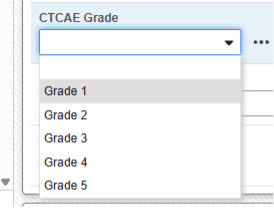
例 1:
有害事象フォームでは、E2B 形式に準拠しておらず、転送できないデータを追跡することがよくあります。この CTCAE グレード フィールドは、有害事象フォームに表示されます。
このタイプを使用すると、簡単な選択によって 報告者 または 送信者コメント フィールドのいずれかに含めることができます。
各追加により、E2B ファイルの 報告者 (または 送信者) コメント に書式設定された箇条書きが表示されます。
例 2:
このようなフィールドを含めるフォームは、別のタイプで使用されていないフォームにすることもできます。重要な登録詳細は、安全システムで役立つ可能性があります。登録 フォームでは、 報告者 または 送信者コメント フィールドのいずれかにランダム化番号、登録理由、コホートなどを含めるように選択できます。
組入基準
包含基準 は、安全性ケースのデータ転送を開始する主要なイベントを超えて、マップされた項目の値を安全性ケースに含めるかどうかを決定するために評価されます。
メモ/概念:
- 包含基準は、次の両方の条件が満たされている場合にのみ評価されます。
- フォームのプロパティ タブでは、すべての包含基準が trueと評価され、特に Key Safety Item
- [アイテム構成] タブで、必須アイテムに 空でない値 がEDCフォームに入力されている
- 追加の基準には、特定のタイプのすべてのフォームを含めることも、施設ユーザのアクション (リンク) や日付の比較に基づくこともできます。これらの構成は、タイプ、特定のフォーム、および/または試験によって異なる場合があります。
- 包含基準 タブの条件は、評価時に「OR」とみなされます。つまり、一連の適用可能な基準のいずれかが真の場合、他の基準が偽と評価されても、評価は 'In' となります。
- ケースに含めるための安全ケース開始イベントとの比較 終了日 が構成されているが、日付がデータ入力画面で 設定されていない 場合、イベントの終了日は 未設定として評価に使用されます。主要イベント (または関連フォーム) に終了日を入力すると、システムは組入基準を再評価し、必要に応じて修正フォローアップを送信します。
- 組入基準は、以下の関連するすべての安全性タイプに適用されます。
- 安全性ケース開始イベント
- 治験薬
- 併用薬
- 病歴
- 薬歴
- 検査結果
- システム別報告者 / 送信者コメント
安全タイプ別オプション概要
| 組入基準 | 安全性データタイプ | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 脊髄損傷 | 治験薬 | 併用薬 | 医学史 | 薬歴 | 検査結果 | 患者特性 | 死亡 | 報告/送信者コメント | |
| すべて | |||||||||
| 施設ユーザによりリンクされている | |||||||||
| 開始から終了までが安全性イベントの開始から終了までと重複しています | |||||||||
| 開始から終了までが安全性イベント開始前の X 日前と重複しています | |||||||||
| 開始から終了までが安全性イベント開始前の X 日後と重複しています | |||||||||
| 開始から終了までが安全性イベント終了前の X 日前と重複しています | |||||||||
| 開始から終了までが安全性イベント終了前の X 日後と重複しています | |||||||||
| 最初の調剤 | |||||||||
| 安全性イベント開始の直近/前に最も近い | |||||||||
| 安全性イベント開始の直近/後に最も近い | |||||||||
| 安全性イベント開始の直近/前 (一つのみ) | |||||||||
| 安全性イベント開始前に医薬品調剤開始 | |||||||||
| 安全性イベント開始前に終了しました | |||||||||
| 安全性症例の開始イベントフォームの一部であるため、自動 | |||||||||
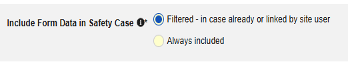
| フィルタリング済み - サイト利用者によって既にまたはリンクされている場合 | |||||||||
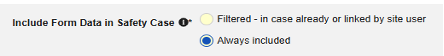
| 常時 | * | * | |||||||
|
この組入基準がセーフティデータタイプで利用可能であることを示します。 * この組入基準がセーフティデータタイプで利用不可であることを示します。 |
|||||||||
表のヘッダーには、以下の安全性データタイプが省略されています。
- SCIE: 安全性ケース開始イベント
- ConMeds: 併用薬
- Med Hist: 病歴
- Drug Hist: 薬歴
- Test Res: 検査結果
- Pat Chars: 患者特性
- 死亡:死亡例を含む
- システム別報告者/送信者コメント
オプションの意味 / 例
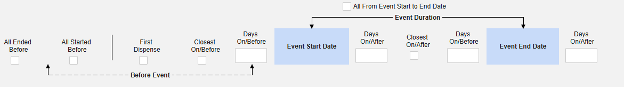
すべての基準オプションは以下にまとめられています。日付ベースの各オプションには、その使用方法を説明するための一連の例が含まれています。
安全性データタイプによる
安全性ケース開始イベント
安全ケース開始イベント は、安全ケースの転送プロセスを開始する主要なイベントになります。その後、他のすべての関連イベントは、設定された基準に従ってケースに組み込まれます。好みやスタディデザインに応じて、開始イベントには開始フォームからの他のデータを含めることができ、または同じタイプの他のイベント/フォームに関連付けることができますが、それ自体は独自の安全性ケースを構成しません (例: 開始の重大なイベントに関連付けられた他の重篤でないイベント)。
一般的な実例:
- 月曜日に、被験者は重篤ではない有害事象「頭痛」(AEフォーム#1)を経験した。
- 水曜日に、被験者は重篤ではない有害事象「頭痛」(AEフォーム#2)を経験した。
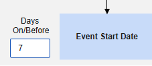
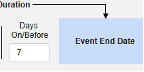
- システムは、火曜日のイベント (「めまい」) の安全性ケースを、新しい安全性ケースの主な開始イベントとして送信します。システムは、設定された包含基準に基づいて、月曜日のイベントのデータを同じ安全性ケースの 2 番目のイベントとして追加します。これは、 Days On/Before = 2 (またはそれ以上)の使用により発生します。
各包含基準オプションの詳細と例については、上記の 「オプションの意味/例」を参照してください。
この安全タイプの組入基準を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
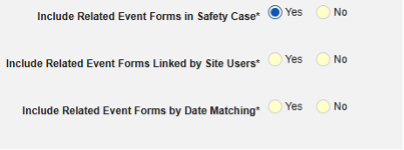
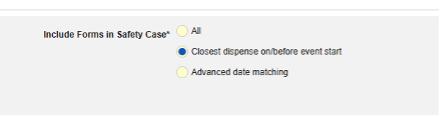
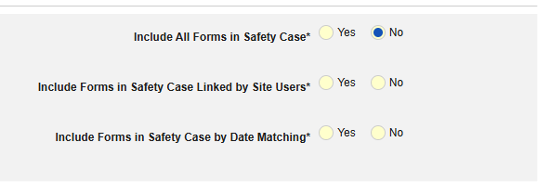
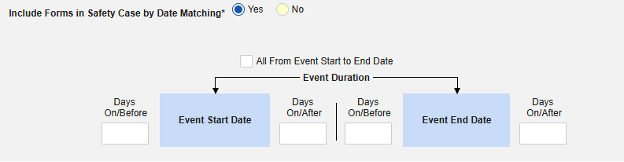
- 関連イベントのフォームを安全性ケースに含めます
- 施設ユーザによってリンクされた関連フォームを含める: 施設によって主要な発端イベントにリンクされたイベントを症例に含める場合は、 [はい] を選択します。警告: はいを選択した場合、フォームには フォーム間 または アイテムからフォーム のリンクも設定されている必要があります。
-
関連イベント フォームを日付の一致で含める: 1 つ以上の日付ベースの基準に基づいて関連イベントのデータを含めるために評価する場合は、 はい を選択します。各包含基準オプションの詳細と例については、上記の 「オプションの意味/例」を参照してください。
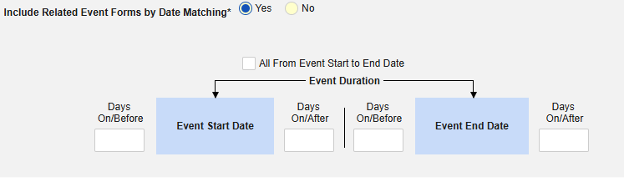
- オプションをチェックするか、特定の 日数 値を設定します。これらのオプションのうち 1 つ以上を選択 / 設定する必要があります。
- 終了するには、 [保存して閉じる] をクリックします。
治験薬
このタイプの安全性構成は、臨床試験で被験者に対してテストされている開始イベントに関連して、研究薬の投与/調剤情報を追跡するために使用されます。情報は、安全性ケースの製品/医薬品セクションに送られます。(E2BのG.*セクション)。
実例:
- 3月1日、被験者は 最初の調剤 を受け、 実薬対プラセボ (盲検試験薬)
- 3月3日に被験者は 別の投与を受ける
- 3月5日に被験者は 別の投与を受ける
- 3月6日、被験者は重篤な有害事象(「めまい」)を経験し、サイトがAEフォームに入力します。
- システムは「めまい」を主要イベントとして安全ケースを作成し転送します。
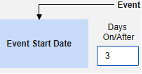
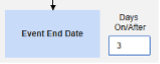
- この試験は、安全性ケースに投与のサブセットを含めるように構成されています。設定例の 1 つは、 3 月 1 日 (全体で 1 番目) と 3 月 5 日 (直前の最も近い) です。設定された基準により、その他の調剤は含まれません。
各包含基準オプションの詳細と例については、上記の 「オプションの意味/例」を参照してください。
この安全タイプの組入基準を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
- 安全事例にフォームを含める(各包含基準オプションの詳細および例については、上記の「オプションの意味/例」を参照してください):
- 終了するには、 [保存して閉じる] をクリックします。
併用薬
このタイプの安全性構成は、治験の併用薬形態に適用されます。情報は、安全性ケースの製品/医薬品セクションに送られます。(E2B の G.* セクション) タイプでは複数の形式を使用できます。
実例:
- 3月1日に被験者はVeeofenを1日1回服用し始めるが、3月3日に服用を中止します
- 3月3日に被験者はNatevbaを開始し、1日1回服用し、終了日は設定されていません (まだ服用中)
- 3月5日に被験者はディートーザを1回服用します (終了日も3月5日)
- 3月7日、被験者は重篤な有害事象(「めまい」)を経験し、サイトがAEフォームに入力します。
- システムは「めまい」を主要イベントとして安全ケースを作成し転送します。
-
スタディデザインでは、次の 2 つのルールを使用して併用薬を組み込むように規定されています。
- 「SAE スタート時に進行中のものすべて」
- 「何かが停止しましたが、SAE 開始から 3 日以内に停止しました」
- 結果: 3 月 3 日の Natevba (進行中) と 3 月 5 日の Deetoza (終了しましたが、わずか 2 日前) は両方ともケースに含まれています。もう1つは、 3月1日アスピリン ではありません(3日以上前に終了しました)。
各包含基準オプションの詳細と例については、上記の 「オプションの意味/例」を参照してください。
この安全タイプの組入基準を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
- 以下のオプションから選択してください。
- すべてのフォームをSafetyケースに含める (デフォルト: いいえ): はいを選択すると、現在併用しているすべての薬がケースに含まれ、他のすべてのオプションが無効になります。
- サイトユーザがリンクした関連イベントフォームを含めます。 主な開始イベントにサイトによって関連付けられている併用薬をケースに含める場合は、 はい を選択します。警告: はいを選択した場合、フォームには フォーム間 または アイテムからフォーム のリンクも設定されている必要があります。
- サイト ユーザーがリンクしたフォームをSafetyケースに含める: はい または いいえ を警告に対して選択します。 はいを選択した場合、フォームには フォーム間リンクまたは アイテムとフォームのリンク も設定されている必要があります。
-
「日付の一致によりセーフティにフォームを含める」 で 「はい」 または 「いいえ」を選択します。はいの場合、システムは 1 つ以上の基準を使用して、安全ケース イベント (プライマリ) の開始から終了までの範囲と関連データ (アクティブに構成されているフォーム、その開始範囲と終了範囲) を比較することを意味します。
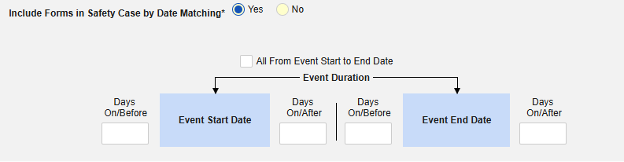
- オプションをチェックするか、特定の 日数 値を設定します。これらのオプションのうち 1 つ以上を選択 / 設定する必要があります。
- 終了するには、 [保存して閉じる] をクリックします。
各包含基準オプションの詳細と例については、上記の 「オプションの意味/例」を参照してください。
病歴
このタイプの安全性構成は、研究の併用薬形態に適用されます。情報は、安全性ケースのE2B D.7セクションに送られます。このタイプでは複数のフォームを使用できます。
実例:
- 2024年1月、被験者は初めて「軽度のめまい」を経験し始めました。病歴は継続中とみなされます (終了日なし)
- 2番目の病歴には「腰痛」とあり、2024年4月に始まり、2024年5月に終わる。
- 3番目の病歴には「片頭痛」とあり、2024年6月に始まり、2024年11月に終わる。
- 2025年3月7日、被験者に重篤な有害事象(「めまい」)が発生し、施設はAEフォームの作成を開始しました
- システムは「めまい」を主要イベントとして安全ケースを作成し転送します。
-
スタディデザインでは、次の 2 つのルールを使用して薬歴を組み込むように規定されています。
- 「SAE スタート時に進行中のものすべて」
- 「何かが停止しましたが、SAE 開始から 182 日以内に停止しました」
- 結果:「軽度のめまい」(継続中)と「偏頭痛」(終了したが、1年以内)の両方がケースに含まれています。もう 1つは、「腰痛」です。これは該当しません (180 日以上前に終了しました)。
各包含基準オプションの詳細と例については、上記の 「オプションの意味/例」を参照してください。
この安全タイプの組入基準を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
- 以下のオプションから選択してください。
- すべてのフォームをSafetyケースに含める (デフォルト: いいえ): はいを選択すると、現在併用しているすべての薬がケースに含まれ、他のすべてのオプションが無効になります。
- サイトユーザがリンクした関連イベントフォームを含めます。 主な開始イベントにサイトによって関連付けられている併用薬をケースに含める場合は、 はい を選択します。警告: はいを選択した場合、フォームには フォーム間 または アイテムからフォーム のリンクも設定されている必要があります。
- サイト ユーザーがリンクしたフォームをSafetyケースに含める: はい または いいえ を警告に対して選択します。 はいを選択した場合、フォームには フォーム間リンクまたは アイテムとフォームのリンク も設定されている必要があります。
-
「日付の一致によりセーフティにフォームを含める」 で 「はい」 または 「いいえ」を選択します。はいの場合、システムは 1 つ以上の基準を使用して、安全ケース イベント (プライマリ) の開始から終了までの範囲と関連データ (アクティブに構成されているフォーム、その開始範囲と終了範囲) を比較することを意味します。
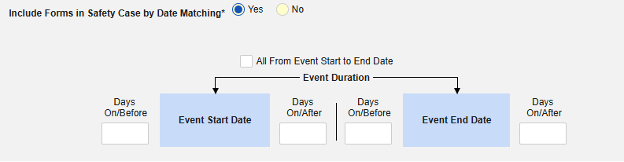
- オプションをチェックするか、特定の 日数 値を設定します。これらのオプションのうち 1 つ以上を選択 / 設定する必要があります。
- 終了するには、 [保存して閉じる] をクリックします。
各包含基準オプションの詳細と例については、上記の 「オプションの意味/例」を参照してください。
薬歴
このタイプの安全性構成は、治験の薬歴フォームに適用されます。情報は、安全性ケースの E2B D.8セクションに送られます。
実例:
- 研究設計では、 スクリーニング訪問 時に、研究者が適切と判断した、および/またはプロトコルに従って、薬物使用履歴情報を収集します。これらは具体的には、被験者が試験に参加する前に服用(および終了)された薬剤/製品です。
- 2025年3月7日、被験者は重篤な有害事象(「めまい」)が発生し、発生し、施設はAEフォームの作成を開始しました。
- システムは「めまい」を主要イベントとして安全ケースを作成し転送します。
- このタイプの安全性データの試験設定に従って、被験者が経験するすべての安全性ケースにすべてが含まれる必要があります。
- あるいは、日付ベースおよび/またはサイトリンクオプションを使用することもできます。
各包含基準オプションの詳細と例については、上記の 「オプションの意味/例」を参照してください。
この安全タイプの組入基準を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
- 以下のオプションから選択してください。
- すべてのフォームをSafetyケースに含める (デフォルト: いいえ): はいを選択すると、現在併用しているすべての薬がケースに含まれ、他のすべてのオプションが無効になります。
- サイトユーザがリンクした関連イベントフォームを含めます。 主な開始イベントにサイトによって関連付けられている併用薬をケースに含める場合は、 はい を選択します。警告: はいを選択した場合、フォームには フォーム間 または アイテムからフォーム のリンクも設定されている必要があります。
- サイト ユーザーがリンクしたフォームをSafetyケースに含める: はい または いいえ を警告に対して選択します。 はいを選択した場合、フォームには フォーム間リンクまたは アイテムとフォームのリンク も設定されている必要があります。
-
「日付の一致によりセーフティにフォームを含める」 で 「はい」 または 「いいえ」を選択します。はいの場合、システムは 1 つ以上の基準を使用して、安全ケース イベント (プライマリ) の開始から終了までの範囲と関連データ (アクティブに構成されているフォーム、その開始範囲と終了範囲) を比較することを意味します。
- オプションをチェックするか、特定の 日数 値を設定します。これらのオプションのうち 1 つ以上を選択 / 設定する必要があります。
- 終了するには、 [保存して閉じる] をクリックします。
各包含基準オプションの詳細と例については、上記の 「オプションの意味/例」を参照してください。
検査結果
このタイプの安全性構成は、治験のラボ / 検査結果フォームに適用されます。情報は、SafetyケースのE2B F.*セクションに送られます。このタイプでは複数のフォームを使用できます。
実例:
- スタディデザインでは、研究者/施設の必要に応じて、追加の検査/テスト結果をログ フォームで収集します。つまり、重大な有害事象に関連していると判断される検査です。
- 2025年3月7日、被験者は重篤な有害事象(「めまい」)が発生し、発生し、施設はAEフォームの作成を開始しました。
- さらに、サイトでは 2つの範囲外検査を追加し、それぞれに対して AE フォームへのリンクを作成します。
- システムは「めまい」を主要イベントとして安全ケースを作成し転送します。
- この研究には、施設がイベントにリンクするものをすべて含めるように指示する安全性構成があるため、2つのテスト結果がケースに含まれています。
- さらに(または代わりに)、日付ベースのオプションを使用することもできます。
各包含基準オプションの詳細と例については、上記の 「オプションの意味/例」を参照してください。
この安全タイプの組入基準を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
- 以下のオプションから選択してください。
- すべてのフォームをSafetyケースに含める (デフォルト: いいえ): はいを選択すると、現在併用しているすべての薬がケースに含まれ、他のすべてのオプションが無効になります。
- サイトユーザがリンクした関連イベントフォームを含めます。 主な開始イベントにサイトによって関連付けられている併用薬をケースに含める場合は、 はい を選択します。警告: はいを選択した場合、フォームには フォーム間 または アイテムからフォーム のリンクも設定されている必要があります。
- サイト ユーザーがリンクしたフォームをSafetyケースに含める: はい または いいえ を警告に対して選択します。 はいを選択した場合、フォームには フォーム間リンクまたは アイテムとフォームのリンク も設定されている必要があります。
-
「日付の一致によりセーフティにフォームを含める」 で 「はい」 または 「いいえ」を選択します。はいの場合、システムは 1 つ以上の基準を使用して、安全ケース イベント (プライマリ) の開始から終了までの範囲と関連データ (アクティブに構成されているフォーム、その開始範囲と終了範囲) を比較することを意味します。
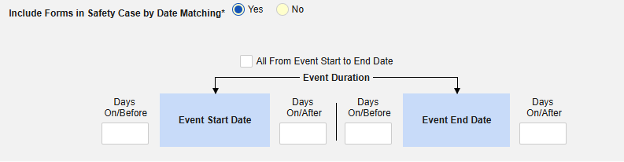
- オプションをチェックするか、特定の 日数 値を設定します。これらのオプションのうち 1 つ以上を選択 / 設定する必要があります。
- 終了するには、 [保存して閉じる] をクリックします。
各包含基準オプションの詳細と例については、上記の 「オプションの意味/例」を参照してください。
患者特性
このタイプの安全性構成は、患者に関する一般的な情報に適用されます。このタイプには 基準はありません 。代わりに、このタイプに分類される情報は、対象の すべての 安全性ケースに含まれます。
[アイテム設定] タブから [包含構成] タブに移動した際、 [保存して次へ]をクリックすると、 [フォーム設定] リストに戻ります:
死亡例
このタイプの安全性構成は、対象者の死亡に関する詳細情報を含むフォームに適用されます。このタイプには 基準はありません 。代わりに、このタイプに分類される情報は、対象の すべての 安全性ケースに含まれます。
[包含基準] タブから [アイテム構成] タブに移動しましたら、 [保存して次へ]をクリックしてください。これにより[フォーム設定] の一覧画面に戻ります:
現在、すべてのケースでこの情報が受信されます。ケース内のどのイベントにも結果 致命的がない場合でも。
システム別報告者 / 送信者コメント
このタイプの安全性構成は、ケースブック内の任意の場所のフォームに適用されます。E2B 構造のどこにも適合しないデータの場合、このタイプが使用されます。
この安全タイプの組入基準を保存するには:
- スタディの スタジオ >> フォーム設定 に進みます。
- 以下の表にリストされている 2 つのオプションのうち適切なものを選択してください。
- 保存して閉じるをクリックします。
| オプション | 意味/注釈 |
|---|---|
| フィルタリング済み - サイト利用者によって既にまたはリンクされている場合 | このオプションには 2つの意味が考えられます。
|
| 常時追加 | フォームの値は、そのフォーム デザインを使用してデータを入力するすべてのフォームの報告者 (または送信者) コメントに、システムによって生成された箇条書きとして含まれます。このオプションは、被験者ごとに 1 回収集されたデータに最もよく使用されます。例:
|
すべての安全性構成を削除する
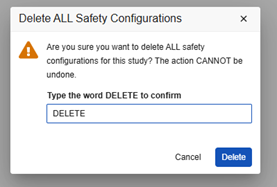
スタディデザインのすべての安全性構成を削除するときは、細心の注意を払ってください。このアクションにより、スタディは構成が存在しない状態に戻り、再度開始する必要があります。
このアクションを実行するには、開発研究にゼロの 安全性ケース が存在している必要があります。開発環境ですでに 安全性ケース を作成している場合は、 非本番環境のテスト データを削除できます。
Go-Live 後の削除: 下流の環境 (テスト、トレーニング、本番) に安全性構成と安全性ケースがある場合は、この操作を実行しないでください。展開スタディで安全性ケースを削除し、その後安全性構成を削除できたとしても、その後のテスト/Training/本番環境への展開は失敗します。
研究のすべての安全性構成を削除するには:
仕様書のダウンロード
スタディデザイン仕様または すべての CRF PDF のエクスポート を使用して、安全性設定をダウンロードできます。安全性統合を構成すると、 安全性設定 と 安全性フォーム構成の 2 つの追加タブが生成されます。
安全性設定を展開する
スタディの DEV 環境での設定が完了したら、TST にデプロイして試験を実施し、トレーニングおよび本番環境へとデプロイできます。
E2B リンクの設定は、試験の展開パッケージに自動的に含まれます。試験の展開時に、Vault は現在の設定をパッケージに含めます。
この構成はスタディのデプロイの一部として管理されるため、DEV タイプの環境でのみ変更できます。変更する場合は、DEV 環境で変更し、その変更を他の環境に展開します。この構成は、ケースブックバージョン出版物の一部としてバリデーションされています。バリデーション中は、編集ができなくなります。予想されるエラーや警告のリストは、こちらでご確認いただけます。
試験のデプロイについて説明します。
E2B 要素リファレンス(システム生成)
次の表は、 Safetyケースで安全性システムに追加で送信されるシステム生成の E2B 要素と、設定された アイテム設定をまとめたものです。
| E2B ID | E2B 要素 | データタイプ | ソース | 説明 |
|---|---|---|---|---|
| N.1.1 | バッチでのメッセージタイプ | 数字 (2) | 静的 | これは ICH ICSR に対して常に「1」に設定されます |
| N.1.2 | バッチ番号 | 数字 (100) | システム生成済み | この値は、被験者の施設 (ISO 2 文字コード)、EDC システムの一意の識別子 (その Vault 内のすべての試験に固有)、Vault の ID、オブジェクトレコードの ID、ダッシュ (「-」) を連結したもの)、およびケースの N 番目のメッセージの数値です (例「US-VAULTCDMS-110377V6800000000L003-1」)。非本番環境では、EDC システム識別子に「TEST」が付加されます。メッセージ番号は、「0」が初回送信、「1」が初回フォローアップというように付けられます。 |
| N.1.3 | バッチ送信者 ID | テキスト (60) | システム生成済み | これは試験の転送プロファイルで指定される バッチ送信者 ID です。これは、Safety システムに設定された送信者プロファイルと一致します。 |
| N.1.4 | バッチ受信者 ID | テキスト (60) | システム生成済み | これは試験の転送プロファイルで指定される バッチ受信者 ID です。これは、Safety システムに設定された受信者プロファイルと一致します。 |
| N.1.5 | バッチ送信日付 | 日時 | システム生成済み | Vault がSafetly メッセージとその XML ファイルを作成したときの完全な日時 (UTC)。 |
| N.2.r.1 | メッセージ識別子 | テキスト (100) | システム生成済み | これは「N.1.2」と同じです。 |
| N.2.r.2 | メッセージ送信者識別子 | テキスト (60) | システム生成済み | これは「N.1.2」と同じです。 |
| N.2.r.3 | メッセージ受信者識別子 | テキスト (60) | システム生成済み | これは「N.14.」と同じです。 |
| N.2.r.4 | メッセージ作成日付 | 日時 | システム生成済み | これは「N.1.5」と同じです。 |
| C.1.1 | 送信者の (ケース) 安全報告書固有識別子 | テキスト (100) | システム生成済み | この値は、被験者の施設 (ISO 2 文字コード)、EDC システムの一意の識別子 (その Vault 内のすべての試験に固有)、Vault の ID、オブジェクトレコードの ID です (例「US-VAULTCDMS-110377V6800000000L003」)。非本番環境では、EDC システム識別子に「TEST」が付加されます。 |
| C.1.2 | 作成日 | 日時 | システム生成済み | Vault は Safety メッセージを転送後すぐに作成します。このフィールドには、作成日が秒単位で記録されます。メッセージ ID として作用します。 |
| C.1.3 | レポートのタイプ | 数字 (1) | 静的 | これは「試験からのレポート」に対して「2」に設定されます。 |
| C.1.4 | ソースからレポートを最初に受信した日付 | 日時 | システム生成済み | このフィールドは、SAE 用にすべての必須フィールド (アイテム) がキャプチャされる場合に、日付と時刻をキャプチャします。 |
| C.1.5 | 本レポートに関する直近の情報の日付 | 日時 | システム生成済み | 最後の安全性メッセージが送信された後に、データ入力ユーザが安全性ケースのデータ対して指定した日付に行った最初の変更が示されます。たとえば、最初に午前 8 時に「治療歴」フォームのデータを変更し、次に同日午前 10 時に [SAE] フォームのデータを変更し、最後に同日午前 11 時に 2 つの [併用薬] フォームをリンクし、同じ安全性ケースのデータにすべての変更を加えた場合、次回の転送予定での C.1.5 の値はその日の午前 8 時になります。 |
| C.1.6.1 | 追加ドキュメントが利用可能ですか? | ブーリアン | 静的 | この値は常に偽です |
| C.1.7 | 本ケースは優先報告書の現地条件を満たしますか? | ブーリアン | 静的 | この値は常に「NI」(情報なし)です |
| C.1.8.1 | 世界的な固有症例識別番号 | テキスト (100) | システム生成済み | これは「C.1.1」と同じです。 |
| C.1.8.2 | 本ケースの第一送信者 | 数字 (1) | 静的 | これは「その他」に対して常に「2」に設定されます。 |
| C.1.11.1 | 報告書の無効化/修正 | 数字 (1) | システム生成済み | メッセージタイプが「修正」の場合、Vault はこのフィールドを「2」に設定します。メッセージタイプが「無効化」の場合、Vault はこのフィールドを「1」に設定します。 |
| C.2.r.1.2 | 報告者の名 | テキスト (60) | サイト使用料より | 研究の報告者(安全性設定)のオプションに応じて、これは施設の主任研究員からのものです。 |
| C.2.r.1.4 | 報告者の姓 | テキスト (60) | サイト使用料より | 研究の報告者(安全性設定)のオプションに応じて、これは施設の主任研究員からのものです。 |
| C.2.r.3 | 報告者の国コード | テキスト (2) | サイト使用料より | |
| C.2.r.5 | 規制目的の主なソース | 数字 (1) | 静的 | この値は常に1です |
| C.3.2 | 送信者の組織 | テキスト (100) | サイト使用料より | これは試験の 組織の名称です (EDC 内、送信者)。 |
| C.5.3 | スポンサー試験番号 | テキスト (50) | ルックアップ済み | これは、研究の安全性設定セクションで特定の値が設定されていない場合の研究の名前/ラベルです。 |
| E.i.9 | 反応/イベントが起こった国の識別 | テキスト (2) | 施設またはユーザーから | 施設の試験国の 2 文字の国コード。または、施設のデータ入力フォームにマッピングして上書きすることもできます。(例:被験者が国外にいるときにイベントが発生する) |
| D.7.1.r.1a | 治療歴の MedDRA バージョン | テキスト (4) | ルックアップ済み | 「MedDRA」は文字列から削除されます。E2B には治療歴用語を入れる場所がなく、コード化された値のみが存在するため、このフィールドはコード化または自動コード化された場合にのみ送信されます。 |
| D.7.1.r.1b | 治療歴 (疾病 / 外科的 / 手順 / その他)(MedDRA コード) | 数字 (8) | ルックアップ済み |