Veeva SafetyとVeena EDC を接続する治験の設定
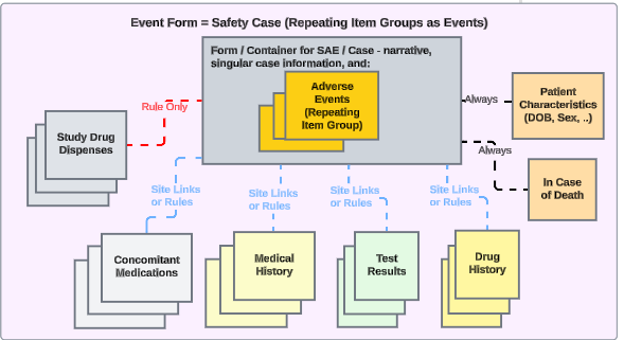
Veeva EDC と Veeva Safety 間の安全性の統合は、Veeva Vault プラットフォームの独自の通信の交換に基づいています。適切な統合構成により、必要なすべての安全関連 EDC データと補足的な安全関連 EDC データが安全性ケースとして安全システムに送信されます。移管につながる可能性のある例としては、重篤な有害事象、特に注目すべき有害事象、治験中の予期外妊娠などが挙げられます。
スタディデザインに対する統合設定により、施設が安全性ケース開始の基準を満たすイベントを作成するたびに、Veeva EDC は自動的に初回送信を生成し、データを安全性システムに転送します。
関連データを安全性ケースに挿入するには、それらのデータを次のいずれかの安全性データ タイプに分類します。
- 治験薬(臨床治験で治験される製品)
- 併用薬
- 病歴
- 薬歴
- 検査結果
- 患者特性
- 死亡例
安全性ケースの開始データまたは関連データが更新されると、指定された時間間隔で安全システムに送信されるフォローアップ送信が自動的に生成されます。
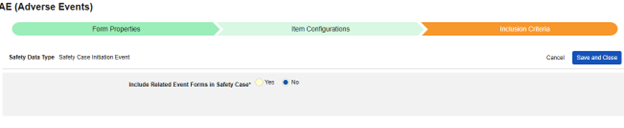
スタディデザイナーは、EDC スタディデザイン 項目 を適切な Veeva Safety の場所にマッピングすることで、この統合を構成します。マップされたケースブック要素を安全性ケースに含めるかどうかは、構成された包含ルールによってさらに決まります。包含ルールでは、マッピングされた アイテム を被験者のすべてのケースブック フォーム に含めるか、施設によって安全性ケースの開始フォームにリンクされているもの、または開始イベントに関連して選択された日付範囲に該当するものを含めるかを選択できます。
安全性ケースは、単一のイベントにより作成される場合もあれば、複数のイベントで構成される場合もあります。これは、施設 リンクや日付ベースの包含ルールを使用して構成されます。
Safetyの統合では、最初の転送を開始した基準が当てはまらなくなった場合に実行される 無効化 もサポートされます。例としては、フォームのリセット(入力ミス)やイベントのダウングレードなどが挙げられます。
Safety-EDC 接続と E2B リンクの主な違い:
- Safety-EDC 接続は、送信ごとのリモート システムからの確認応答ファイルを待機しません。代わりに、Vault Safetyでの受信 (その 受信トレイ ) は、安全性被験者へのその後の昇格に関係なく、Veeva EDC に記録されます。その後、通常のトリアージプロセスを通じて正式な安全性ケースに昇格した場合、そのケースの場所は Veeva EDC に記録されます。
- 安全性ケースの一部として転送される実際のデータに加えて、最初の安全性イベントが発生すると、標準の安全性データ タイプにマッピングされた治験参加者のすべての安全性関連データが Veeva Safety に送信されます。このデータは、Veeva Safety の安全性ケースの処理に必要な場合に、 追加の被験者情報として表示できます。EDC のデータが変更されると、安全性ケースデータと Veeva Safety の追加の被験者情報の両方が更新されます。「ケース内」データの変更によってフォローアップの受信トレイ項目が作成されますが、追加の被験者情報の更新はケースに変更を加えることなくバックグラウンドで実行されます。Veeva Safety ユーザは、Veeva Safety の 追加の被験者情報 ユーザ インターフェースを通じて、「ケースに含まれない」標準安全性データ タイプにマップされているすべてのものに簡単にアクセスでき、そのシステムから離れることなく医学的決定に従ってコンテンツを選択/選択解除できます。その結果、Veeva EDC によるフォローアップ転送でその選択が反映されます。
- Veeva Safety でのアクションは Veeva EDC に伝達されます。特に、施設と CRA に示すケースステータスと、Veeva Safety で行われた安全性の決定です。この追加の被験者情報は、簡単に選択するだけで Veeva Safety の安全性ケースに追加できます。また、ケースから被験者情報を削除することもできます。別のシナリオでは、安全性ケース が Veeva EDC から送信された際に、複数のイベントが含まれることがあります。これらのイベントは、Safety 側で個々のケースに分割したり、個々の安全性ケース を 1 つに統合したりすることができます。Veeva EDC は現在、Veeva Safety で行われたこれらの決定を認識しています。Veeva EDC では EDC 臨床データおよび施設リンクの決定は変更されませんが、Veeva Safety で行われた追加、削除、およびスピッティング、またはマージに関する決定は、次回のフォローアップ送信をコンパイルする際にも反映されます。
安全性管理者は、最初の送信のタイミングとフォローアップの頻度、および統合のその他の運用設定を設定します。詳細については、 「Safety 統合の管理」の「Safety 設定」 を参照してください。
前提条件
Vault Owner セキュリティプロファイルを持っているユーザは Veeva EDC と安全システム間の 接続 を確立する必要があります。
標準の CDMS スタディ デザイナー または CDMS ライブラリアン スタディ ロールを持つユーザは、安全性構成の表示と編集の両方を行うことができます。組織がカスタム治験の役割を使用する場合、ロールには以下の権限が付与されている必要があります:
| タイプ | 権限ラベル | 制御 |
|---|---|---|
| 標準タブ | Studio タブ | Studio タブへのアクセス権限 |
| 標準タブ | ライブラリタブ | ライブラリタブへのアクセス権限 |
| 機能権限 | 治験デザインの表示 | 治験デザインへの閲覧のみのアクセス |
| 機能権限 | 治験のデザイン | Studio から治験デザイン定義と治験スケジュールを作成する権限 |
| 機能権限 | 安全設定の管理 | Study の安全性統合を設計および構成する権限。これには、どの フォーム が関係しているか、それらの フォーム のどの 項目 が安全システムに送信されるか、どの 組入基準 が 安全性ケースにフォーム データを含めるか範囲外 (Out)するかを規定するかを決定することが含まれます。 |
| 機能権限 | ライブラリの表示 | Studio>ライブラリからライブラリコレクションとそのデザインを表示する権限 |
| 機能権限 | ライブラリの設計 | Studio>ライブラリからコレクションの治験デザイン定義と治験スケジュールを作成する権限 |
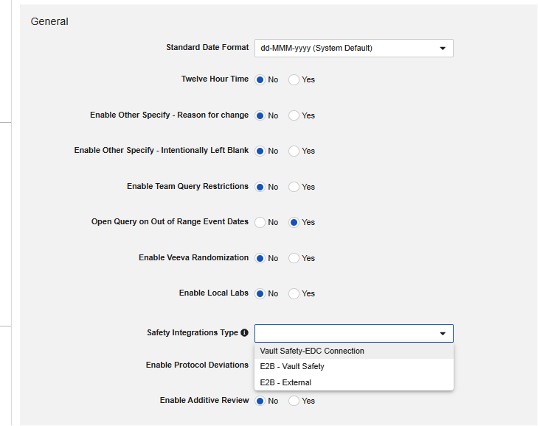
安全性統合タイプ
Veeva EDC の安全性統合を構成する最初のステップは、研究設定の 安全性統合タイプ の値です。
安全性統合タイプ 設定は、空でない値を持つ場合、読み取り専用になります。これは、Safety-EDC 接続スタイルの統合と E2B リンクの性質によるものです。2 つを切り替える必要がある場合は、サポートと計画について Veeva の担当者にお問い合わせください。
E2B を使用した安全性統合の詳細については、「 E2B 治験の設定」を参照してください。
全体的な統合タイプが保存されると、Studio ナビゲーション メニューの [ Safety設定 ] と [ フォーム設定 ] に追加のオプションが表示されます。
安全性構成
設定の更新
スタディ設定の主な安全性構成を設定するには:
- Studio > の Safety 設定 (Study のため)に進みます。
- 編集をクリックします。
- 変更を実行します。次の表に、使用可能なケース設定を示します。
- 保存をクリックします。
利用可能な設定
次の設定が使用可能です:
| 設定 | デフォルト値 | 説明 |
|---|---|---|
| 被験者 ID ロケーション | 患者名またはイニシャル | 現在のスタディの Veeva EDC 被験者 ID が転送される E2B の場所を選択します。
|
| 被験者 ID フォーマット | 被験者のみ | 被験者 ID の形式を以下から選択します。
|
| 第一ソース評価 の値 | 医師 | 安全性ケースの各イベントに関連するため、治験薬または治療法を評価する者の分類を示します。次の分類タイプから選択できます:
|
| ConMed 候補の場合の試験薬分類 | 常に候補 | この設定は、データ入力ユーザが「 併用薬 」と分類されたフォームを「 安全性ケース開始イベント 」にリンクし、「併用」(E2B 値「2」)のデフォルト分類を上書きできるように研究が設定されている場合にのみ適用されます。
|
| 研究名の値 | 任意の作業: 移管に使用する 治験名 を定義します。空白のままにすると、Vault は研究ラベルを送信します。 |
|
| スポンサー試験番号の値 | 任意の作業: 移管に使用する スポンサー治験番号 を定義します。空白のままにすると、Vault は研究ラベルを送信します。 |
|
| スタディの種類 | 試験 | 以下の選択肢から反応の研究タイプ(C.5.4)を選択します。
|
| 報告者 | 全サイト情報 | これは、安全性ケースのレポーターフィールドの値です。E2B のレポーターの施設は、Veeva EDC の 施設 の情報定義に基づいて入力されます。以下のオプションから選択します:
|
| コーディング用 NullFlavor | コーディングのゼロ値を処理する方法を選択します(MedDRA コーディング値がない場合)。この設定は、フォームのコーディングが有効になっていて、安全性転送の場所を割り当てた Veeva EDC スタディデザインの場所にのみ適用されます。以下のオプションから選択します:
接続のコーディングは、安全性データ タイプごとに次の各場所に配置されます。
注: 上記のそれぞれについてタンデム フィールドをマップする必要はありません (それぞれは 安全性フィールド リストの下にあり、「…(コーディング LLT)」と記載されています)。これらのマッピング行は特別な場合にのみ使用されます。詳細については、このリファレンスの後半にある関連するアイテム構成のセクションを参照してください。 |
|
| コーディングフォローアップをミュート | いいえ | この設定を はい に設定すると、Veeva EDC でコード化された医療用語 (イベント、病歴、死亡原因) に新しいコードまたは異なるコードが割り当てられただけの変更があった場合に、Veeva によるフォローアップの送信が停止されます。安全性ケースの一部であるデータに対するその他の変更は、引き続きフォローアップ送信を開始します。 いいえに設定すると、Veeva EDC は、医学用語のコーディングの変更など、安全性ケースの一部であるデータに対するすべての変更について、フォローアップを送信します。 スタディが Safety システムで主にコーディングを実行する場合、Vault は、Safety システムへの不必要なフォローアップを防ぐために、このオプションをはいに設定することを推奨します。 |
| 日時値の動作 | 画面 / 入力値の使用 | EDC フォームの日時フィールドに対して安全データを構成する場合、このオプションは送信する値を示します。「画面/入力値を使用」を選択すると、施設で入力された値をそのまま使用できます。また、「正規化された (UTC) 値を使用」を選択すると、施設のタイムゾーンに基づいた画面上の値に対し UTC に正規化した日時値を使用できます。 |
| 現地臨床検査の SAE 開始前の日数 | この設定は、スタディで Local Labs モジュール (Studio のスタディ設定で有効化) が使用されている場合にのみ適用されます。 ラボ テストを検索するには、安全性ケース Initiating Event の 開始日 の何日前までかを入力します。これを設定すると、ローカル ラボのテスト (すべてのフォーム) を検索し、そのテストをレビューのために安全システムに送信することになります。これらの検査は転送時に表示されるわけではなく、特定のケースに含めるための医学的決定のためにレビューされます。 このフィールドでは、0 から 21 までの数値 (日数) を入力できます。 |
|
| 現地臨床検査の SAE 開始後の日数 | この設定は、スタディで Local Labs モジュール (Studio のスタディ設定で有効化) が使用されている場合にのみ適用されます。 ラボ テストを検索するには、安全性ケース Initiating Event の 開始日 の何日後までかを入力します。これを設定すると、ローカル ラボのテスト (すべてのフォーム) を検索し、そのテストをレビューのために安全システムに送信することになります。これらの検査は転送時に表示されるわけではなく、特定のケースに含めるための医学的決定のためにレビューされます。 このフィールドでは、0 から 21 までの数値 (日数) を入力できます。 |
|
| 医学的に確認された自動設定 | いいえ | この設定は、安全性ケースに「医療従事者による医学的確認」を含めるかどうかを決定します。含める場合、はいを選択します。いいえを選択した場合、転送から値が省略されます。安全性ケースは臨床現場/研究者から発信されているため、これの最も一般的な使用法は はいです。 |
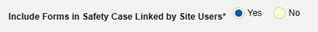
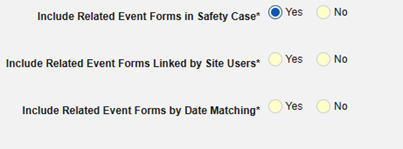
| 二次イベントサイトへのリンクを症例に含める | はい | この設定に [はい] を使用すると、主安全性症例開始イベントだけでなく、症例の二次イベントにリンクされた関連先データも含まれます。 |
フォーム設定
メインの Safety 設定を更新した後、次のステップでは、完全なスタデデザインのどの特定のフォームが安全性統合に参加するかを構成します。これらは スタジオ> フォーム設定で設定されます。
「+ 新しいフォーム設定」ボタンは、 Safety 設定の構成後にのみアクティブになることに注意してください。
重篤な有害事象 ( 安全性ケース Initiation Event )フォームおよび Safety システムにデータを送信するために使用するその他の フォーム の フォーム設定 を作成する必要があります。フォーム設定 を Studio > フォームの設定 から作成します。
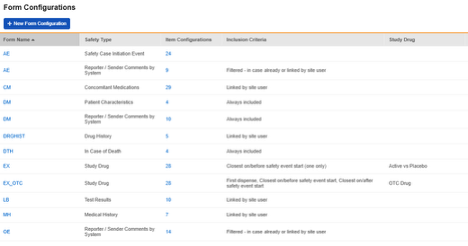
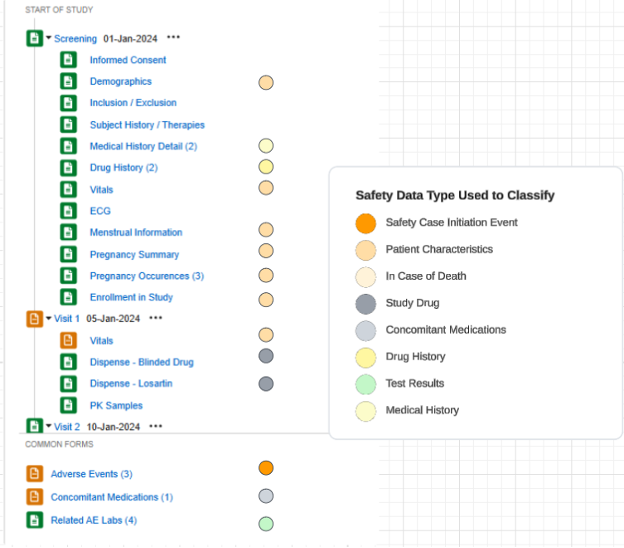
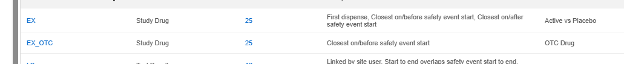
治験の設定済みフォームの概要リストの例:
各フォーム設定には、次の 3 つの手順があります:
- フォームプロパティ: 安全性データ、キーアイテムを含むフォームのプロパティを定義します。
- アイテムの設定: 安全性フィールド を対応する アイテム にマッピングします。
- 組入基準: Safety システムへの送信に含めるフォームデータを決定するために Vault が使用する組入基準を定義します。
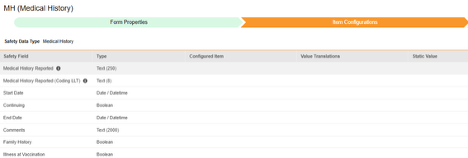
安全性データタイプ
各フォームは、 安全性データタイプ を含む安全性統合用に設定されています。これらの型は、あらゆる安全性システムの標準データ モデル/型を表します。
Veeva EDC の安全性構成タイプは次のようにまとめられます。E2B フォーマット (R3) に精通している方のために、関連セクションを示します。
| EDC タイプ | 関連するE2B(R3)の場所 | Veeva Safety | メモ |
|---|---|---|---|
| 安全性ケース開始イベント | E.* | 有害事象 | このタイプのフォーム (以前は 重篤な有害事象と呼ばれていました) は、 安全性ケースの転送を開始します。以前送信されたケースが最初の送信の基準を満たさなくなった場合、ケースは無効化されます。 安全性ケース には、設定された組入基準に応じて、主要なイベント、またはいくつかの異なる追加イベントフォーム(重大でないイベントも含む)からのみデータを含めることができます。 Safety システム/ケースでは、これらは イベント と呼ばれます。 |
| 治験薬 | G.* | 製品 / 製品の投与量 | 治験 における治験薬剤/製品の調剤を追跡する予定の各EDCフォームでは、このタイプを使用します。Safetyシステム/ケースでは、これらは 製品 と呼ばれ、1つ以上の 投与/投与量 がグループ化されます。 治験薬の組入基準に応じて、EDC は症例の イベント に関連して治験薬の調剤を含めます。重要な治験薬調剤への施設リンクは、施設ユーザの操作に依存せずに、関連する治験薬調剤の発生を包括的に転送できるようにするためにサポートされていません。 |
| 併用薬 | G.* | 製品 / 製品の投与量 | これらのフォームは、必ずしも研究プロトコルの一部ではない、被験者 に投与された他の薬剤または製品を追跡します。 Safety システムおよびケースでは、これらは 製品 とも呼ばれ、1つ以上の 投与/投与量 がグループ化されます。 |
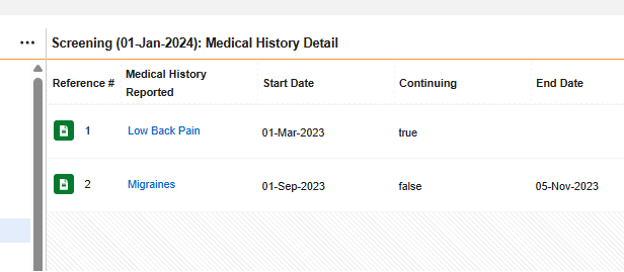
| 病歴 | D.7.* | 病歴 & 併存症状 | これらのフォームは 被験者 の、通常は 治験 への参加前の、過去の疾患または処置を記録するものです。 |
| 薬歴 | D.8.* | 薬歴 | これらのフォームは 被験者 の、通常は 治験 への参加前の、過去の薬歴を記録するものです。 |
| 検査結果 | F.* | 検査結果 | これらのフォームは、 被験者 が経験している出来事に関連していると思われる特定の検査結果と診断結果を記録するものです。 |
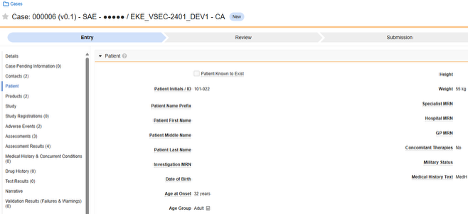
| 患者特性 | D.1 から D.6 | 症例 | このフォームは、生年月日や性別など、 被験者 の一般的な特性を記録するものです。 |
| 死亡例 | D.9.* | 患者または死因 | 被験者が死亡した場合、このフォームには死亡日や死亡原因などの関連情報が記録されます。 |
フォーム設定を作成する方法
新しい フォーム設定 を作成するには:
- スタディ のStudio > フォーム設定 に進みます。
- 完了したら、保存と終了をクリックします。
ボタンが見つかりません: 必要な権限があるにもかかわらず、[+ 新しいフォーム設定] ボタンが表示されない場合は、まず安全性構成が保存されていることを確認してください。
オプション フォーム プロパティ、 アイテム構成、および 組入基準 については、このドキュメントの後のセクションで安全性タイプ別に詳します。
各ステップで、 [保存] ボタンをクリックすると、次のステップに進まずにその情報が保存されます。[保存して次へ] ボタンをクリックすると、情報が保存され、次のステップに進みます。
フォーム設定の削除
単一の フォーム設定 または すべての フォーム設定 を一度に削除してやり直すことができます。 フォーム設定に関連付けられた安全性ケースがある場合、Vault は該当する削除オプションを無効化します。
単一のフォーム設定を削除するには:
- スタディ のStudio > フォーム設定 に進みます。
- フォーム設定の名前にカーソルを合わせると、アクションメニューが表示されます。
- 削除を選択します。
- 確認ダイアログで、削除をクリックします。
フォーム設定のコピー
現在のリリースでは、安全性フォームの設定情報をコピーする唯一の方法は、「フォームのコピー」を使用することです。その他のコピー レベル (コピー イベント グループとコピー イベント) では、フォーム レベルの安全性構成のコピーはサポートされていません。
ソース ライブラリ/スタディから イベント グループ または イベント がコピーされ (フォーム を含む)、それらの フォーム に安全性フォームの設定情報が含まれている場合は、後続のアクションとして「 既存の使用 / 変更を加えて更新 」オプションを指定して [フォームのコピー] を使用します。
フォーム のコアコピーを実行するときに安全性フォーム設定をコピーすることは任意です。
含める セクションで、 安全性構成 を選択して、以前に設定した設定をコピーする必要があります。
コピー中に既存の安全性構成を取り込むシナリオ:
-
後でコピー: これは、以前に フォーム でコピーした場合 ( イベント グループのコピー または イベントのコピー を使用)、または最初に安全性構成を含めずに フォームのコピー を使用した場合に実行されます。変更を加えて更新 をチェックする必要があります。このシーケンスは、フォーム調整の場合など、「適合するもの」をコピーします。ここで、AE フォームはターゲットスタディにすでに存在します。
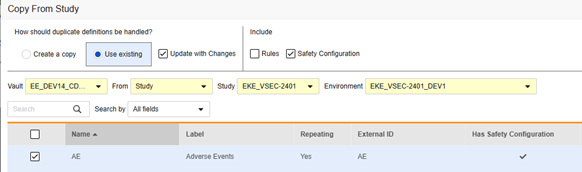
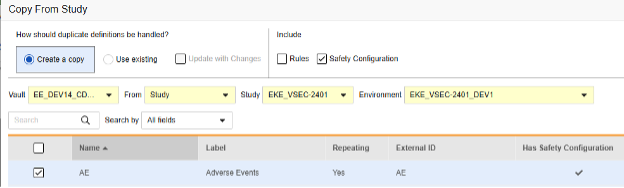
フォームの安全性構成をコピーするには:
- Stutio>フォームへ移動します。
- 試験からコピーをクリックします。
- 必要に応じて、 コピーを作成 または 既存のものを使用/変更を加えて更新 を選択します(上記の例を参照)。
- フォームに関連付けられた安全性構成の設定もコピーするには、安全性構成チェックボックスを選択します。Vault は、ダイアログの [安全設定あり] 列に、どのフォームに安全設定があるかを示します。これには、安全設定の管理権限を持つスタディロールが必要です。ソース スタディとターゲット スタディの安全性構成が一致しない場合は、 安全性構成 チェックボックスは 無効 になります。両方で設定されていて、同じ 安全性統合タイプを使用している必要があります。
- Vault を選択します。
- 試験からコピーの場合、コピー元を選択します (他の試験からまたはライブラリから。)
- コピー元となる試験環境を選択します。
- 検索またはスクロールして、コピーしたい フォーム定義 を探します。
- コピーしたい フォーム を選択します。
- フォームをコピーをクリックします。Vault は、試験に対してフォーム定義のコピーを開始します。
- 任意の作業: 試験からコピーダイアログで以下を行います:
- サマリーを表示をクリックして、コピー済みのフォームおよびコピーのステータスを確認します。
- コピーした フォーム が 20 個以下の場合、ログを表示 をクリックすると、コピーした各オブジェクトレコードの詳細なステータス情報が表示されます。
- フォームを 20 個以上コピーした場合、Vault は完了時にログファイルをダウンロードするためのリンクをメールで通知します。
- 終わったら、閉じるをクリックします。閉じるをクリックすると、サマリーまたはログファイルにアクセスできなくなります。
- コピー後は必ずコピーしたフォームの安全フォーム設定を参照してください。マッピング/値の変換の調整が必要になる場合があります。
コピーフォームの詳細については、「 デザインのコピー」を参照してください。
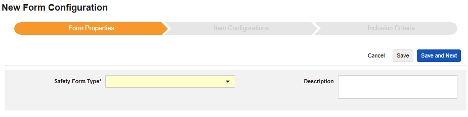
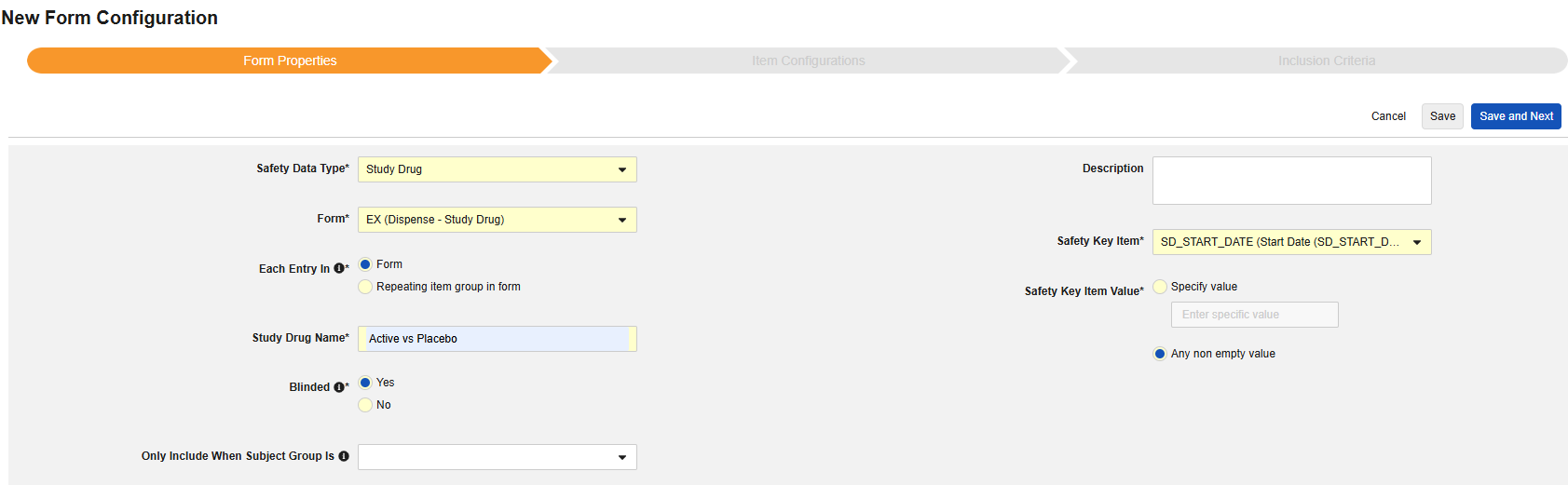
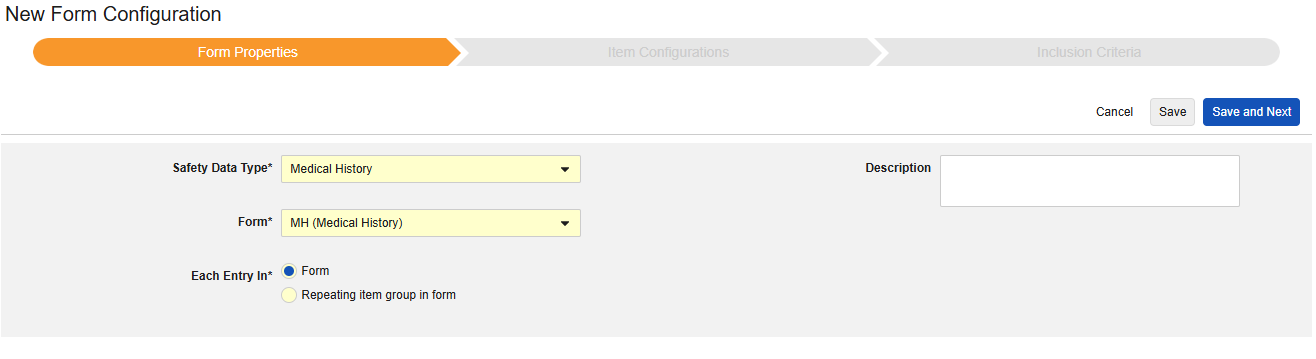
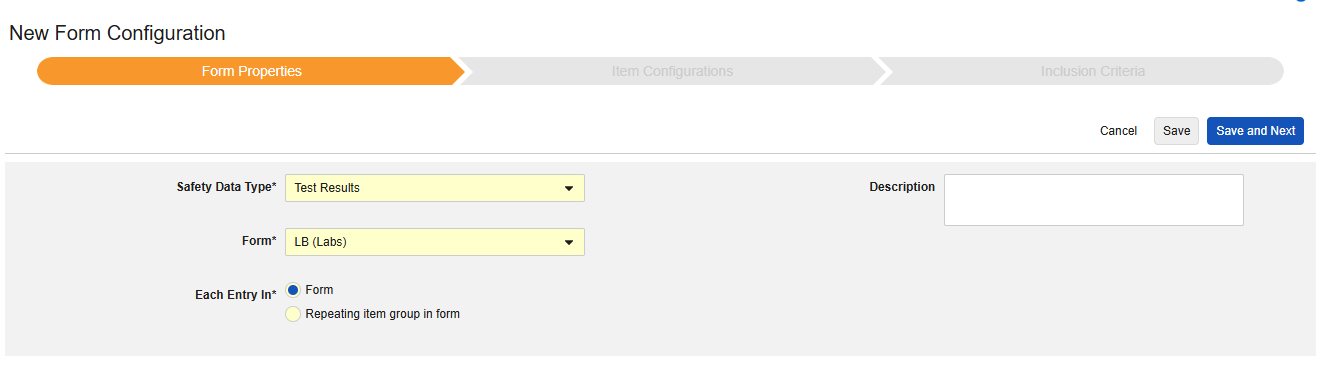
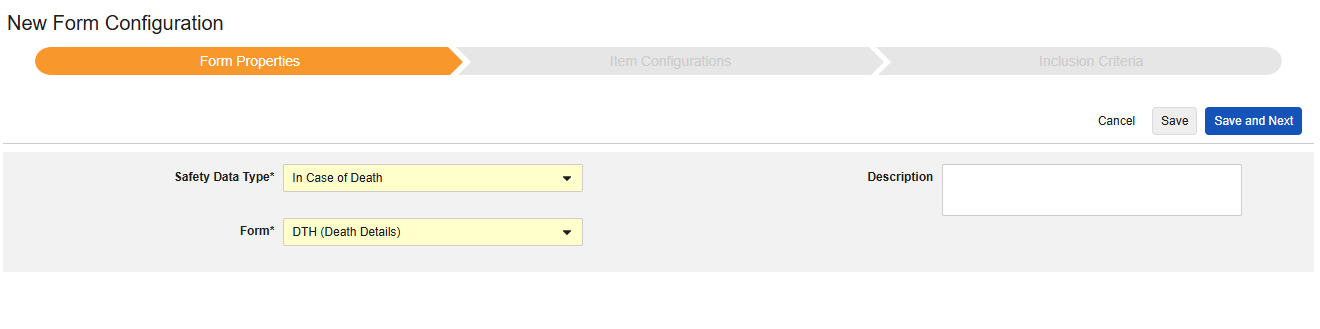
フォームのプロパティ
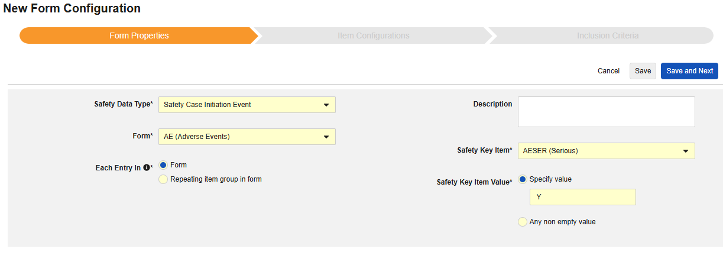
フォーム設定 の最初のステップは、 フォームのプロパティ です。ドロップダウン メニューから Safety タイプ を選択すると、一般的なプロパティを設定できるようになります。これらは 安全性データタイプによって異なります。
| 安全性データタイプ | プロパティ | ||||
|---|---|---|---|---|---|
| フォーム | Safety キーアイテム | 各エントリイン | 製品情報 | 説明 | |
| 安全性ケース開始イベント | * | * | * | ||
| 治験薬 | * | * | * | * | |
| 併用薬 | * | * | |||
| 病歴 | * | * | |||
| 薬歴 | * | * | |||
| 検査結果 | * | * | |||
| 患者特性 | * | ||||
| 死亡例 | * | ||||
|
* このプロパティが安全性データタイプのためにあり、必須であることを示します。 このプロパティが安全性データタイプのためにあり、オプションであることを示します。 |
|||||
- フォーム では、安全性関連項目へのマッピングのために EDC フォームを選択する必要があります。
- 安全性キーアイテム は、他の基準よりも先にフォームがケースの開始または包含の対象として考慮されるかどうかを評価する特別なプロパティです。安全性ケース開始イベント タイプの場合、ケース全体の初期送信 (または後の無効化) を駆動します。治験薬 タイプの場合、これは他の日付ベースの基準が評価される前の、包含するための初期基準です。
- 各エントリイン は、EDC フォームの設計に基づいて情報をさまざまな安全性データタイプにグループ化するための設定を示します。例と詳細については次のセクションを参照してください。適切な安全性構成のためには、これを理解することが非常に重要です。
- 製品情報 は、試験の既知の治験薬、名前、盲検化(または非盲検化)、適応症、適用される研究グループに関する情報です。
- 説明 は、スタディデザイナーにとって役立つオプションのテキストです。
各エントリイン - 設計上の考慮事項
安全性フォーム設定の フォーム プロパティ における 「各エントリイン」 の概念は、データ転送の設定の鍵となります。 これは、Veeva EDC に対して、(繰り返し)フォーム上のデータまたはフォーム上の繰り返しアイテムグループのデータを考慮するように具体的に指示します。このオプションには 2つの選択肢があります。
- フォーム: 繰り返しのないアイテム グループのフォームに入力されたデータは転送対象として考慮されます。フォームは、たとえば調査で複数のイベントを許可するなどのために繰り返すことができますが、フォーム上のアイテムグループは繰り返すことはできません。
- フォーム内の繰り返しアイテムグループ: フォーム上の繰り返しアイテムグループに入力されたデータは転送対象として考慮されます。この場合、複数のイベントはフォームの繰り返しではなく、アイテム グループの各繰り返しによって表されます。
フォーム上の一部の項目構成では、各エントリイン フォーム プロパティから利用可能な選択肢が異なります。 このタイプのほとんどのアイテム構成は「単一エントリ」として意図されていますが、一部の外れ値は非繰り返しのみ、または制限なし(繰り返しアイテムまたは非繰り返しアイテム)である必要があります。外れ値の詳細については、このページの後半にあるタイプ別のサブセクションを参照してください。
各エントリイン: フォーム
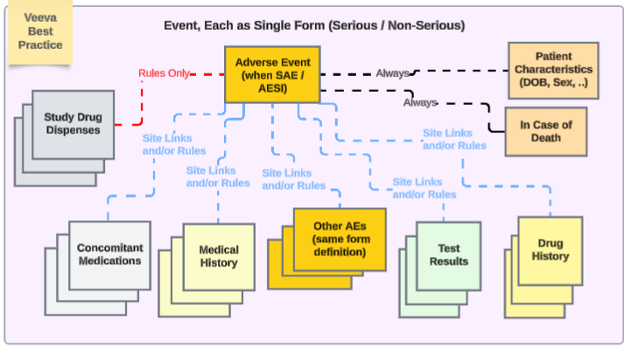
安全性統合によるスタディデザインに関する Veeva のベスト プラクティスでは、さまざまな安全性タイプ全体で繰り返しフォームを使用することが推奨されています。
この例では、
- 有害事象フォーム は、重篤でなくても重篤であっても、同じフォーム デザインを使用します。これにより、施設 ユーザのアップグレード/ダウングレードの問題が回避され、ある場所 (非重篤な AE フォーム) から別の場所 (重篤な SAE フォーム) に移動する必要がなくなり、その逆も回避されます。
- 複数の安全性事例を EDC ユーザが管理する必要がある場合は、日付ルールや特定の施設 リンクを使用して、他の重大または非重大なイベントをプライマリイベントに含めるようにします。
- その他の安全性データ タイプは、単一の回答情報 (患者特性 および 死亡の場合) を除き、それぞれ繰り返し形式です。この意味での「繰り返し形式」とは、次のいずれかであることに注意してください。
- フォームは繰り返しとして定義されます(例:ログフォーム)
- または、試験訪問スケジュール全体で使用される非反復形式です(例: 治験薬 が訪問1、次に訪問2で使用されるなど)。
- 治験の必要性に応じて、施設の意見(リンク)や日付に基づく包含ルールに、さまざまなタイプにわたる適切な関連データを含めることができます。
この設定を使用した治験例と、スタディデザインのフォームに適用される安全性データタイプ:
カスタム フィールド: Safety-EDC 接続を使用すると、Veeva Safety のカスタム/設定済みフィールドを使用して、転送可能なフォーム/データを拡張できます。
各エントリイン: 繰り返しアイテムグループ対フォーム
この試験を、 各エントリイン の両方のオプションを使用する例として考慮してください。
- フォーム 被験者の履歴/治療法 では、最初のアイテムグループで、繰り返しのない質問がいくつか尋ねられます。
- 「 報告する特定の病歴の詳細はありますか? 」という質問に「 はい 」と回答すると、フォーム送信時の動的ルールによってスケジュールの次のフォームである 病歴の詳細 が開きます。そこに入力されたフォームには、フォームごとに病歴のエントリが含まれます。
- 「 登録されている場合、併用Medical療法はありますか? 」に「 はい 」と回答すると、プログレッシブ表示を使用して、同じフォーム上に繰り返しアイテムグループが表示されます。病歴のエントリは、必要に応じて、同じフォーム内の繰り返しアイテムグループとしてそれぞれ入力されます。
- フォーム 病歴の詳細 は繰り返しますが、繰り返しのないアイテムグループ/質問はすべてそのデザインに含まれているため、 各エントリ = フォーム
- 上に示した例では、安全性ケースに 4つの病歴があるとみなされる安全性構成は次のとおりです。
- フォーム CTHERAPY (被験者の病歴/治療法):
- タイプ = 病歴
- エントリイン = フォーム内の繰り返しアイテムグループ
- フォーム MH (病歴の詳細):
- タイプ = 病歴
- 各エントリイン = フォーム
- フォーム CTHERAPY (被験者の病歴/治療法):
各エントリ: 繰り返しアイテムグループ対フォーム
1 つの EDC フォーム設計で安全性ケース内の複数のイベントを追跡する研究の場合、アプローチは次のようになります。
- 安全性ケースは、イベントを含むフォームが存在するだけで開始されます。
- このスタディデザインでは、各エントリイン を フォーム内の繰り返しアイテムグループ に設定する必要があります。
セーフティキーアイテム / 値
フォーム プロパティ 設定の セーフティキーアイテム および セーフティキーアイテム値 は、ケースの開始またはケースへのフォームの組み込みを評価します。これらは次の安全性タイプに適用されます:
- 安全性ケース開始イベント - システム評価が 真の場合、安全システムへの最初の転送が開始されます。逆に、システムが評価を 偽 と判断し、以前に安全性ケースが送信されていた場合、 無効化 が安全システムに送信されます。
- 治験薬 - システム評価が 真の場合、フォーム上の調剤情報はケースに含めるのに適格であるとみなされます。治験薬の組入基準をさらに評価することで、安全性ケースとのデータ転送が最終的に決定されます。
安全性キーアイテム値 を コードリスト に参照するには、コードリスト ラベルではなく、コードリスト コードの指定が必要になることに注意してください。
安全性ケース開始イベント タイプの一般的な例をいくつか示します。
例 1
安全性キーアイテムはコードリスト項目 「AESER」を参照し、 コードリストコード 「Y」によって安全性ケースが開始されることを期待します: 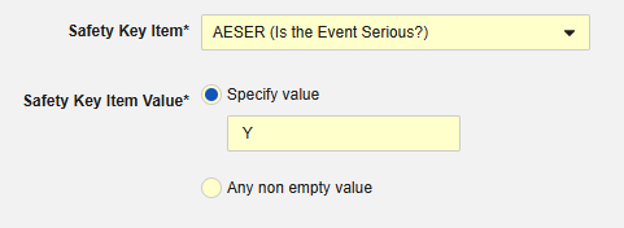
安全性キーアイテムとは、AE フォームの次の項目を指します。安全性キーアイテム値 には コードリスト コード が必要ですが、施設 ユーザは コードリスト ラベル から選択することに注意してください。
- この規定の回答を記載したフォームを最初に 送信 すると、フォームと関連データの安全な転送が可能となります。
- 転送は設定されたタイミングで実行されます。詳細については、 「Safety 統合の管理」の「Safety 設定」 を参照してください。
- さらに、転送を続行するには、フォームの安全性フィールド 「報告されたイベント」 にも空でない値が設定されている必要があります。
- この例では、有害事象フォームの 重大な質問 を使用して、安全性ケースを送信するかどうかを決定します。このフィールドは、どの研究/フォーム設計でも、通常は安全性のフィールド 「重篤な」 にマッピングされます。
最初に安全性システムに送信されてからしばらく経つと、これらの条件のどちらも満たされなくなります。(例: Serious = No、または報告されたイベント値がない)。そうであれば、システムは自動的に安全性システムに 無効化 フォローアップを送信し、安全性ケースとして適格ではなくなったことを示します。施設 ユーザがフォーム データを変更すると、安全性の統合に関して特別な施設 アクションは必要ありません。
例 2
例 1 では、深刻な質問を安全性キーアイテムとして使用しました。ただし、安全性移管場所にマッピングするために使用されていないフィールドであっても、任意のフィールドをこの目的に使用できます。
この例では、代わりに AE フォームからのより一般的な質問を使用します。
これはフォーム上の主要な重大な質問ではありませんが、重大な有害事象と「特に注目すべき有害事象」(AESI) の両方について安全性ケースを開始することができます。これらの有害事象は重大ではない可能性がありますが、それでも安全性システムにデータを送信する必要があります。
例 3
次の例では、1 つの安全性キーアイテム値を使用しながら、安全性ケースの開始と無効化が施設ユーザにとってより透過的になっています。
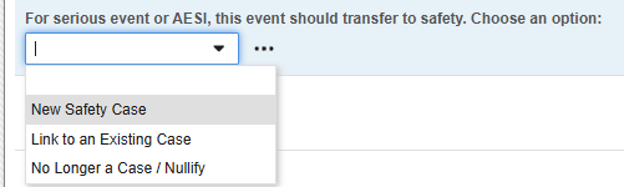
コードリスト項目では次のオプションが使用できます。
- 新しい安全性ケース: (そのコードリスト コード) は、 安全性キーアイテム値に使用されます。したがって、この選択によってのみ安全性ケースが開始されます。
- 既存のケースへのリンク: 回答すると、このコードは安全性キーアイテム値を 偽 として評価します。したがって、フォームはスタンドアロン/追加のケースを開始しません。代わりに、デザインルールを使用して、施設 ユーザが現在のフォームを、安全性ケースを開始した別のイベントにリンクしていることを確認します。
- 対象外..: これは、以前は安全性ケースの対象となっていたが、転送されたイベントに使用されます。施設 ユーザがダウングレードまたは無効化を示す場合、EDC システムはこの選択のコードリスト コードを偽と評価します。これにより、以前に開始された安全性ケースの無効化フォローアップが行われます。
無効化
安全性ケース内のデータに変更が発生するたびに、Veeva EDC からフォローアップが複数送信されます 。無効化 は、次のような特性を持つ特別な種類のフォローアップです。
- これは、次のいずれかが該当する場合に発生します。
- 安全性キー項目および安全性キー項目値の評価が偽になります
- または、EDC フォームの報告済み事象安全性フィールド位置の項目値が空になります
- これは、Veeva Safety への次のメッセージで無効化タイプとして記録されます。
- これは 安全性システムへの安全性ケースの最後の送信です
- 注: このケースの最初の送信は以前に発生しました。Veeva EDC は、最初の送信時 (つまり、最初の送信タイマーの後) に上記の 2 つの条件を再評価し、安全性システムに送信せずに安全性ケースを直ちに無効化します。これは、最初の送信のタイマーが終了する前に、施設 ユーザがミスをしたり、フォームをリセットしたりした場合に最もよく発生します。
- 安全性報告では通常、このような移管の無効化理由が必要となります。試験は、施設ユーザに情報を求めるように設定できます。施設回答が設定されていない場合、または施設が回答に失敗した場合、システムはデフォルトの理由を使用します:「ケースは、最初に送信されたときの条件を満たさなくなりました。これには、現在では重大ではないイベントに格下げされたイベントや、ユーザ操作によってすべてのイベントが削除されることが含まれます。」
無効化の一般的な例:
- EDC フォームのリセット
- 前回のフォーム送信後、EDC フォームの特定の部分が意図的に空白のままになっています
- 「ダウングレード」、例えば、以前は 安全性キーアイテム/値 を介して安全性ケースを満たしていた状況は、もはや満たされていないが、イベントは依然として継続しています
Veeva EDC で安全性ケースの無効化が発生すると、アクティブな安全性ケースには戻りません。 同じフォームを変更して、 安全性キーアイテム/値 を真にし、 E.i.1.1a の値が空でないようにすると、新しい安全性ケースが作成され、送信されます。元の安全性ケースは再開されません。
安全性データタイプによる
これらのセクションでは、各 安全性データ タイプ のフォーム設定手順について説明します 。
安全性ケース開始イベント
この安全性データ タイプのフォーム設定は、安全性ケースの転送プロセスを開始するために重要です。その後、他のすべての安全性データ タイプは、設定されたルールに従ってケースに組み込まれます。イベントは Veeva Safety のこのセクションに表示されます。
Veeva Safety EDC 接続では、複数のフォームを安全性ケース開始イベントとして設定することができます。これにより、有害事象フォームのデザインに柔軟性を持たせることができます。この機能により、重篤な有害事象と、妊娠など安全性システムに報告が必要なその他の状況について、別々のフォームを作成することができます。
安全性ケース開始イベントフォームを設定するには:
- スタディ のStudio > フォーム設定 に進みます。
- + 新規フォーム設定をクリックします。
- 安全性データタイプに対して、安全性ケース開始イベントを選択します。
- フォームを選択します。
- 各エントリーインに対して、個々の ケースを決定するための方法を選択します:
- フォーム: フォームの各インスタンスを独自のケースとして扱うには、このオプションを選択します。
- フォーム内の繰り返しアイテムグループ: 繰り返しアイテムグループの各インスタンスを独自のケースとして扱うには、このオプションを選択します。
- 任意の作業: 説明を入力します。
- 安全性キーアイテム値を定義します:以下から1つ選択します:
- 値を指定: このオプションでは、一致させる特定の値を入力する必要があります。コードリスト タイプ アイテム の場合、コードリスト アイテムの コード ではなく ラベル を指定する必要があることに注意してください。
- 空でない値: このオプションは、空でない値を一致と見なします。
- [保存] または [保存して次へ] をクリックして、アイテム構成手順に進みます。
安全性データ タイプ、 フォーム、 各エントリ設定 は、最初に保存された時点での読み取り専用となります。[アイテム構成] タブと [組入基準] タブでの追加構成は、これらの設定に依存します。これらの設定のいずれかを変更するには、フォーム構成を削除して再度作成する必要があります。
治験薬
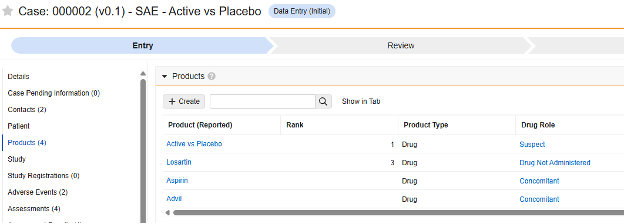
この安全性データ タイプは、臨床試験で被験者に対してテストされている治験薬の投与量 / 調剤情報を追跡するために使用されます。情報は、Veeva Safety の 製品 / 製品投与量 セクションに送信されます。以下の例では 2 つの薬剤を示しています。
複数のフォーム: 治験薬 の安全性データ タイプを使用して、複数の フォーム定義 を設定できます。
治験薬フォーム (旧ラベル治療) のデータを含める方法:
- スタディ のStudio > フォーム設定 に進みます。
- + 新規フォーム設定をクリックします。
- 安全性データタイプのスタディ薬を選択します。
- 各エントリーインに対して、個々のスタディ薬を決定するための方法を選択します:
- フォーム: フォームの各インスタンスを独自のスタディ薬として扱うには、このオプションを選択します
- フォーム内の繰り返しアイテムグループ: 繰り返しアイテムグループの各インスタンスを独自のスタディ薬として扱うには、このオプションを選択します。
- 治験薬名を入力します。この値は、Veeva Safety での薬剤の命名方法と一致する必要があります。不一致によって転送/フローが停止することはありませんが、最終的には同期が必要になります。
-
盲検化に対してはいまたはいいえを選択します。試験において、治験薬が 盲検化 されているか(またはされていないか)を示します。このプロパティは単なる指標であり、レポート目的でのみ使用されます。EDC のデータに制限が適用されている場合でも、すべてのデータは安全性システムに非盲検で転送されます。
-
オプション: 被験者が特定の被験者グループに属している場合にのみ、このフォームに含めるよう選択できます。被験者グループが次の場合にのみ含めるでグループを選択します。選択されたグループに含まれない被験者の場合、転送時に治験薬フォームは含まれません。このフィールドが空白の場合、組み入れ基準が満たされると、すべての被験者のフォームが Vault に含まれます。
- 任意の作業: 説明を入力します。
- Safety キーアイテムを選択します。これは通常、投与が行われたことを示す項目です。治験薬の種類については、評価はデータ移行に含めるのに適格なフォーム/調剤を検討するために使用されます。安全性ケースに適切な試験薬の調剤を含めるために、追加の 組入基準 も評価されます。
- 安全性キーアイテム値を定義します:以下から1つ選択します:
- 値を指定: このオプションでは、一致させる特定の値を入力する必要があります。
- 空でない値: このオプションは、空でない値を一致と見なします。
- [保存] または [保存して次へ] をクリックして、アイテム構成手順に進みます。
安全性データ タイプ、 フォーム、 各エントリ設定 は、最初に保存された時点での読み取り専用となります。[アイテム構成] タブと [組入基準] タブでの追加構成は、これらの設定に依存します。これらの設定のいずれかを変更するには、フォーム構成を削除して再度作成する必要があります。
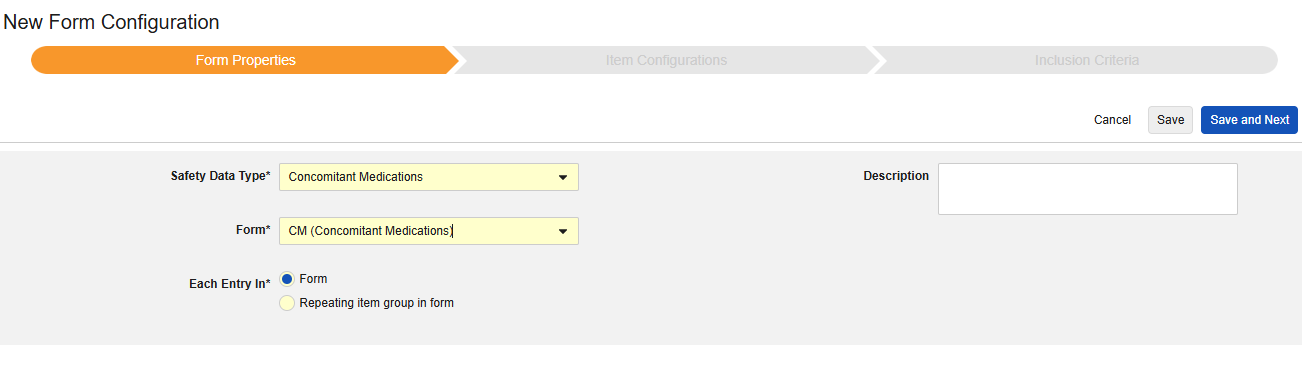
併用薬
このタイプの安全性構成は、治験の併用薬形態に適用されます。情報は、Veeva Safety の 製品 / 製品投与量 セクションに送信されます。以下の例では、 アスピリン と アドビルを示しています。
複数のフォーム: 併用薬 の安全性データ タイプを使用して、複数の フォーム定義 を設定できます。
併用薬を含める方法:
- スタディ のStudio > フォーム設定 に進みます。
- + 新規フォーム設定をクリックします。
- 安全性データタイプの併用薬を選択します。
- 各エントリーインに対して、個々の ConMeds を決定するための方法を選択します:
- フォーム: フォームの各インスタンスを独自の ConMed として扱うには、このオプションを選択します。
- フォーム内の繰り返しアイテムグループ: 繰り返しアイテムグループの各インスタンスを独自の ConMed として扱うには、このオプションを選択します。
- 任意の作業: 説明を入力します。
- [保存] または [保存して次へ] をクリックして、アイテム構成手順に進みます。
安全性データ タイプ、 フォーム、 各エントリ設定 は、最初に保存された時点での読み取り専用となります。[アイテム構成] タブと [組入基準] タブでの追加構成は、これらの設定に依存します。これらの設定のいずれかを変更するには、フォーム構成を削除して再度作成する必要があります。
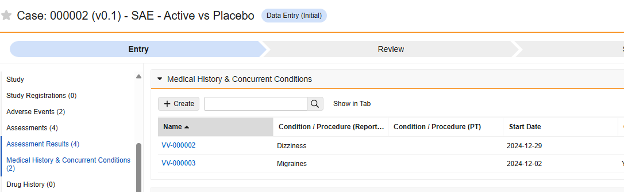
病歴
このタイプの安全性構成は、研究の併用薬形態に適用されます。情報は、Veeva Safety の 病歴 & 併発疾患 セクションに送信されます。
複数のフォーム: 複数の フォーム定義 を 病歴 安全性データ タイプで設定できます。
治療暦を含める方法:
- スタディ のStudio > フォーム設定 に進みます。
- + 新規フォーム設定をクリックします。
- 安全性データタイプの治療歴を選択します。
- 各エントリーインに対して、個々の治療歴イベントを決定するための方法を選択します:
- フォーム: フォームの各インスタンスを独自の履歴として扱うには、このオプションを選択します
- フォーム内の繰り返しアイテムグループ: 繰り返しアイテムグループの各インスタンスを独自の履歴として扱うには、このオプションを選択します。
- 任意の作業: 説明を入力します。
- [保存] または [保存して次へ] をクリックして、アイテム構成手順に進みます。
安全性データ タイプ、 フォーム、 各エントリ設定 は、最初に保存された時点での読み取り専用となります。[アイテム構成] タブと [組入基準] タブでの追加構成は、これらの設定に依存します。これらの設定のいずれかを変更するには、フォーム構成を削除して再度作成する必要があります。
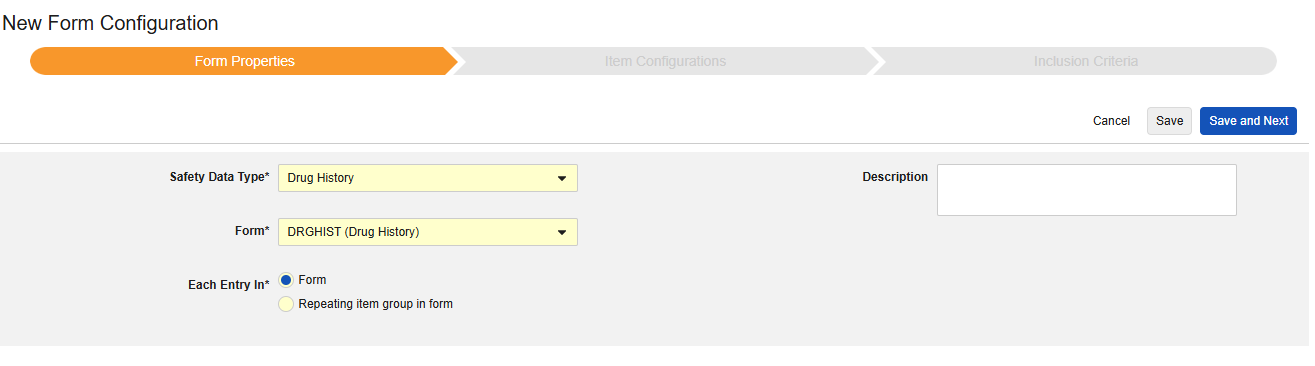
薬歴
このタイプの安全性構成は、治験の薬歴フォームに適用されます。情報は、Veeva Safety の 薬歴 セクションに送信されます。
複数のフォーム: 複数の フォーム定義 を 薬歴 安全性データ タイプで設定できます。
薬歴フォームのデータを含めるには:
- スタディ のStudio > フォーム設定 に進みます。
- + 新規フォーム設定をクリックします。
- 安全性データタイプで薬歴を選択します。
- 各入力箇所に対して、個々の薬歴を決定するための方法を選択します:
- フォーム: フォームの各インスタンスを独自の薬歴として扱うには、このオプションを選択します。
- フォーム内の繰り返しアイテムグループ: 繰り返しアイテムグループの各インスタンスを独自の薬歴として扱うには、このオプションを選択します。
- 任意の作業: 説明を入力します。
- [保存] または [保存して次へ] をクリックして、アイテム構成手順に進みます。
安全性データ タイプ、 フォーム、 各エントリ設定 は、最初に保存された時点での読み取り専用となります。[アイテム構成] タブと [組入基準] タブでの追加構成は、これらの設定に依存します。これらの設定のいずれかを変更するには、フォーム構成を削除して再度作成する必要があります。
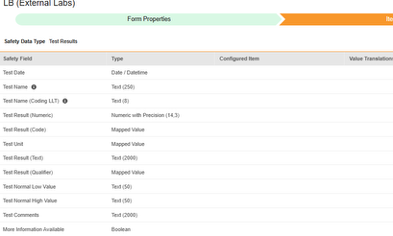
検査結果
このタイプの安全性構成は、治験のラボ / 検査結果フォームに適用されます。情報は、Veeva Safety の 検査結果 セクションに送信されます。
複数のフォーム: 複数の フォーム定義 を 検査結果 安全性データ タイプで設定できます。
Veeva EDC でローカル ラボ モジュール (ラボ パネル) を使用する場合、フォームは追加の安全性構成で特別に設定されません。代わりに、ラボの日付が安全性ケースの開始に近いすべてのテストは、レビューのために Veeva Safety に送信されます。そこで、Veeva Safety ユーザは、医学的レビューごとに特定のテストをケースに含めることができます。ケースの周辺日数の範囲は、 治験の安全設定 で設定されます。
検査結果のデータフォームを含めるには:
- まだ編集モードでない場合、編集をクリックします。
- 検査結果をクリックし、そのセクションを展開します。
- テスト結果を含めるについては、はいを選択します。
- テスト結果フォーム を選択します。
- フォームに含まれる各フィールドの品目を選択します。品目は正確なデータタイプでなければならないことに注意してください。品目とその予想されるデータタイプのリストは、下表を参照してください。
- [保存] または [保存して次へ] をクリックして、アイテム構成手順に進みます。
安全性データ タイプ、 フォーム、 各エントリ設定 は、最初に保存された時点での読み取り専用となります。[アイテム構成] タブと [組入基準] タブでの追加構成は、これらの設定に依存します。これらの設定のいずれかを変更するには、フォーム構成を削除して再度作成する必要があります。
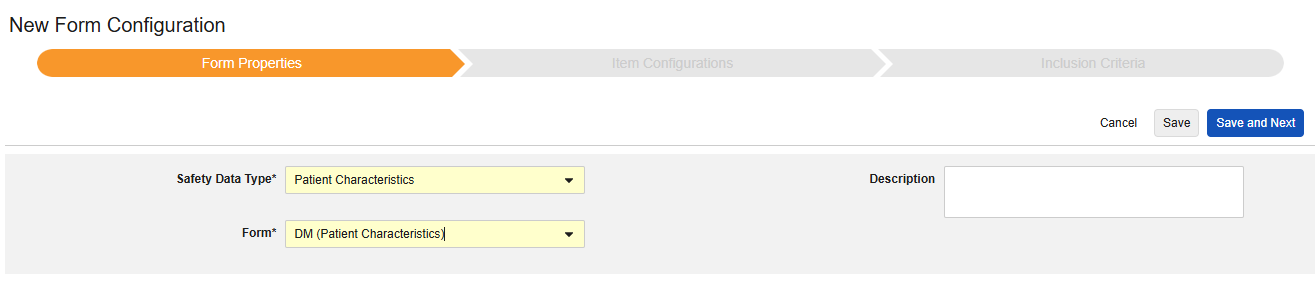
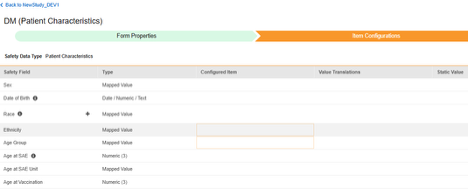
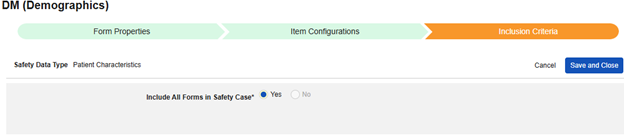
患者特性
このタイプの安全性構成は、対象に関する一般的な情報に適用されます。情報は、Veeva Safety の 患者 セクションに送信されます。
複数のフォーム: 複数の フォーム定義 を 患者特性 安全性データ タイプで設定できます。たとえば、あるフォームでは 性別 の項目を収集し、別のフォームでは 生年月日 の項目を収集することができます。
患者特性を含める方法:
- スタディ のStudio > フォーム設定 に進みます。
- + 新規フォーム設定をクリックします。
- 安全性データタイプの症例特性を選択します。
- 任意の作業: 説明を入力します。
- [保存] または [保存して次へ] をクリックして、アイテム構成手順に進みます。
安全性データ タイプ、 フォーム、 各エントリ設定 は、最初に保存された時点での読み取り専用となります。[アイテム構成] タブと [組入基準] タブでの追加構成は、これらの設定に依存します。これらの設定のいずれかを変更するには、フォーム構成を削除して再度作成する必要があります。
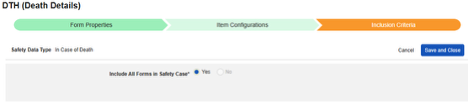
死亡例
このタイプの安全性構成は、対象者の死亡に関する詳細情報を含むフォームに適用されます。このタイプの一部のフィールドは繰り返し不可(例: 死亡日)ですが、その他のフィールドは繰り返しまたは非繰り返し(死因)にすることができます。情報は、Veeva Safety の 2 つの場所、 患者 または 死亡原因に送信されます。
複数のフォーム: 複数の フォーム定義 を 死亡例 安全性データ タイプで設定できます。
死亡例フォームのデータを含める方法:
- スタディ のStudio > フォーム設定 に進みます。
- + 新規フォーム設定をクリックします。
- 安全性データタイプの死亡例を選択します。
- 任意の作業: 説明を入力します。
- [保存] または [保存して次へ] をクリックして、アイテム構成手順に進みます。
安全性データ タイプ、 フォーム、 各エントリ設定 は、最初に保存された時点での読み取り専用となります。[アイテム構成] タブと [組入基準] タブでの追加構成は、これらの設定に依存します。これらの設定のいずれかを変更するには、フォーム構成を削除して再度作成する必要があります。
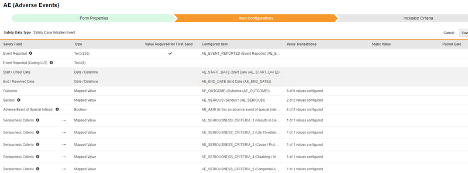
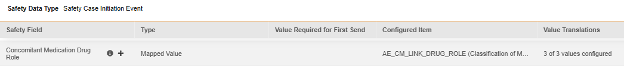
アイテム構成
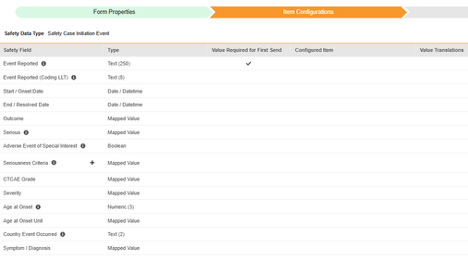
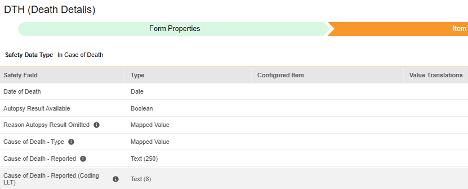
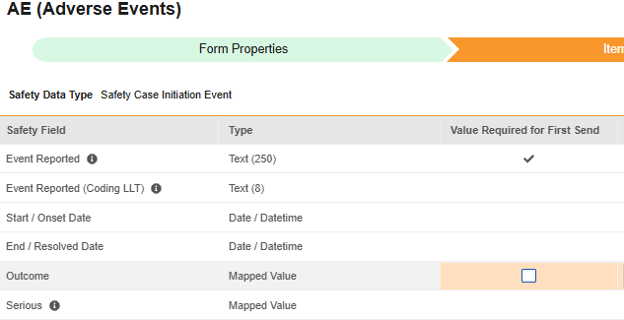
安全フォーム構成の 2 番目の手順は、 [アイテム構成] タブです。例として、この AE (有害事象) フォーム デザインは、 安全性ケース開始イベント タイプに分類されています。
このグリッドの目的は、フォーム デザイン (項目定義) からの回答を Veeva Safety の適切な場所に割り当てることです。
この表はグリッド内の列をまとめたものです。
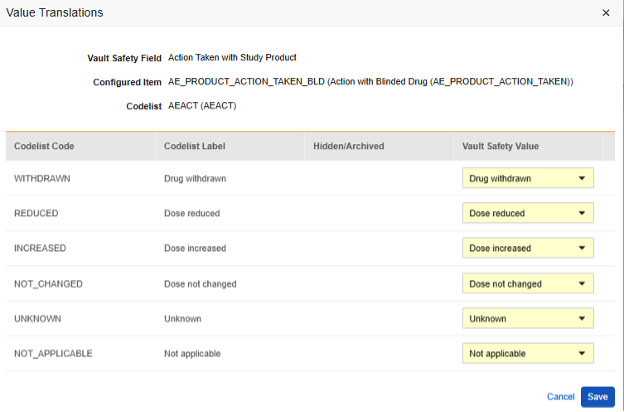
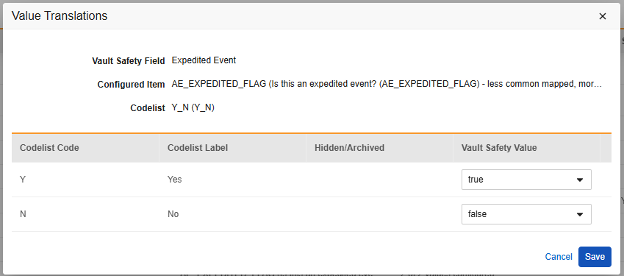
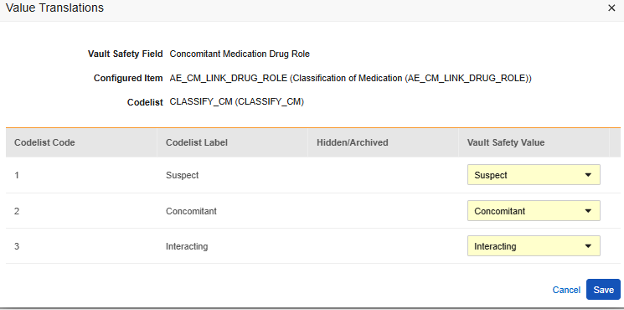
値の翻訳
E2B の場所にマッピングされる アイテム定義 がコードリストまたはブール値 (チェックボックス) データ型であり、E2B の場所に非常に具体的な E2B 値が必要な場合は、転送が正しく機能するように 値の翻訳 を設定する必要があります。
- 構成済みアイテム 列に アイテム定義 を指定します。
-
値の翻訳 列のセルをクリックします。値の翻訳を設定できる場合、セルにマウスを移動すると オレンジ色 で表示されます。これにより、値の翻訳ダイアログが開きます。
- 各コードリスト タイプ アイテムに対して、Veeva Safety で適切な値を選択します。
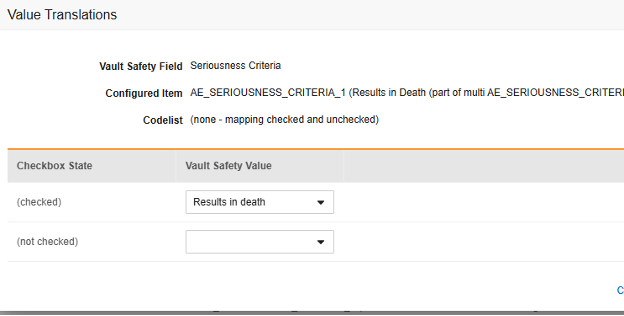
- ブールタイプの 項目の場合、 (チェックあり) または (チェックなし) のいずれかがマッピングされます。例:
- 終了したら、保存をクリックします。
- 値の翻訳が指定されると、構成された翻訳の数がセルに表示されます。
- 独自の標準に従って特定の値を必要とするすべての場所に対してこのステップを繰り返します。これらのいずれかが欠落している場合、スタジオ検証ジョブはエラーを示し、デプロイメントを防止します。
このアクションを実行すると、翻訳値は一時的にのみ保存されます。その後、タブ レベルで [保存] または [保存して次へ] を使用すると、翻訳が保存されます。
静的値
一部の安全性フィールドでは、EDC フォーム定義 の特定の アイテム定義 を使用する代わりに、静的な値が許可されます。 各フィールドの詳細、特に静的値の設定が許可されるフィールドについては、以下の 安全性データタイプのセクション を参照してください。
例:
ペアリング日
一部の安全性フィールドでは、一連の値を Veeva Safety に転送できます。各値は、その値の日付とペアになっています。たとえば、EDC スタディデザイン全体にわたって、Vitals フォームに体重が存在する場合があります。接続により、すべての値が参照用に転送されます。ケース作成の場合、Veeva Safety はケースの開始時または開始前に最も近い値を自動的に決定します。その他の値は追加の被験者情報として利用可能になり、Veeva Safety で確認できます。このような値とペアになる日付は、 イベント日付 、または同じフォーム上の別の日付タイプの アイテム定義 の値のいずれかになります。
各フィールドの詳細、特にどのフィールドがこの方法で構成できるかについては、 安全性データ タイプ別のアイテム構成 を参照してください。
例:
治験薬の関連付け
Safetyフィールドには、回答が適用される特定の治験薬も示さなければなりません。
各フィールドの詳細、特にどのフィールドが各治験薬で回答できるかについては、 安全性データ タイプ別のアイテム構成 を参照してください。
例:
-
重要なイベントと治験薬に関する質問への回答 - 治験薬で講じた措置、 治験薬に対する評価結果、 治験薬の再開時に反応/イベントが再発したか - が設定されている場合は、各治験薬について回答します。
-
上記の静的な値は、フォーム上の項目ではなく、 治験薬の評価元ごとにも設定されます。
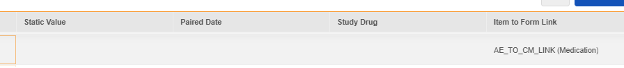
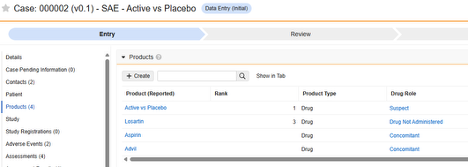
項目からフォームへのリンク関連付け
現在、アイテム構成 は、アイテムからフォームへのリンク タイプの アイテム定義 と「リンク付き」で提供される回答との関係に関与するものが1つだけです。 具体的には、安全性ケース開始イベント データタイプ、 併用薬薬剤役割 のフィールド:
EDC フォームに記載された回答には、併用薬に関する現場の意見が含まれます。特定の安全性ケース/イベントについては、施設はそれにリンクしますが、併用薬とは異なる意見/回答を提供し、相互作用または疑わしいものとします。上記のアイテム定義 AE_CM_LINK_DRUG_ROLE は、値の翻訳を含む質問です。
安全性ケース開始イベント フォーム デザインには複数のアイテムからフォームへのリンクが存在する可能性があるため、特定の アイテムからフォーム リンクを選択する必要があります。この例では、 AE_TO_CM_LINK という名前の アイテム定義 は次のようになります。
安全性データタイプによる
安全性ケース開始イベント
この安全性データ タイプのフォーム設定は、安全性ケースの転送プロセスを開始するために重要です。その後、他のすべての安全性データ タイプは、設定されたルールに従ってケースに組み込まれます。イベントは Veeva Safety のこのセクションに表示されます。
この安全性データ タイプに対して アイテム構成 ステップを実行するには:
- スタディの スタジオ >> フォーム設定 に進みます。
-
マップする行ごとに、 構成アイテム 列のセルを使用して、適切な アイテム定義 を選択します。たとえば、Veeva 安全性フィールドの 報告されたイベントフォームから AETERM 項目を選択します (下図)。 選択項目は通常、 事前に保存されたフォームプロパティ > 各エントリ インに依存します (前の手順)。一部の安全性ロケーションには、繰り返しアイテム グループまたは非繰り返しアイテム グループのみで実行できる、あるいはその両方で実行できることを示す特別なルールがあります。それらの外れ値と、このタイプのすべての Safety 場所に関する重要な注意事項については、これらの手順の最後にある表を参照してください。
-
マッピングする行ごとに、 [最初の送信に必要な値] チェックボックスをオンにして、この アイテム に最初の送信時に値を設定することを必須にします。それ以外の場合は、このチェックボックスをオフのままにしておきます。
- 構成アイテム と 安全性フィールド のデータタイプに応じて、 値の翻訳 を指定する必要がある場合があります。手順については、上記の 値の翻訳 セクション を参照してください 。
- 安全性フィールド に応じて、追加情報が必要になる場合があります。行内の適切なセルを使用して、次の情報を入力します。
- 「保存」 (ページに留まる場合)または 「保存して次へ」 (次のタブ「 組入基準」に進む場合)をクリックします。
| EDC 安全性データタイプ | EDC フィールドラベル | フィールドデータタイプ | メモ | 関連するE2B(R3)の場所 | 受信ボックスアイテム/ ケースオブジェクト & フィールド |
EDC フィールド識別子 |
|---|---|---|---|---|---|---|
| 安全性ケース開始イベント | 報告済み事象 | テキスト (250) |
|
E.i.1.1a, E.i.1.2 | case_adverse_event__v, event_reported__v | AE_EVENT_REPORTED |
| 安全性ケース開始イベント | 報告済み事象 (コーディング LLT) | テキスト (8) |
|
E.i.2.1a, E.i.2.1b | case_adverse_event__v, event_meddra__v | AE_CODING_LLT |
| 安全性ケース開始イベント | 開始 / 発現日 | 日付 / 日時 |
|
E.i.4 | case_adverse_event__v, onset_idate__v | AE_START_DATE |
| 安全性ケース開始イベント | 終了 / 解決日 | 日付 |
|
E.i.5 | case_adverse_event__v, resolved_idate__v | AE_END_DATE |
| 安全性ケース開始イベント | 結果 | マッピングされた値 |
|
E.i.7 | case_adverse_event__v, outcome__v | AE_OUTCOME |
| 安全性ケース開始イベント | 重症 | マッピングされた値 |
|
E.i.3.1 | case_adverse_event__v, highlighted_term__v | AE_SERIOUS |
| 安全性ケース開始イベント | 特に関心のある有害事象 | ブーリアン |
|
case_adverse_event__v, aesi_watchlist__v | AE_AESI | |
| 安全性ケース開始イベント | 重症度基準 | マッピングされた値 |
|
E.i.3.2a, E.i.3.2b, E.i.3.2c, E.i.3.2d, E.i.3.2e, E.i.3.2f | case_adverse_event__v, seriousness__v | AE_SERIOUSNESS_CRITERIA |
| 安全性ケース開始イベント | CTCAE グレード | マッピングされた値 |
|
case_adverse_event__v, ctcae_grade__v | AE_CTCAE_GRADE | |
| 安全性ケース開始イベント | 重症度 | マッピングされた値 |
|
case_adverse_event__v, severity__v | AE_SEVERITY | |
| 安全性ケース開始イベント | 発現時の年齢 | 数値 (3) |
|
D.2.2a | case_version__v, age_value__v (age_calculation_status__v を「Yes」に設定) | AE_AGE_AT_ONSET |
| 安全性ケース開始イベント | 発現時の年齢単位 | マッピングされた値 |
|
D.2.2b | case_version__v, age_unit__v | AE_AGE_AT_ONSET_UNIT |
| 安全性ケース開始イベント | イベントが起こった国 | テキスト (2) |
|
E.i.9 | case_adverse_event__v, event_country__v | AE_EVENT_COUNTRY |
| 安全性ケース開始イベント | 症状/診断 | マッピングされた値 |
|
case_adverse_event__v, symptom_diagnosis__v | AE_SYMPTOM_DIAGNOSIS | |
| 安全性ケース開始イベント | 優先イベント | ブーリアン |
|
case_adverse_event__v, expedited_flag__v | AE_EXPEDITED_FLAG | |
| 安全性ケース開始イベント | 医療従事者確認済み | ブーリアン |
|
E.i.8 | case_adverse_event__v, hcp_confirmed__v | AE_HCP_CONFIRMED |
| 安全性ケース開始イベント | 入院日 | 日付 |
|
case_adverse_event__v, hospital_admission_date__v | AE_HOSPITAL_ADM_DATE | |
| 安全性ケース開始イベント | 退院日 | 日付 |
|
case_adverse_event__v, hospital_discharge_date__v | AE_HOSPITAL_DISCHARGE_DATE | |
| 安全性ケース開始イベント | 入院日数 | 数値 (4) |
|
case_adverse_event__v, days_hospitalized__v | AE_DAYS_HOSPITALIZED | |
| 安全性ケース開始イベント | 病院名 | テキスト (200) |
|
case_adverse_event__v, hospital_name__v | AE_HOSPITAL_NAME | |
| 安全性ケース開始イベント | 病院の市町村 | テキスト (35) |
|
case_adverse_event__v, hospital_city__v | AE_HOSPITAL_CITY | |
| 安全性ケース開始イベント | 病院の都道府県 | テキスト (40) |
|
case_adverse_event__v, hospital_state__v | AE_HOSPITAL_STATE | |
| 安全性ケース開始イベント | 症例の記述情報 | テキスト (30000) |
|
H.1(施設の説明文からの抜粋) | case_version__v, site_narrative__v | AE_NARRATIVE |
| 安全性ケース開始イベント | 報告者のコメント | テキスト (20000) |
|
H.2 | case_version__v, reporters_comments__v | AE_REPORTER_COMMENTS |
| 安全性ケース開始イベント | 送信者のコメント | テキスト (20000) |
|
H.4 | case_version__v, sender_comments__v | AE_SENDER_COMMENTS |
| 安全性ケース開始イベント | 無効化の理由 | テキスト (200) |
|
C.1.11.2 | inbox_item__v, edc_reason__v (これは受信ボックスアイテムでのみ使用可能で、ユーザに無効化ケースであることとその理由を示します。ケースデータモデルに影響を与えることはありません)。 | AE_NULLIFY_REASON |
| 安全性ケース開始イベント | 報告者の資格 | マッピングされた値 |
|
C.2.r.4 | case_contact__v, qualification__v | AE_REPORTER_QUALIFICATION |
| 安全性ケース開始イベント | 報告対象言語 | テキスト (20) |
|
E.i.1.1b | case_adverse_event__v, event_reported_language__v | AE_REPORTER_LANGUAGE |
| 安全性ケース開始イベント | 報告者の国 | テキスト (2) |
|
C.2.r.3 | case_contact__v, country_value__v(有効な2文字のISO国の場合) | AE_REPORTER_COUNTRY |
| 安全性ケース開始イベント | 報告者の名 | テキスト (50) |
|
C.2.r.1.2 | case_contact__v, firstname_value__v | AE_REPORTER_FIRST_NAME |
| 安全性ケース開始イベント | 報告者の姓 | テキスト (50) |
|
C.2.r.1.4 | case_contact__v, lastname_value__v | AE_REPORTER_LAST_NAME |
| 安全性ケース開始イベント | 報告者の組織 | テキスト (100) |
|
C.2.r.2.1 | case_contact__v, organization_value__v | AE_REPORTER_ORGANIZATION |
| 安全性ケース開始イベント | 報告者電子メール | テキスト (100) |
|
case_contact__v, email_address__v | AE_REPORTER_EMAIL | |
| 安全性ケース開始イベント | 報告者の電話番号 | テキスト (33) |
|
C.2.r.2.7 | case_contact__v, telephone_value__v | AE_REPORTER_TELEPHONE |
| 安全性ケース開始イベント | 報告者の番地 1 | テキスト (100) |
|
C.2.r.2.3 | case_contact__v, street_value__v | AE_REPORTER_STREET |
| 安全性ケース開始イベント | 報告者の番地 2 | テキスト (100) |
|
C.2.r.2.3 | case_contact__v, street_line_2_value__v | AE_REPORTER_STREET_2 |
| 安全性ケース開始イベント | 報告者市町村 | テキスト (35) |
|
C.2.r.2.4 | case_contact__v, city_value__v | AE_REPORTER_CITY |
| 安全性ケース開始イベント | 報告者の都道府県 | テキスト (40) |
|
C.2.r.2.5 | case_contact__v, state_province_value__v | AE_REPORTER_STATE_PROVINCE |
| 安全性ケース開始イベント | 報告者の郵便番号 / Zip | テキスト (15) |
|
C.2.r.2.6 | case_contact__v, postalcode_value__v | AE_REPORTER_POSTAL_ZIP |
| 安全性ケース開始イベント | 実施された全体的な措置 | マッピングされた値 |
|
G.k.8 | , | AE_ACTION_TAKEN |
| 安全性ケース開始イベント | 併用薬の役割 | マッピングされた値 |
|
G.k.1 | case_product__v, drug_role__v | |
| 安全性ケース開始イベント | 研究製品を使用して実施された処置 | マッピングされた値 |
|
G.k.8 | case_assessment_result__v, action_taken__v | AE_PRODUCT_ACTION_TAKEN |
| 安全性ケース開始イベント | 試験薬の投与再開時に副作用 / 有害事象は再発したか | マッピングされた値 |
|
G.k.9.i.4 | case_assessment__v, reaction_recurrence__v | AE_PRODUCT_ACTION_RECUR |
| 安全性ケース開始イベント | 試験薬の評価結果 | マッピングされた値 |
|
G.k.9.i.2.r.3 | case_assessment_result__v, assessment_result__v または result_text__v | AE_PRODUCT_ASSESS_RESULT |
| 安全性ケース開始イベント | 試験薬の評価方法 | テキスト (60) |
|
G.k.9.i.2.r.2 | case_assessment_result__v, method_of_assessment__v または method_text__v | AE_PRODUCT_ASSESS_METHOD |
| 安全性ケース開始イベント | 試験薬の評価ソース | テキスト (60) |
|
G.k.9.i.2.r.1 | case_assessment_result__v, source_type__v または source_text__v | AE_PRODUCT_ASSESS_SOURCE |
| 安全性ケース開始イベント | 妊娠例 | ブーリアン |
|
case_version__v, pregnancy__v | AE_PREG_CASE | |
| 安全性ケース開始イベント | 妊娠の発生 | 数値 (2) |
|
case_version__v, gravida_gravidity__v | AE_PREG_INFO_GRAV | |
| 安全性ケース開始イベント | 出生数 | 数値 (2) |
|
case_version__v, para_parity__v | AE_PREG_INFO_PARA | |
| 安全性ケース開始イベント | 試験薬曝露時に妊娠していた | ブーリアン |
|
case_version__v, pregnancy_at_vaccination__v | AE_PREG_INFO_AT_VX | |
| 安全性ケース開始イベント | 最終月経日 (妊娠ケース) | 日付 |
|
D.6 | case_version__v, last_menstrual_idate__v | AE_PREG_LAST_MENSTRUAL_DATE |
| 安全性ケース開始イベント | 受胎日 | 日付 |
|
case_version__v, pregnancy_conception_idate__v | AE_PREG_INFO_CONC_DT | |
| 安全性ケース開始イベント | 出産予定日 | 日付 |
|
case_version__v, pregnancy_due_idate__v | AE_PREG_INFO_DUE_DT | |
| 安全性ケース開始イベント | 妊娠結果の日付 | 日付 |
|
case_version__v, idate_of_pregnancy_outcome__v | AE_PREG_INFO_OUTCOME_DT | |
| 安全性ケース開始イベント | 妊娠結果 | マッピングされた値 |
|
case_version__v, pregnancy_outcome__v | AE_PREG_INFO_OUTCOME | |
| 安全性ケース開始イベント | 出産方法 | マッピングされた値 |
|
case_version__v, delivery_method__v | AE_PREG_INFO_DELV_METH |
治験薬
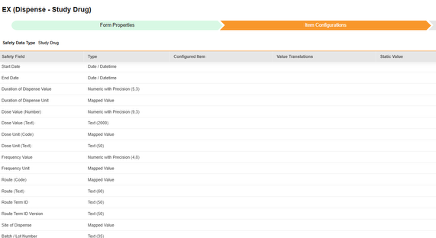
この安全性データ タイプは、臨床試験で被験者に対してテストされている治験薬の投与量 / 調剤情報を追跡するために使用されます。情報は、Veeva Safety の 製品 / 製品投与量 セクションに送信されます。以下の例では 2 つの薬剤を示しています。
現在、研究薬の名前 (G.k.2.2) は、スタジオの [フォーム プロパティ] タブで設定されています。薬剤名の項目構成は、将来のリリースで利用可能になります。
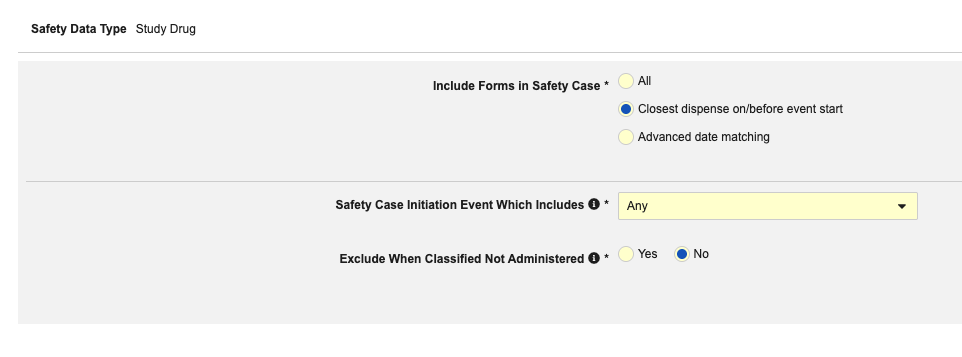
重要な「医薬品の分類」は、このタイプの EDC フォームにマッピングされている項目ではありません。代わりに、イベント開始日以前に少なくとも 1つの調剤フォームがある場合は、システムによって「Suspect」が設定されます。調剤がない場合、システムによって「未投与」が使用されます。
この安全性データ タイプに対して アイテム構成 ステップを実行するには:
- スタディの スタジオ >> フォーム設定 に進みます。
-
マップする行ごとに、 構成アイテム 列のセルを使用して、適切な アイテム定義 を選択します。たとえば、フォームから SD_START_DATE 項目を選択し、場所の 開始日 を指定します (下図)。選択項目は通常、 事前に保存されたフォームプロパティ > 各エントリ インに依存します (前の手順)。一部の安全性ロケーションには、繰り返しアイテム グループまたは非繰り返しアイテム グループのみで実行できる、あるいはその両方で実行できることを示す特別なルールがあります。それらの外れ値と、このタイプのすべての Safety 場所に関する重要な注意事項については、これらの手順の最後にある表を参照してください。
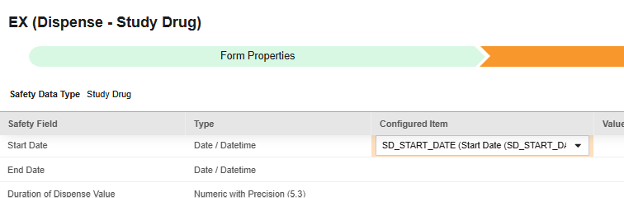
- 構成アイテム と 安全性フィールド のデータタイプに応じて、 値の翻訳 を指定する必要がある場合があります。手順については、上記の 値の翻訳 セクション を参照してください 。
- 安全性フィールド に応じて、追加情報が必要になる場合があります。行内の適切なセルを使用して、次の情報を入力します。
- 「保存」 (ページに留まる場合)または 「保存して次へ」 (次のタブ「 組入基準」に進む場合)をクリックします。
| EDC 安全性データタイプ | EDC フィールドラベル | フィールドデータタイプ | メモ | 関連するE2B(R3)の場所 | 受信ボックスアイテム/ ケースオブジェクト & フィールド |
EDC フィールド識別子 |
|---|---|---|---|---|---|---|
| 治験薬 | 開始日 | 日付 / 日時 |
|
G.k.4.r.4 | case_product_dosage__v, firstadmin_idate__v | SD_START_DATE |
| 治験薬 | 終了日 | 日付 / 日時 |
|
G.k.4.r.5 | case_product_dosage__v, lastadmin_idate__v | SD_END_DATE |
| 治験薬 | 投与期間の値 | 精度付き数値 (5,3) |
|
G.k.4.r.6a | case_product_dosage__v, duration_number__v | SD_DURATION_VALUE |
| 治験薬 | 投与期間の単位 | マッピングされた値 |
|
G.k.4.r.6b | case_product_dosage__v, duration_unit__v | SD_DURATION_UNIT |
| 治験薬 | 投与量 (数値) | 精度付き数値 (9,3) |
|
G.k.4.r.1a | case_product_dosage__v, dose_number__v | SD_DOSE_VALUE_NUMBER |
| 治験薬 | 投与量 (テキスト) | テキスト (2000) |
|
G.k.4.r.8 | case_product_dosage__v, dose_text_long_text__v | SD_DOSE_VALUE_TEXT |
| 治験薬 | 投与単位 (コード) | マッピングされた値 |
|
G.k.4.r.1b | case_product_dosage__v, dose_unit__v | SD_DOSE_UNIT_CODE |
| 治験薬 | 投与単位 (テキスト) | テキスト (50) |
|
G.k.4.r.8 | case_product_dosage__v, dose_unit_text__v | SD_DOSE_UNIT_TEXT |
| 治験薬 | 頻度の値 | 精度付き数値 (4,8) |
|
G.k.4.r.2 | case_product_dosage__v, frequency_number__v | SD_FREQUENCY_VALUE |
| 治験薬 | 頻度の単位 | マッピングされた値 |
|
G.k.4.r.3 | case_product_dosage__v, frequency_unit__v | SD_FREQUENCY_UNIT |
| 治験薬 | 経路 (コード) | マッピングされた値 |
|
G.k.4.r.10.2b | case_product_dosage__v, patient_adminroute__v | SD_ROUTE_CODE |
| 治験薬 | 経路 (テキスト) | テキスト (60) |
|
G.k.4.r.10.1 | case_product_dosage__v, patient_adminroute_text__v | SD_ROUTE_TEXT |
| 治験薬 | 経路用語 ID | テキスト (50) |
|
G.k.4.r.10.2b | case_product_dosage__v, patient_adminroute_termid__v | SD_ROUTE_TERM_ID |
| 治験薬 | 経路用語 ID バージョン | テキスト (50) |
|
G.k.4.r.10.2a | case_product_dosage__v, patient_adminroute_termid_version__v | SD_ROUTE_TERM_ID_VERSION |
| 治験薬 | 投与施設 | マッピングされた値 |
|
case_product_dosage__v, anatomical_site__v | SD_SITE_OF_DISPENSE | |
| 治験薬 | バッチ/ロット番号 | テキスト (35) |
|
G.k.4.r.7 | case_product_dosage__v, batchlot_number__v | SD_BATCH_LOT_NUMBER |
| 治験薬 | 剤形用語 ID | テキスト (50) |
|
G.k.4.r.9.2b | case_product_dosage__v, dose_form_termid__v | SD_DOSE_FORM_TERM_ID |
| 治験薬 | 剤形用語 ID バージョン | テキスト (50) |
|
G.k.4.r.9.2a | case_product_dosage__v, dose_form_termid_version__v | SD_DOSE_FORM_TERM_ID_VERSION |
| 治験薬 | 剤形テキスト | テキスト (128) |
|
G.k.4.r.9.1 | case_product_dosage__v, dose_form_text__v | SD_DOSE_FORM_TEXT |
| 治験薬 | 親経路 (テキスト) | テキスト (60) |
|
G.k.4.r.11.1 | case_product_dosage__v, parent_adminroute_text__v | SD_PARENT_ROUTE_TEXT |
| 治験薬 | 親経路 (コード) | マッピングされた値 |
|
G.k.4.r.11.2b | case_product_dosage__v, parent_adminroute__v | SD_PARENT_ROUTE_CODE |
| 治験薬 | 親経路用語 ID | テキスト (50) |
|
G.k.4.r.11.2b | case_product_dosage__v, parent_adminroute_termid__v | SD_PARENT_ROUTE_TERM_ID |
| 治験薬 | 親経路用語 ID バージョン | テキスト (50) |
|
G.k.4.r.11.2a | case_product_dosage__v, parent_adminroute_termid_version__v | SD_PARENT_ROUTE_TERM_ID_VERSION |
併用薬
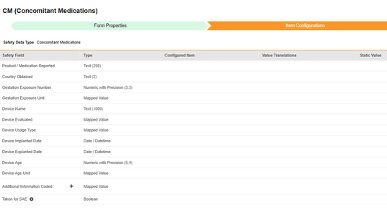
このタイプの安全性構成は、治験の併用薬形態に適用されます。情報は、Veeva Safety の 製品 / 製品投与量 セクションに送信されます。
この安全性データ タイプに対して アイテム構成 ステップを実行するには:
- スタディの スタジオ >> フォーム設定 に進みます。
-
マップする行ごとに、 構成アイテム 列のセルを使用して、適切な アイテム定義 を選択します。たとえば、場所 報告された製品/薬剤 のフォームから CMTRT 項目を選択します (下図参照)。選択項目は通常、 事前に保存されたフォームプロパティ > 各エントリ インに依存します (前の手順)。一部の安全性ロケーションには、繰り返しアイテム グループまたは非繰り返しアイテム グループのみで実行できる、あるいはその両方で実行できることを示す特別なルールがあります。それらの外れ値と、このタイプのすべての Safety 場所に関する重要な注意事項については、これらの手順の最後にある表を参照してください。
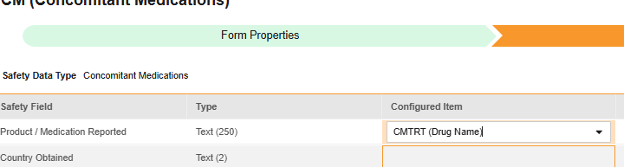
- 構成アイテム と 安全性フィールド のデータタイプに応じて、 値の翻訳 を指定する必要がある場合があります。手順については、上記の 値の翻訳 セクション を参照してください 。
- 「保存」 (ページに留まる場合)または 「保存して次へ」 (次のタブ「 組入基準」に進む場合)をクリックします。
| EDC 安全性データタイプ | EDC フィールドラベル | フィールドデータタイプ | メモ | 関連するE2B(R3)の場所 | 受信ボックスアイテム/ ケースオブジェクト & フィールド |
EDC フィールド識別子 |
|---|---|---|---|---|---|---|
| 併用薬 | 報告済みの製品 / 併用薬 | テキスト (250) |
|
G.k.2.2 | case_product__v, product_reported__v | CM_REPORTED |
| 併用薬 | 取得された国 | テキスト (2) |
|
G.k.2.4 | case_product__v, country_obtained__v | CM_COUNTRY_OBTAINED |
| 併用薬 | 妊娠中の曝露数 | 精度付き数値 (3,3) |
|
G.k.6a | case_product__v, gestation_exposure_number__v | CM_GESTATION |
| 併用薬 | 妊娠中の曝露単位 | マッピングされた値 |
|
G.k.6b | case_product__v, gestation_exposure_unit__v | CM_GESTATION_UNIT |
| 併用薬 | 機器名 | テキスト (1000) |
|
case_product__v, device_name_part__v | CM_DEVICE_NAME | |
| 併用薬 | デバイス評価済み | マッピングされた値 |
|
case_product__v, device_evaluated__v | CM_DEVICE_EVALUATED | |
| 併用薬 | デバイスの使用タイプ | マッピングされた値 |
|
case_product__v, device_usage_type__v | CM_DEVICE_USAGE_TYPE | |
| 併用薬 | デバイスのインプラント日 | 日付 / 日時 |
|
case_product__v, date_implanted_idate__v | CM_IMPLANTED_DATE | |
| 併用薬 | デバイスのエクスプラント日 | 日付 / 日時 |
|
case_product__v, date_explanted_idate__v | CM_DEVICE_EXPLANTED_DATE | |
| 併用薬 | デバイスの経過年数 | 精度付き数値 (5,4) |
|
case_product__v, date_age__v | CM_DEVICE_AGE | |
| 併用薬 | デバイスの経過年数単位 | マッピングされた値 |
|
case_product__v, device_age_unit__v | CM_DEVICE_AGE_UNIT | |
| 併用薬 | コーディング済み追加情報 | マッピングされた値 |
|
G.k.10.r | case_product__v, additional_information_coded__v | CM_ADDITIONAL_INFO_CODED |
| 併用薬 | 開始日 | 日付 / 日時 |
|
G.k.4.r.4 | case_product_dosage__v, firstadmin_idate__v | CM_START_DATE |
| 併用薬 | 終了日 | 日付 / 日時 |
|
G.k.4.r.5 | case_product_dosage__v, lastadmin_idate__v | CM_END_DATE |
| 併用薬 | 投与期間の値 | 精度付き数値 (5,3) |
|
G.k.4.r.6a | case_product_dosage__v, duration_number__v | CM_DURATION_VALUE |
| 併用薬 | 投与期間の単位 | マッピングされた値 |
|
G.k.4.r.6b | case_product_dosage__v, duration_unit__v | CM_DURATION_UNIT |
| 併用薬 | 投与量 (数値) | 精度付き数値 (9,3) |
|
G.k.4.r.1a | case_product_dosage__v, dose_number__v | CM_DOSE_VALUE_NUMBER |
| 併用薬 | 投与量 (テキスト) | テキスト (2000) |
|
G.k.4.r.8 | case_product_dosage__v, dose_text__v | CM_DOSE_VALUE_TEXT |
| 併用薬 | 投与単位 (コード) | マッピングされた値 |
|
G.k.4.r.1b | case_product_dosage__v, dose_unit__v | CM_DOSE_UNIT_CODE |
| 併用薬 | 投与単位 (テキスト) | テキスト (50) |
|
G.k.4.r.8 | case_product_dosage__v, dose_unit_text__v | CM_DOSE_UNIT_TEXT |
| 併用薬 | 頻度の値 | 精度付き数値 (4,8) |
|
G.k.4.r.2 | case_product_dosage__v, frequency_number__v | CM_FREQUENCY_VALUE |
| 併用薬 | 頻度の単位 | マッピングされた値 |
|
G.k.4.r.3 | case_product_dosage__v, frequency_unit__v | CM_FREQUENCY_UNIT |
| 併用薬 | 経路 (コード) | マッピングされた値 |
|
G.k.4.r.10.2b | case_product_dosage__v, patient_adminroute__v | CM_ROUTE_CODE |
| 併用薬 | 経路 (テキスト) | テキスト (60) |
|
G.k.4.r.10.1 | case_product_dosage__v, patient_adminroute_text__v | CM_ROUTE_TEXT |
| 併用薬 | 経路用語 ID | テキスト (50) |
|
G.k.4.r.10.2b | case_product_dosage__v, patient_adminroute_termid__v | CM_ROUTE_TERM_ID |
| 併用薬 | 経路用語 ID バージョン | テキスト (50) |
|
G.k.4.r.10.2a | case_product_dosage__v, patient_adminroute_termid_version__v | CM_ROUTE_TERM_ID_VERSION |
| 併用薬 | 投与施設 | マッピングされた値 |
|
case_product_dosage__v, anatomical_site__v | CM_SITE_OF_DISPENSE | |
| 併用薬 | バッチ/ロット番号 | テキスト (35) |
|
G.k.4.r.7 | case_product_dosage__v, batchlot_number__v | CM_BATCH_LOT_NUMBER |
| 併用薬 | 剤形用語 ID | テキスト (50) |
|
G.k.4.r.9.2a | case_product_dosage__v, dose_form_termid__v | CM_DOSE_FORM_TERM_ID |
| 併用薬 | 剤形用語 ID バージョン | テキスト (50) |
|
G.k.4.r.9.1 | case_product_dosage__v, dose_form_termid_version__v | CM_DOSE_FORM_TERM_ID_VERSION |
| 併用薬 | 剤形 (テキスト) | テキスト (50) |
|
G.k.4.r.9.2b | case_product_dosage__v, dose_form_text__v | CM_DOSE_FORM_TEXT |
| 併用薬 | 親経路 (テキスト) | テキスト (60) |
|
G.k.4.r.11.1 | case_product_dosage__v, parent_adminroute_text__v | CM_PARENT_ROUTE_TEXT |
| 併用薬 | 親経路 (コード) | マッピングされた値 |
|
G.k.4.r.11.2b | case_product_dosage__v, parent_adminroute__v | CM_PARENT_ROUTE_CODE |
| 併用薬 | 親経路用語 ID | テキスト (50) |
|
G.k.4.r.11.2b | case_product_dosage__v, parent_adminroute_termid__v | CM_PARENT_ROUTE_TERM_ID |
| 併用薬 | 親経路用語 ID バージョン | テキスト (50) |
|
G.k.4.r.11.2a | case_product_dosage__v, parent_adminroute_termid_version__v | CM_PARENT_ROUTE_TERM_ID_VERSION |
病歴
このタイプの安全性構成は、研究の併用薬形態に適用されます。情報は、Veeva Safety の 病歴 & 併発疾患 セクションに送信されます。
この安全性データ タイプに対して アイテム構成 ステップを実行するには:
- スタディの スタジオ >> フォーム設定 に進みます。
-
マップする行ごとに、 構成アイテム 列のセルを使用して、適切な アイテム定義 を選択します。たとえば、場所 報告された病歴 のフォームから MHTERM 項目を選択します (下図参照)。選択項目は通常、 事前に保存されたフォームプロパティ > 各エントリ インに依存します (前の手順)。一部の安全性ロケーションには、繰り返しアイテム グループまたは非繰り返しアイテム グループのみで実行できる、あるいはその両方で実行できることを示す特別なルールがあります。それらの外れ値と、このタイプのすべての Safety 場所に関する重要な注意事項については、これらの手順の最後にある表を参照してください。
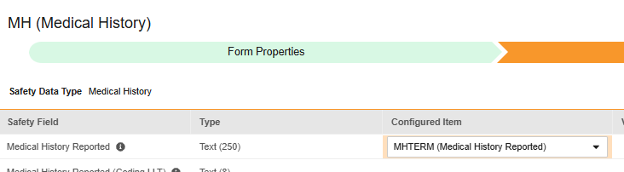
- 構成アイテム と 安全性フィールド のデータタイプに応じて、 値の翻訳 を指定する必要がある場合があります。手順については、上記の 値の翻訳 セクション を参照してください 。
- 「保存」 (ページに留まる場合)または 「保存して次へ」 (次のタブ「 組入基準」に進む場合)をクリックします。
| EDC 安全性データタイプ | EDC フィールドラベル | フィールドデータタイプ | メモ | 関連するE2B(R3)の場所 | 受信ボックスアイテム/ ケースオブジェクト & フィールド |
EDC フィールド識別子 |
|---|---|---|---|---|---|---|
| 病歴 | 治療歴報告済み | テキスト (250) |
|
D.7.1.r.5(コメントからよく報告される用語) | case_medical_history__v, name_reported__v | MH_REPORTED |
| 病歴 | 治療歴報告済み (コーディング LLT) | テキスト (8) |
|
D.7.1.r.1a/D.7.1.r.1b | case_medical_history__v, name_meddra__v | MH_REPORTED_LLT |
| 病歴 | 開始日 | 日付 / 日時 |
|
D.7.1.r.2 | case_medical_history__v, startdate_idate__v | MH_START_DATE |
| 病歴 | 継続 | ブーリアン |
|
D.7.1.r.3 | case_medical_history__v, continuing_value__v | MH_CONTINUING |
| 病歴 | 終了日 | 日付 / 日時 |
|
D.7.1.r.4 | case_medical_history__v, enddate_idate__v | MH_END_DATE |
| 病歴 | コメント | テキスト (2000) |
|
D.7.1.r.5 | case_medical_history__v, comments__v | MH_COMMENTS |
| 病歴 | 家族歴 | ブーリアン |
|
D.7.1.r.6 | case_medical_history__v, family_history__v | MH_FAMILY_HISTORY |
| 病歴 | ワクチン接種時の疾患 | ブーリアン |
|
case_medical_history__v, illness_at_vaccination__v | MH_ILLNESS_AT_VACCINATION |
薬歴
このタイプの安全性構成は、治験の薬歴フォームに適用されます。情報は、Veeva Safety の 薬歴 セクションに送信されます。
この安全性データ タイプに対して アイテム構成 ステップを実行するには:
- スタディの スタジオ >> フォーム設定 に進みます。
-
マップする行ごとに、 構成アイテム 列のセルを使用して、適切な アイテム定義 を選択します。たとえば、場所 報告された薬歴 のフォームから DH_REPORTED 項目を選択します (下図参照)。選択項目は通常、 事前に保存されたフォームプロパティ > 各エントリ インに依存します (前の手順)。一部の安全性ロケーションには、繰り返しアイテム グループまたは非繰り返しアイテム グループのみで実行できる、あるいはその両方で実行できることを示す特別なルールがあります。それらの外れ値と、このタイプのすべての Safety 場所に関する重要な注意事項については、これらの手順の最後にある表を参照してください。
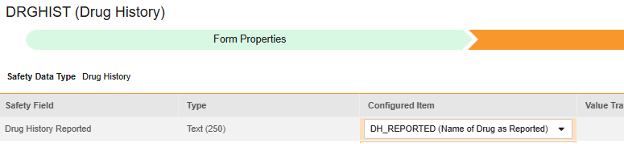
- 構成アイテム と 安全性フィールド のデータタイプに応じて、 値の翻訳 を指定する必要がある場合があります。手順については、上記の 値の翻訳 セクション を参照してください 。
- 「保存」 (ページに留まる場合)または 「保存して次へ」 (次のタブ「 組入基準」に進む場合)をクリックします。
| EDC 安全性データタイプ | EDC フィールドラベル | フィールドデータタイプ | メモ | 関連するE2B(R3)の場所 | 受信ボックスアイテム/ ケースオブジェクト & フィールド |
EDC フィールド識別子 |
|---|---|---|---|---|---|---|
| 薬歴 | 薬歴報告済み | テキスト (250) |
|
D.8.r.1 | case_drug_history__v, name_reported__v | DH_REPORTED |
| 薬歴 | 開始日 | 日付 / 日時 |
|
D.8.r.4 | case_drug_history__v, startdate_idate__v | DH_START_DATE |
| 薬歴 | 終了日 | 日付 / 日時 |
|
D.8.r.5 | case_drug_history__v, enddate_idate__v | DH_END_DATE |
| 薬歴 | ワクチン接種時の年齢 / 使用 | 数値 (3) |
|
case_drug_history__v, age_at_vaccination_number__v | DH_AGE_AT_USE | |
| 薬歴 | ワクチン接種時の年齢 / 使用単位 | マッピングされた値 |
|
case_drug_history__v, age_at_vaccination_unit__v | DH_AGE_AT_USE_UNIT | |
| 薬歴 | 製品タイプ | マッピングされた値 |
|
case_drug_history__v, product_type__v | DH_PRODUCT_TYPE | |
| 薬歴 | 適応症報告済み | テキスト (250) |
|
D.8.r.6a, D.8.r.6b | case_drug_history__v, indication_reported__v | DH_INDICATION |
| 薬歴 | 反応報告済み | テキスト (250) |
|
D.8.r.7a, D.8.r.7b | case_drug_history__v, reaction_reported__v | DH_REACTION |
検査結果
このタイプの安全性構成は、治験のラボ / 検査結果フォームに適用されます。情報は Veeva Safety の '検査結果 セクションに送信されます。
この安全性データ タイプに対して アイテム構成 ステップを実行するには:
- スタディの スタジオ >> フォーム設定 に進みます。
-
マップする行ごとに、 構成アイテム 列のセルを使用して、適切な アイテム定義 を選択します。たとえば、フォームから LBDT 項目を選択し、場所の 検査日 を指定します (下図)。選択項目は通常、 事前に保存されたフォームプロパティ > 各エントリ インに依存します (前の手順)。一部の安全性ロケーションには、繰り返しアイテム グループまたは非繰り返しアイテム グループのみで実行できる、あるいはその両方で実行できることを示す特別なルールがあります。それらの外れ値と、このタイプのすべての Safety 場所に関する重要な注意事項については、これらの手順の最後にある表を参照してください。
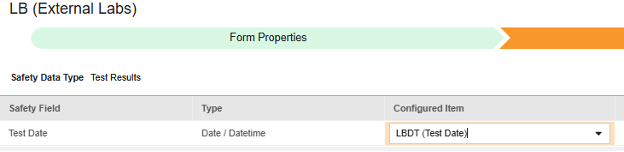
- 構成アイテム と 安全性フィールド のデータタイプに応じて、 値の翻訳 を指定する必要がある場合があります。手順については、上記の 値の翻訳 セクション を参照してください 。
- 「保存」 (ページに留まる場合)または 「保存して次へ」 (次のタブ「 組入基準」に進む場合)をクリックします。
| EDC 安全性データタイプ | EDC フィールドラベル | フィールドデータタイプ | メモ | 関連するE2B(R3)の場所 | 受信ボックスアイテム/ ケースオブジェクト & フィールド |
EDC フィールド識別子 |
|---|---|---|---|---|---|---|
| 検査結果 | 検査日 | 日付 / 日時 |
|
F.r.1 | case_test_result__v, date_idate__v | LAB_DATE |
| 検査結果 | テストの名前 | テキスト (250) |
|
F.r.2.1 | case_test_result__v, name_reported__v | LAB_TEST_NAME |
| 検査結果 | 検査名 (コーディング LLT) | テキスト (8) |
|
F.r.2.2a, F.r.2.2b | case_test_result__v, name_meddra__v | LAB_TEST_NAME_MEDDRA |
| 検査結果 | 検査結果 (数値) | 精度付き数値 (14,3) |
|
F.r.3.2 | case_test_result__v, result_value__v | LAB_RESULT_NUMERIC |
| 検査結果 | 検査単位 | マッピングされた値 |
|
F.r.3.3 | case_test_result__v, result_unit__v | LAB_RESULT_UNIT |
| 検査結果 | 検査結果 (コード) | マッピングされた値 |
|
F.r.3.1 | case_test_result__v, result_code__v | LAB_TEST_RESULT_CODE |
| 検査結果 | 検査結果 (テキスト) | テキスト (2000) |
|
F.r.3.4 | case_test_result__v, restult_text__v | LAB_RESULT_TEXT |
| 検査結果 | 検査結果 (検査者) | マッピングされた値 |
|
F.r.3.2 | case_test_result__v, result_qualifier__v | LAB_RESULT_QUALIFIER |
| 検査結果 | 検査正常範囲低値 | テキスト (50) |
|
F.r.4 | case_test_result__v, normal_low_value__v | LAB_LOW_VALUE |
| 検査結果 | 検査正常範囲高値 | テキスト (50) |
|
F.r.5 | case_test_result__v, normal_high_value__v | LAB_HIGH_VALUE |
| 検査結果 | 検査コメント | テキスト (2000) |
|
F.r.6 | case_test_result__v, comments__v | LAB_COMMENTS |
| 検査結果 | さらに情報が利用可能 | ブーリアン |
|
F.r.7 | case_test_result__v, more_information_available__v | LAB_MORE_INFO_AVAILABLE |
患者特性
このタイプの安全性構成は、対象に関する一般的な情報に適用されます。情報は、Veeva Safety の 患者 セクションに送信されます。
この安全性データ タイプに対して アイテム構成 ステップを実行するには:
- スタディの スタジオ >> フォーム設定 に進みます。
-
マップする行ごとに、 構成アイテム 列のセルを使用して、適切な アイテム定義 を選択します。たとえば、フォームから DOB 項目を選択し、場所の 誕生日 を指定します (下図)。選択項目は通常、 事前に保存されたフォームプロパティ > 各エントリ インに依存します (前の手順)。一部の安全性ロケーションには、繰り返しアイテム グループまたは非繰り返しアイテム グループのみで実行できる、あるいはその両方で実行できることを示す特別なルールがあります。それらの外れ値と、このタイプのすべての Safety 場所に関する重要な注意事項については、これらの手順の最後にある表を参照してください。
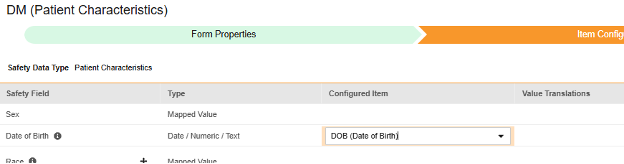
- 構成アイテム と 安全性フィールド のデータタイプに応じて、 値の翻訳 を指定する必要がある場合があります。手順については、上記の 値の翻訳 セクション を参照してください 。
- 「保存」 (ページに留まる場合)または 「保存して次へ」 (次のタブ「 組入基準」に進む場合)をクリックします。
| EDC 安全性データタイプ | EDC フィールドラベル | フィールドデータタイプ | メモ | 関連するE2B(R3)の場所 | 受信ボックスアイテム/ ケースオブジェクト & フィールド |
EDC フィールド識別子 |
|---|---|---|---|---|---|---|
| 患者特性 | 性別 | マッピングされた値 |
|
D.5 | case_version__v, gender_value__v | |
| 患者特性 | 生年月日 | 日付 / 数値 / テキスト |
|
D.2.1 | case_version__v, dob_idate__v | PC_DOB |
| 患者特性 | 人種 | マッピングされた値 |
|
case_version__v, race__v | PC_RACE | |
| 患者特性 | 民族 | マッピングされた値 |
|
case_version__v, ethnicity__v | PC_ETHNICITY | |
| 患者特性 | 年齢群 | マッピングされた値 |
|
D.2.3 | case_version__v, age_group__v | PC_AGE_GROUP |
| 患者特性 | SAE 発現時の年齢 | 数値 (3) |
|
D.2.2a | case_version__v, age_value__v | PC_AGE_VALUE |
| 患者特性 | SAE 発現時の年齢単位 | マッピングされた値 |
|
D.2.2b | case_version__v, age_unit__v | PC_AGE_UNIT |
| 患者特性 | ワクチン接種時の年齢 | 数値 (3) |
|
case_version__v, age_at_vaccination_number__v | PC_AGE_AT_VX | |
| 患者特性 | ワクチン接種時の年齢単位 | マッピングされた値 |
|
case_version__v, age_at_vaccination_unit__v | PC_AGE_AT_VX_UNIT | |
| 患者特性 | 妊娠値 | 数値 (3) |
|
D.2.2.1a | case_version__v, gestation_value__v | PC_GESTATION |
| 患者特性 | 妊娠単位 | マッピングされた値 |
|
D.2.2.1b | case_version__v, gestation_unit__v | PC_GESTATION_UNIT |
| 患者特性 | 体重 (kg) | 精度付き数値 (4,4) |
|
D.3 | case_version__v, weight_normalized__kg__v | PC_WEIGHT_KG |
| 患者特性 | 身長 (cm) | 精度付き数値 (4,3) |
|
D.4 | case_version__v, height_normalized__cm__v | PC_HEIGHT_CM |
| 患者特性 | 患者名またはイニシャル | テキスト (60) |
|
D.1 | case_version__v, patient_id_value__v | PC_NAME_OR_INITIALS |
| 患者特性 | GP メディカルレコード番号 | テキスト (20) |
|
D.1.1.1 | case_version__v, mrn_gp_value__v | PC_GPRN |
| 患者特性 | 病院レコード番号 | テキスト (20) |
|
D.1.1.3 | case_version__v, mrn_hospital_value__v | PC_HRN |
| 患者特性 | 試験レコード番号 | テキスト (20) |
|
D.1.1.4 | case_version__v, mrn_investigation_value__v | PC_IRN |
| 患者特性 | スペシャリストレコード番号 | テキスト (20) |
|
D.1.1.2 | case_version__v, mrn_specialist__value | PC_SRN |
| 患者特性 | ランダムな数字 | テキスト (20) |
|
case_version__v, patient_randomization_number__v | PC_RAND_NUM | |
| 患者特性 | 最終月経日 | 日付 |
|
D.6 | case_version__v, last_menstrual_date | PC_LAST_MENSTRUAL_DATE |
| 患者特性 | 妊娠の発生 | 数値 (2) |
|
case_version__v, gravida_gravidity__v | ||
| 患者特性 | 出生数 | 数値 (2) |
|
case_version__v, para_parity__v | AE_PREG_INFO_PARA | |
| 患者特性 | SAE 発現時の妊娠 | ブーリアン |
|
case_version__v, pregnancy_case__v | PC_PREG_CASE | |
| 患者特性 | ワクチン接種時の妊娠 | ブーリアン |
|
case_version__v, pregnant_at_vaccination__v | PC_PREG_AT_VX | |
| 患者特性 | 受胎日 | 日付 |
|
case_version__v, pregnancy_conception_date__v | A_PREG_INFO_CON_DT | |
| 患者特性 | 出産予定日 | 日付 |
|
case_version__v, pregnancy_due_date__v | AE_PREG_INFO_DUE_DT | |
| 患者特性 | 妊娠結果 | マッピングされた値 |
|
case_version__v, pregnancy_outcome__v | AE_PREG_INFO_OUTCOME | |
| 患者特性 | 出産方法 | マッピングされた値 |
|
case_version__v, delivery_method__v | AE_PREG_INFO_DELV_METH | |
| 患者特性 | 妊娠結果の日付 | 日付 |
|
case_version__v, date_of_pregnancy_outcome__v | AE_PREG_INFO_OUTCOME_DT | |
| 患者特性 | 親被験者番号 | テキスト (128) |
|
case_version__v, parent_subject_number__v | PC_PARENT_SUBNUM | |
| 患者特性 | 一般的な病歴 | テキスト (10000) |
|
D.7.2 | case_version__v, medical_history_text__v | PC_MH_TEXT |
| 患者特性 | 被験者が受けた併用療法 | ブーリアン |
|
, | PC_CON_THERAPY |
死亡例
このタイプの安全性構成は、対象者の死亡に関する詳細情報を含むフォームに適用されます。このタイプの一部のフィールドは繰り返し不可(例: 死亡日)ですが、その他のフィールドは繰り返しまたは非繰り返し(死因)にすることができます。情報は、Veeva Safety の 2 つの場所、 患者 または 死亡原因に流れます。
この安全性データ タイプに対して アイテム構成 ステップを実行するには:
- スタディの スタジオ >> フォーム設定 に進みます。
-
マップする行ごとに、 構成アイテム 列のセルを使用して、適切な アイテム定義 を選択します。たとえば、フォームから DTHDT 項目を選択し、場所の 死亡日 を指定します (下図)。選択項目は通常、 事前に保存されたフォームプロパティ > 各エントリ インに依存します (前の手順)。一部の安全性ロケーションには、繰り返しアイテム グループまたは非繰り返しアイテム グループのみで実行できる、あるいはその両方で実行できることを示す特別なルールがあります。それらの外れ値と、このタイプのすべての Safety 場所に関する重要な注意事項については、これらの手順の最後にある表を参照してください。
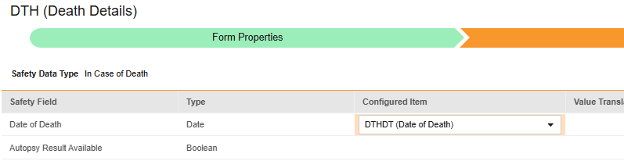
- 構成アイテム と 安全性フィールド のデータタイプに応じて、 値の翻訳 を指定する必要がある場合があります。手順については、上記の 値の翻訳 セクション を参照してください 。
- 完了したら、 [保存] をクリックするか、 [保存して次へ] をクリックして、組入基準の手順に進みます。
| EDC 安全性データタイプ | EDC フィールドラベル | フィールドデータタイプ | メモ | 関連するE2B(R3)の場所 | 受信ボックスアイテム/ ケースオブジェクト & フィールド |
EDC フィールド識別子 |
|---|---|---|---|---|---|---|
| 死亡例 | 死亡日 | 日付 |
|
D.9.1 | case_version__v, dod_idate__v | ICD_DEATH_DT |
| 死亡例 | 検死結果あり | ブーリアン |
|
D.9.3 | case_version__v, autopsy_value__v | ICD_AUTOPSY_RES |
| 死亡例 | 検死結果省略理由 | マッピングされた値 |
|
case_version__v, autopsy_reason_omitted__v | ICD_AUTOPSY_REAS_OMIT | |
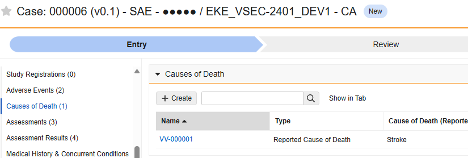
| 死亡例 | 死因 - タイプ | マッピングされた値 |
|
D.9.2.r, D.9.4.r | case_cause_of_death__v, type__v | ICD_CASE_TYPE |
| 死亡例 | 死因 - 報告済み | テキスト (250) |
|
D.9.2.r, D.9.4.r | case_cause_of_death__v, name_reported__v | ICD_CAUSE_REPORTED |
| 死亡例 | 死因 - 報告済み (コーディング LLT) | テキスト (8) |
|
D.9.2.r, D.9.4.r | case_cause_of_death__v, name_meddra__v | ICD_CAUSE_LLT |
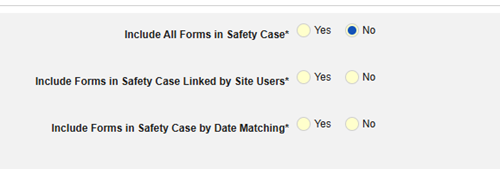
組入基準
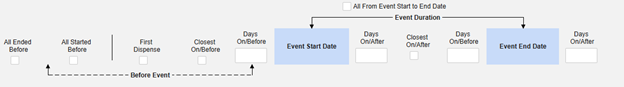
組入基準 は、安全性ケースのデータ転送を開始する主要なイベントを超えて、マップされた項目の値を安全性ケースに含めるかどうかを決定するために評価されます。
メモ/概念:
- 組入基準は、以下の場合にのみ評価されます。
- フォームのプロパティ タブでは、すべての組入基準が真と評価され、特に Key Safety Item
- (および)
- [アイテム構成] タブで、必須アイテムに 空でない値 がEDCフォームに入力されている場合
- フォームのプロパティ タブでは、すべての組入基準が真と評価され、特に Key Safety Item
- 追加の基準には、特定のタイプのすべてのフォームを含めることも、施設ユーザのアクション (リンク) や日付の比較に基づくこともできます。これらの構成は、タイプ、特定のフォーム、および/または試験によって異なる場合があります。
- 組入基準 タブの条件は、評価時に「OR」とみなされます。つまり、一連の適用可能な基準のいずれかが真の場合、偽(「Out」)と評価されても、評価は「In」となります。
- ケースに含めるための安全ケース開始イベントとの比較 終了日 が構成されているが、日付がデータ入力画面で 設定されていない 場合、イベントの終了日は 未設定として評価に使用されます。主要イベント (または関連フォーム) に終了日を入力すると、システムは組入基準を再評価し、必要に応じて修正フォローアップを送信します。
- 組入基準は、以下の関連するすべての安全性タイプに適用されます。
- 安全性ケース開始イベント
- 治験薬
- 併用薬
- 病歴
- 薬歴
- 検査結果
データタイプ別オプション概要
| 組入基準 | 安全性データタイプ | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 脊髄損傷 | 治験薬 | 併用薬 | 病歴 | 薬歴 | 検査結果 | 患者特性 | 死亡例 | ||
| すべて | |||||||||
| 施設ユーザによりリンクされている | |||||||||
| 開始から終了までが安全性イベントの開始から終了までと重複しています | |||||||||
| 開始から終了までが安全性イベント開始前の X 日前と重複しています | |||||||||
| 開始から終了までが安全性イベント開始前の X 日後と重複しています | |||||||||
| 開始から終了までが安全性イベント終了前の X 日前と重複しています | |||||||||
| 開始から終了までが安全性イベント終了前の X 日後と重複しています | |||||||||
| 最初の調剤 | |||||||||
| 安全性イベント開始の直近/前に最も近い | |||||||||
| 安全性イベント開始の直近/後に最も近い | |||||||||
| 安全性イベント開始の直近/前 (一つのみ) | |||||||||
| 安全性イベント開始前に医薬品調剤開始 | |||||||||
| 安全性イベント開始前に終了しました | |||||||||
| 常時 | * | * | |||||||
|
この組入基準がセーフティデータタイプで利用可能であることを示します。 * この組入基準がセーフティデータタイプで利用不可であることを示します。 |
|||||||||
表のヘッダーには、以下の安全性データタイプが省略されています。
- SCIE: 安全性ケース開始イベント
- ConMeds: 併用薬
- Med Hist: 病歴
- Drug Hist: 薬歴
- Test Res: 検査結果
- Pat Chars: 患者特性
オプションの意味 / 例
すべての基準オプションは以下にまとめられています。日付ベースの各オプションには、その使用方法を説明するための一連の例が含まれています。
安全性データタイプによる
安全性ケース開始イベント
安全ケース開始イベント は、安全ケースの転送プロセスを開始する主要なイベントになります。その後、他のすべての関連イベントは、設定された基準に従ってケースに組み込まれます。好みやスタディデザインに応じて、開始イベントには開始フォームからの他のデータを含めることができ、または同じタイプの他のイベント/フォームに関連付けることができますが、それ自体は独自の安全性ケースを構成しません (例: 開始の重大なイベントに関連付けられた他の重篤でないイベント)。
一般的な実例:
- 月曜日に、被験者は重篤ではない有害事象「頭痛」(AEフォーム#1)を経験した。
- 水曜日に、被験者は重篤ではない有害事象「頭痛」(AEフォーム#2)を経験した。
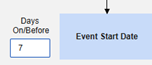
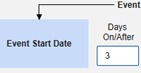
- システムは、火曜日のイベント (「めまい」) の安全性ケースを、新しい安全性ケースの主な開始イベントとして送信します。システムは、設定された包含基準に基づいて、月曜日のイベントのデータを同じ安全性ケースの 2 番目のイベントとして追加します。これは、 Days On/Before = 2 (またはそれ以上)の使用により発生します。
この安全タイプの組入基準を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
- 関連イベントのフォームを安全性ケースに含めます:
- 施設ユーザによってリンクされた関連フォームを含める: 施設によって主要な発端イベントにリンクされたイベントを症例に含める場合は、 [はい] を選択します。警告: はい を選択した場合、フォームには フォーム間 または アイテムからフォーム のリンクも設定されている必要があります。
-
関連イベント フォームを日付の一致で含める: 1 つ以上の日付ベースの基準に基づいて関連イベントのデータを含めるために評価する場合は、 はい を選択します。
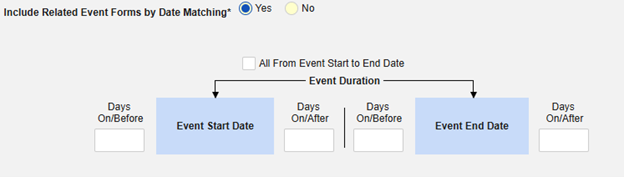
- オプションをチェックするか、特定の 日数 値を設定します。これらのオプションのうち 1 つ以上を選択 / 設定する必要があります。
- 終了するには、 [保存して閉じる] をクリックします。
各包含基準オプションの詳細と例については、上記の「オプションの意味 & 例」 を参照してください。
治験薬
このタイプの安全性構成は、臨床試験で被験者に対してテストされている開始イベントに関連して、研究薬の投与/調剤情報を追跡するために使用されます。情報は、安全性ケースの 製品/医薬品 セクションに送られます。
実例:
- 3月1日、被験者は 最初の調剤 を受け、実薬対プラセボ (盲検試験薬)
- 3月3日に被験者は 別の投与を受ける
- 3月5日に被験者は 別の投与を受ける
- 3月6日、被験者は重篤な有害事象(「めまい」)を経験し、サイトがAEフォームに入力します。
- システムは「めまい」を主要イベントとして安全ケースを作成し転送します。
- この試験は、安全性ケースに投与のサブセットを含めるように構成されています。設定例の 1 つは、 3 月 1 日 (全体で 1 番目) と 3 月 5 日 (直前の最も近い) です。設定された基準により、その他の調剤は含まれません。
この安全タイプの組入基準を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
- 安全性ケース内のフォームを含める:
- 薬剤が投与されない場合( 薬剤の役割 が「薬剤未投与」に設定されている)に 安全性ケース から治験薬剤情報を除外するには、 「投与されないと分類された場合は除外」 を はいに設定したままにします。それ以外は 「いいえ」 を選択します
- 終了するには、 [保存して閉じる] をクリックします。
各包含基準オプションの詳細と例については、上記の「オプションの意味 & 例」 を参照してください。
併用薬
このタイプの安全性構成は、治験の併用薬形態に適用されます。情報は、安全性ケースの 製品/医薬品 セクションに送られます。
このタイプでは複数のフォームを使用できます。
実例:
- 3月1日に被験者はVeeofenを1日1回服用し始めるが、3月3日に服用を中止します
- 3月3日に被験者はNatevbaを開始し、1日1回服用し、終了日は設定されていません (まだ服用中)
- 3月5日に被験者はディートーザを1回服用します (終了日も3月5日)
- 3月7日、被験者は重篤な有害事象(「めまい」)を経験し、サイトがAEフォームに入力します。
- システムは「めまい」を主要イベントとして安全ケースを作成し転送します。
- スタディデザインでは、次の 2 つのルールを使用して併用薬を組み込むように規定されています。
- 「SAE スタート時に進行中のものすべて」
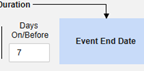
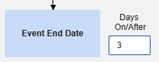
- 「何かが停止しましたが、SAE 開始から 3 日以内に停止しました」
- 結果: 3 月 3 日の Natevba (進行中) と 3 月 5 日の Deetoza (終了しましたが、わずか 2 日前) は両方とも ケースに含まれています。もう1つは、 3月1日アスピリン ではありません(3日以上前に終了しました)。
この安全タイプの組入基準を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
- 以下のオプションから選択してください。
- すべてのフォームを安全性ケースに含める (デフォルト: いいえ): はいを選択すると、現在併用しているすべての薬がケースに含まれ、他のすべてのオプションが無効になります。
- 施設ユーザによってリンクされた関連フォームを含める: 施設によって主要な発端イベントにリンクされた併用薬を症例に含める場合は、 [はい] を選択します。警告: はいを選択した場合、フォームには フォーム間 または アイテムからフォーム のリンク も 設定されている必要があります。
- 施設ユーザーがリンクしたフォームを安全性ケースに含める: はい または いいえ を 警告に対して選択します。 はいを選択した場合、フォームには フォーム間リンクまたは アイテムとフォームのリンク も設定されている必要があります。
-
「日付の一致によりセーフティにフォームを含める」 で 「はい」 または 「いいえ」を選択します。はい の場合、システムは 1 つ以上の基準を使用して、安全ケース イベント (プライマリ) の 開始から 終了までの範囲と関連データ (アクティブに構成されているフォーム、その開始範囲と終了範囲) を比較することを意味します:
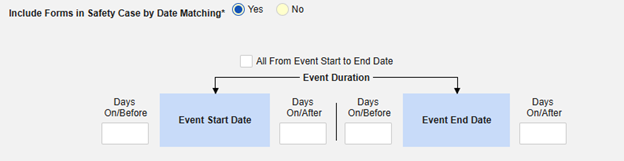
- オプションをチェックするか、特定の 日数 値を設定します。これらのオプションのうち 1 つ以上を選択 / 設定する必要があります。
- 終了するには、 [保存して閉じる] をクリックします。
各包含基準オプションの詳細と例については、上記の「オプションの意味 & 例」 を参照してください。
病歴
このタイプの安全性構成は、研究の併用薬形態に適用されます。
実例:
- 2024年1月、被験者は初めて「軽度のめまい」を経験し始めました。病歴は継続中とみなされます (終了日なし)
- 2番目の病歴には「腰痛」とあり、2024年4月に始まり、2024年5月に終わります
- 3番目の病歴には「片頭痛」とあり、2024年6月に始まり、2024年11月に終わります
- 2025年3月7日、被験者に重篤な有害事象(「めまい」)が発生し、施設はAEフォームの作成を開始しました
- システムは「めまい」を主要イベントとして安全ケースを作成し転送します。
- スタディデザインでは、次の 2 つのルールを使用して薬歴を組み込むように規定されています。
- 「SAE スタート時に進行中のものすべて」
- 「何かが停止しましたが、SAE 開始から 182 日以内に停止しました」
- 結果:「軽度のめまい」(継続中)と「偏頭痛」(終了したが、1年以内)の両方がケースに含まれています。もう 1つは、「腰痛」です。これは該当しません (180 日以上前に終了しました)。
この安全タイプの組入基準を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
- 以下のオプションから選択してください。
- すべてのフォームを安全性ケースに含める (デフォルト: いいえ): はいを選択すると、現在併用しているすべての薬がケースに含まれ、他のすべてのオプションが無効になります。
- 施設ユーザによってリンクされた関連フォームを含める: 施設によって主要な発端イベントにリンクされた併用薬を症例に含める場合は、 [はい] を選択します。警告: はいを選択した場合、フォームには フォーム間 または アイテムからフォーム のリンク も 設定されている必要があります。
- 施設ユーザがリンクしたフォームを安全性ケースに含める: はい または いいえ を 警告に対して選択します。はい を選択した場合、フォームには フォーム間リンクまたは アイテムとフォームのリンク も設定されている必要があります。
-
「日付の一致によりセーフティにフォームを含める」 で 「はい」 または 「いいえ」を選択します。はい の場合、システムは 1 つ以上の基準を使用して、安全ケース イベント (プライマリ) の 開始から 終了までの範囲と関連データ (アクティブに構成されているフォーム、その開始範囲と終了範囲) を比較することを意味します:
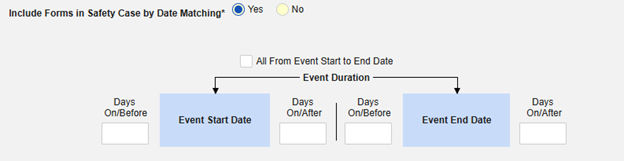
- オプションをチェックするか、特定の 日数 値を設定します。これらのオプションのうち 1 つ以上を選択 / 設定する必要があります。
- 終了するには、 [保存して閉じる] をクリックします。
各包含基準オプションの詳細と例については、上記の「オプションの意味 & 例」 を参照してください。
薬歴
このタイプの安全性構成は、治験の薬歴フォームに適用されます。情報は、Veeva Safety の 薬歴 セクションに送信されます。
実例:
- スタディデザインでは、 スクリーニング訪問 時に、研究者が適切と判断した、および/またはプロトコルに従って、薬物使用履歴情報を収集します。これらは具体的には、被験者が試験に参加する前に服用(および終了)された薬剤/製品です。
- 2025年3月7日、被験者は重篤な有害事象(「めまい」)が発生し、発生し、施設はAEフォームの作成を開始しました。
- システムは「めまい」を主要イベントとして安全ケースを作成し転送します。
- このタイプの安全性データの試験設定に従って、被験者が経験するすべての安全性ケースにすべてが含まれる必要があります。
- あるいは、日付ベースおよび/またはサイトリンクオプションを使用することもできます。
この安全タイプの組入基準を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
- 以下のオプションから選択してください。
- すべてのフォームを安全性ケースに含める (デフォルト: いいえ): はいを選択すると、現在併用しているすべての薬がケースに含まれ、他のすべてのオプションが無効になります。
- 施設ユーザによってリンクされた関連フォームを含める: 施設によって主要な発端イベントにリンクされた併用薬を症例に含める場合は、 [はい] を選択します。警告: はい を選択した場合、フォームには フォーム間 または アイテムからフォーム のリンクも設定されている必要があります。
- 施設ユーザがリンクしたフォームを安全性ケースに含める: はい または いいえ を 警告に対して選択します。はい を選択した場合、フォームには フォーム間リンクまたは アイテムとフォームのリンク も設定されている必要があります。
-
「日付の一致によりセーフティにフォームを含める」 で 「はい」 または 「いいえ」を選択します。はい の場合、システムは 1 つ以上の基準を使用して、安全ケース イベント (プライマリ) の 開始から 終了までの範囲と関連データ (アクティブに構成されているフォーム、その開始範囲と終了範囲) を比較することを意味します:
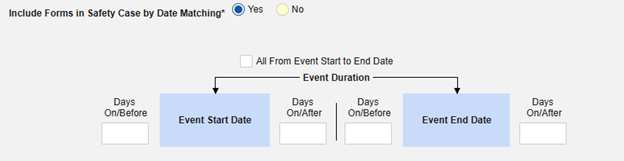
- オプションをチェックするか、特定の 日数 値を設定します。これらのオプションのうち 1 つ以上を選択 / 設定する必要があります。
- 終了するには、 [保存して閉じる] をクリックします。
各包含基準オプションの詳細と例については、上記の「オプションの意味 & 例」 を参照してください。
検査結果
このタイプの安全性構成は、治験のラボ / 検査結果フォームに適用されます。情報は、Veeva Safety の 検査結果 セクションに送信されます。
実例:
- スタディデザインでは、研究者/施設の必要に応じて、追加の検査/テスト結果をログ フォームで収集します。つまり、重大な有害事象に関連していると判断される検査です。
- 2025年3月7日、被験者は重篤な有害事象(「めまい」)が発生し、発生し、施設はAEフォームの作成を開始しました。
- さらに、施設では 2つの範囲外検査を追加し、それぞれに対して AE フォームへのリンクを作成します。
- システムは「めまい」を主要イベントとして安全ケースを作成し転送します。
- この研究には、施設がイベントにリンクするものをすべて含めるように指示する安全性構成があるため、2つのテスト結果がケースに含まれています。
- さらに(または代わりに)、日付ベースのオプションを使用することもできます。
この安全タイプの組入基準を保存するには:
- スタディの スタジオ >> フォーム設定に進みます。
- 以下のオプションから選択してください。
- すべてのフォームを安全性ケースに含める (デフォルト: いいえ): はいを選択すると、現在併用しているすべての薬がケースに含まれ、他のすべてのオプションが無効になります。
- 施設ユーザによってリンクされた関連フォームを含める: 施設によって主要な発端イベントにリンクされた併用薬を症例に含める場合は、 [はい] を選択します。警告: はい を選択した場合、フォームには フォーム間 または アイテムからフォーム のリンクも設定されている必要があります。
- 施設ユーザーがリンクしたフォームを安全性ケースに含める: はい または いいえ を 警告に対して選択します。 はいを選択した場合、フォームには フォーム間リンクまたは アイテムとフォームのリンク も設定されている必要があります。
-
「日付の一致によりセーフティにフォームを含める」 で 「はい」 または 「いいえ」を選択します。はい の場合、システムは 1 つ以上の基準を使用して、安全ケース イベント (プライマリ) の 開始から 終了までの範囲と関連データ (アクティブに構成されているフォーム、その開始範囲と終了範囲) を比較することを意味します:
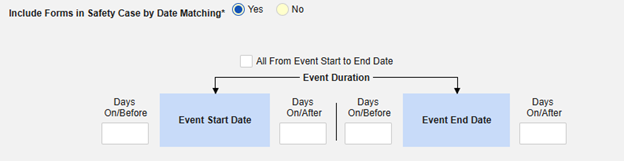
- オプションをチェックするか、特定の 日数 値を設定します。これらのオプションのうち 1 つ以上を選択 / 設定する必要があります。
- 終了するには、 [保存して閉じる] をクリックします。
各包含基準オプションの詳細と例については、上記の「オプションの意味 & 例」 を参照してください。
患者特性
このタイプの安全性構成は、患者に関する一般的な情報に適用されます。このタイプには 基準はありません 。代わりに、このタイプに分類される情報は、対象の すべての 安全性ケースに含まれます。
[アイテム設定] タブから [組入基準] タブに移動した際、 [保存して次へ]をクリックすると、 [フォーム設定] リストに戻ります:
死亡例
このタイプの安全性構成は、対象者の死亡に関する詳細情報を含むフォームに適用されます。このタイプには 基準はありません 。代わりに、このタイプに分類される情報は、対象の すべての 安全性ケースに含まれます。
現在、すべてのケースでこの情報が受信されます。ケース内のどのイベントにも結果 致命的がない場合でも。
[アイテム設定] タブから [組入基準] タブに移動した際、 [保存して次へ]をクリックすると、 [フォーム設定] リストに戻ります:
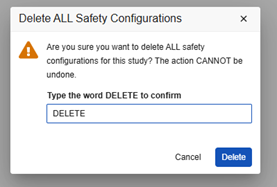
すべての安全性構成を削除する
スタディデザインのすべての安全性構成を削除するときは、細心の注意を払ってください。このアクションにより、スタディは構成が存在しない状態に戻り、再度開始する必要があります。
このアクションを実行するには、開発研究にゼロの 安全性ケース が存在している必要があります。開発環境ですでに 安全性ケース を作成している場合は、 非本番環境のテスト データを削除できます。
Go-Live 後の削除: 下流の環境 (テスト、トレーニング、本番) に安全性構成と安全性ケースがある場合は、この操作を実行しないでください。展開スタディで安全性ケースを削除し、その後安全性構成を削除できたとしても、その後のテスト/Training/本番環境への展開は失敗します。
研究のすべての安全性構成を削除するには:
仕様書のダウンロード
スタディデザイン仕様または すべての CRF PDF のエクスポート を使用して、安全性設定をダウンロードできます。安全性統合を構成すると、 安全性設定 と 安全性フォーム構成の 2 つの追加タブが生成されます。
安全性設定を展開する
スタディの DEV 環境での設定が完了したら、TST にデプロイして試験を実施し、トレーニングおよび本番環境へとデプロイできます。
統合のセットアップと接続を除く Safety の設定は、スタディの展開パッケージに自動的に含まれます。試験の展開時に、Vault は現在の設定をパッケージに含めます。
この構成は治験の展開の一部として管理されるため、DEV タイプの環境でのみ変更できます。変更する場合は、DEV 環境で変更し、その変更を他の環境に展開します。この構成は、ケースブックバージョン出版物の一部としてバリデーションされています。バリデーション中は、編集ができなくなります。予想されるエラーや警告のリストは、こちらでご確認いただけます。
試験のデプロイについて説明します。
カスタムセーフティフィールド
Safety-EDC 接続は、マッピング用の標準安全性フィールドとして、最も一般的な安全性関連フィールド (E2B および非 E2B) を提供します。EDC から Veeva Safety への情報転送の柔軟性をさらに高めるために、追加のカスタム安全性フィールドを設定できます。カスタム フィールドは、適用される安全性データ タイプの [アイテム構成] メニューに他の標準フィールドとともに表示されます。
- Veeva Safety では、安全性ケースには、有害事象、死亡原因、評価などの複数のサブセクションがあります。この構造は、階層的なオブジェクト構造で表されます。ケース オブジェクトは、関連するすべてのケース セクション オブジェクトの親であり、ケースの有害事象、ケースの死亡原因、ケース評価など、UI 内の安全性ケースのサブセクションを表します。
- したがって、それぞれのケース子オブジェクトにエントリを追加することで、Veeva Safety のカスタム安全性フィールドを使用してケースの個々のサブセクションを修正できます。詳細については、Veeva Safety ヘルプを参照してください。
- Veeva Safety でケース子オブジェクトを修正する場合、Veeva EDC の次の設定において最も重要な情報は次のとおりです。
- 子オブジェクト(例: case_medical_history__v)
- 正確なカスタム フィールド名 (たとえば、新しいカスタム フィールド「慢性疾患」の場合、フィールド名は chronic_condition__c になります)。
- Veeva EDC でカスタム 安全性フィールドを作成するには、新しい Safety コネクタ フィールド定義エントリを作成する必要があります。マッピングのために Safety データ タイプのいずれかの正しい場所を構成するには、特に グループ化プロパティ (つまり、どの Safety データ タイプに項目を表示するか) と 表示順序 が重要です (詳細は以下を参照)。
- Veeva EDC から Veeva Safety へのデータ転送は JSON に基づいています。さらに、Veeva Safety への正しい転送を可能にするには、JSON 構造を理解し、新しい Safety Connector フィールド定義で構成する必要があります。データのマッチングのため、JSON ノード名は Veeva Safety のカスタム フィールド名と一致している必要があります (詳細は以下を参照)。
- カスタム 安全性フィールドは Vault レベルで構成され、既存の研究と新しい研究の両方のマッピングに使用できます。
- 新しいカスタム 安全性フィールドは既存の研究にはマッピングされませんが、既存のケースは影響を受けず、構成によってフォローアップ メッセージは表示されません。
例 1
-
Veeva Safety の 安全性ケース の Adverse Event サブセクションには、安全性ケースのイベントが格納されます。Case Adverse Events オブジェクト (case_adverse_event__v) は、このサブセクションに表示されるフィールドを提供します。 このサブセクションにあるデータは、主に EDC 研究の AE/SAE フォームに記載されています。Veeva EDC から Veeva Safety に転送されるフィールドは、 安全性ケース Initiation Event データ タイプのフィールドに対応します。安全性のユーザー インターフェースでは、これらは次のように表示されます。
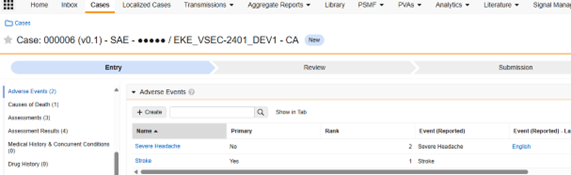
-
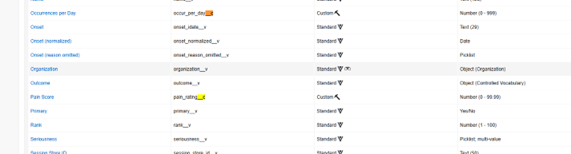
以下では、Veeva Safety オブジェクトに 2 つの Custom 安全性フィールドs を追加しました。これらのフィールドには末尾に「__c」、 痛みスコア (pain_rating__c)、 1 日あたりの発生回数 (occur_per_day__c) が付いていることに注意してください。
-
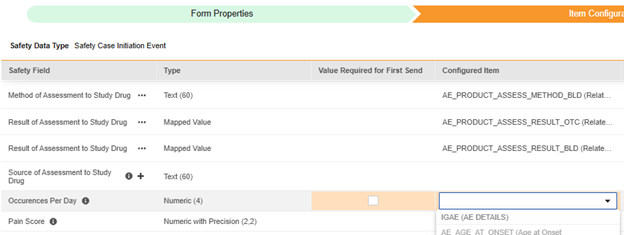
対応する Safety データ タイプでフィールドが設定されると、そのフィールドは標準 安全性フィールドとともにマッピングに使用できるようになります。
例 2
- Veeva Safety のテスト結果サブセクションには、 ケース テスト結果 オブジェクト (case_test_result__v) の安全性ケースのテスト結果に対して設定されたすべてのフィールドが表示されます。これらのレコードは通常、EDC ラボ結果フォームで構成され、 検査結果 データ タイプにマップされます。
-
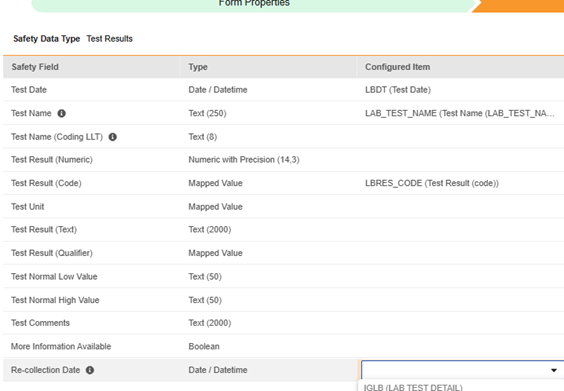
以下に、Veeva Safety オブジェクトにカスタム フィールド 再収集日 (recollection_date__c) を追加しました。
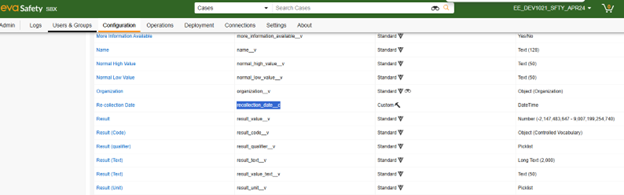
- EDC 側で考慮されると、フィールドはStandard 安全性フィールドsと一緒に使用できるようになります。
EDC内のカスタム安全性フィールド
Veeva EDC でのカスタム安全性フィールドの構成は、Vault レベルで実行されます。新しいフィールドは、すべての既存および新規の研究でマッピングできるようになります。
カスタム安全性フィールドには重要な考慮事項があります。
- この機能を正常に構成し、最大限に活用するために必要な計画と手順については、Veeva の担当者にご相談ください。
- カスタム安全性フィールドの作成または更新には、Veeva EDC と Veeva Safety 構成間の慎重な調整が必要です。
- カスタム安全性フィールドを誤って構成すると、Veeva EDC から Veeva Safety へのデータ転送が破損する可能性があります。
- また、EDC 設計チーム、Safety ユーザー、場合によっては他の Veeva アプリケーションを使用するメンバーも含めたプログラム レベルの決定も検討してください。
- Veeva EDC での設定に先立って、Veeva Safety でカスタム安全性フィールドを設定することをお勧めします。
- 設定には、Veeva Safety と Veeva EDC の両方で Vault Owner セキュリティ プロファイルを持つアカウントが必要です。
- 接続の EDC 側の構成は、開発用 Vault /「コントロール センター」で 1 回実行されます。開発用 Vault からテスト、実稼働、またはトレーニングに構成を移動するには、安全性オプションをオンにした状態で、システム ツールから Vault レベルの展開 を使用します。
Vault 所有者が必要: Vault 所有者 セキュリティ プロファイルを持つユーザーは、カスタム安全性フィールドを構成する必要があります。
Veeva EDC で Veeva Safety に対応するカスタム安全性フィールドを構成するには:
- 国を追加するには、作成をクリックします。
- 以下のフィールド レベルの情報ガイドラインに従って、新しいレコードを入力します。
- 保存をクリックします。
| Vault フィールド | 値 | メモ | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
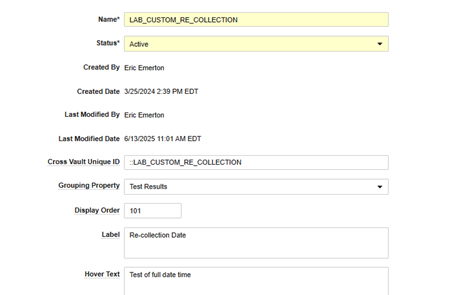
| 名前 | (テキスト) | 命名は、安全データ タイプ別に、すでにリスト内にある他の標準/フィールド名と一貫性を持たせることをお勧めします。たとえば、 MH_CHRONIC_CONDITION は、病歴が「慢性疾患」であるかどうかを収集するフィールドです。先頭に付加された 'MH_' テキストは他の MH フィールドを反映します。 | ||||||||||||||||||||||||
| クロス Vault 固有 ID | (::名前) | 先頭に 2 つのコロンを付ける必要があります。名前と 同じ 値の前に '::' を付けて使用することをお勧めします。例えば ::MH_CHRONIC_CONDITION | ||||||||||||||||||||||||
| グループ化プロパティ | (ピックリスト) | このフィールドはSafetyデータ タイプ (領域) であり、Veeva Safety の安全性ケースの宛先サブセクションと一致させることが推奨されます。たとえば、有害事象セクションの情報は、 安全性ケース開始イベントに配置する必要があります。
|
||||||||||||||||||||||||
| 表示順序 | (整数値) | 通常、これは、その安全性データ タイプ (グループ化プロパティ) の既存の他のすべての値よりも大きい値です。位置が決定し、下に向かって読むと、その安全データ タイプの アイテム構成 リストに行が表示されます。既存の値を選択した場合、重複したエントリに対する表示順序は決定的ではありません。 | ||||||||||||||||||||||||
| ラベル | (テキスト) | マッピングのためにスタジオの安全性データ タイプのカスタム安全性フィールドに表示されるラベル (例: 再収集日) | ||||||||||||||||||||||||
| テキストをマウスオーバーする | (テキスト) | オプションで、ラベルの横にある「i」ホバーアイコンに表示されるテキストを指定します。 | ||||||||||||||||||||||||
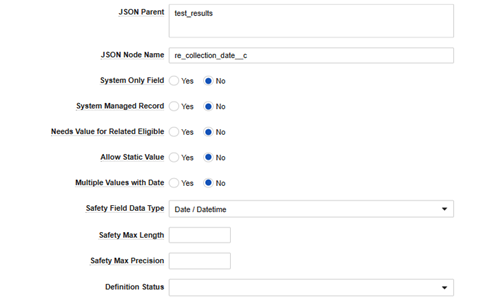
| JSON 親 | (テキスト) | 注: このフィールドの設定には、Veeva コンサルタントのサポートをお勧めします。無効な値が挿入されると、EDC から Safety へのデータ転送が破損します。誤った構成に対するシステム検証は実施されていません。
値は、2 つのシステム間で交換される JSON ファイルに対応します。Safety と EDC のデータ型の位置に基づいた値のみを使用します。
|
||||||||||||||||||||||||
| JSON ノード名 | (テキスト) | この値は、Veeva Safety のフィールド名と正確に一致する必要があります。たとえば、フィールド MH_CHRONIC_CONDITION が Veeva Safety case_medical_history__v.chronic_condition__c にある場合は、 chronic_condition__c を使用します。 |
||||||||||||||||||||||||
| システム専用フィールド | 常に設定 No | いいえ のみサポートされています | ||||||||||||||||||||||||
| システム管理対象のレコード | 常に設定 No | いいえ のみサポートされています | ||||||||||||||||||||||||
| 関連する対象者にとって価値が必要 | 常に設定 No | いいえ のみサポートされています | ||||||||||||||||||||||||
| 静的値を許可 | はい または いいえ | はい を選択すると、 アイテム設定 UI の行では、データ入力の EDC フォーム の アイテム設定 /フィールドからの値ではなく、安全性へのデータフロー内の静的な値が許可されます。 | ||||||||||||||||||||||||
| 日付を含む複数の値 | 常に設定 No | いいえ のみサポートされています | ||||||||||||||||||||||||
| 安全性フィールドデータタイプ | メモ参照。 | フィールドのタイプ (例: 日付、数値、テキスト)。タイプに応じて、レコードの他のフィールドで追加の構成が必要になります。
|
||||||||||||||||||||||||
| 安全性最大長 | 整数値 | Safetyでフィールドに設定された値を示します。安全性フィールドデータタイプを参照。 | ||||||||||||||||||||||||
| 安全性最大精度 | 整数値 | 精度を許容するフィールドの場合は、ここでその値を指定します。安全性フィールドデータタイプを参照。 | ||||||||||||||||||||||||
| 定義ステータス | 常に空白のままにしてください | このフィールドが空白の場合のみ、「アクティブ」を意味します。ステータスが アーカイブ済み になると、フィールドはスタジオに表示されなくなります。 | ||||||||||||||||||||||||
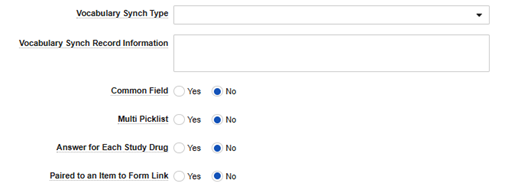
| 語彙同期タイプ | メモ参照。 | ここでの値は、 安全性フィールド データ タイプ が マップされた値である場合にのみ適用されます。選択内容に応じて、次のフィールド(語彙同期レコード情報)に追加情報が必要になります。 | ||||||||||||||||||||||||
| 語彙同期レコード情報 | メモ参照。 | このフィールドは、選択した 語彙同期タイプ に基づいて、EDC にそれらの選択肢を見つける場所を指示します。
|
||||||||||||||||||||||||
| 共通のフィールド | 常に設定 No | いいえ のみサポートされています | ||||||||||||||||||||||||
| 複数の選択リスト | はい または いいえ |
|
||||||||||||||||||||||||
| 各治験薬の回答 | 常に設定 No | いいえ のみサポートされています | ||||||||||||||||||||||||
| 項目からフォームへのリンクとペアになっている | 常に設定 No | いいえ のみサポートされています |
前述の例のセクションの 例 2 から、適切に構成された 再収集日 カスタム フィールドは次のように表示されます。
カスタムフィールドの展開
- Veeva EDC でのカスタム安全性フィールドの構成は、開発環境 (「コントロール センター」) を含む EDC Vault で 1 回実行されます。
- 開発用ボールトから他のボールト (テスト/UAT、本番環境、トレーニング) に構成を移動する場合は、ダウンストリーム ボールトで手順を再実行しないでください。
-
代わりに、 [ツール] > [システム ツール] の [Vault デプロイメント] オプションを使用し、[ Safety コネクタ定義 ] をオンにします。
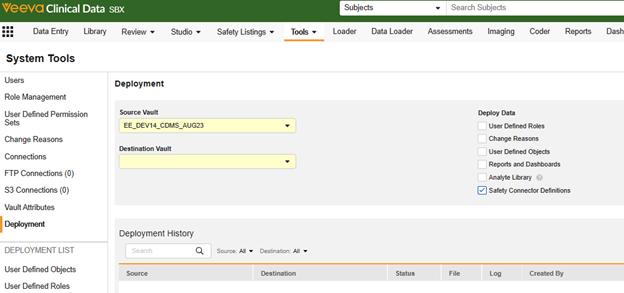
- Veeva EDC での Vault レベルの展開の詳細については、「 システム ツールでの Vault レベルの構成の展開」を参照してください。
標準 & カスタムフィールドのカスタム安全性値
Veeva Safety では、Vault ピックリスト または 制御語彙 オブジェクトのレコードを使用して、特定の標準およびカスタム安全性フィールドで使用可能な値 (薬剤に対するアクションの使用可能なオプションなど) を定義します。利用可能なオプションは、標準セット以外の追加の選択肢を使用して構成できます (例: 薬剤によるアクションに「投与中断」を追加する)。
Veeva EDC では、フィールドが Veeva Safety 側で指定された利用可能なオプションを使用して標準フィールドまたはカスタム フィールドにマップされている場合、アイテム構成手順で Value Translations が必要になります。
Value Translations を必要とする安全データ タイプのフィールドは、安全フィールド データ タイプが マップされた値に設定されている安全コネクタ フィールド定義によって識別できます。新しく設定または更新されたオプションを Veeva EDC で使用できるようにするには、接続安全性スキャン ジョブを再実行する必要があります。EDC では、アイテム定義 の コードリストタイプまたは ブール値 が通常これらの安全性フィールドにマッピングされます。
安全性フィールド値の更新は Vault レベルで構成され、既存の研究と新しい研究の両方に適用されます。既存の研究への影響を考慮する必要があります。
例 1
安全性ケース開始イベントの試験薬に対して取られた措置の 安全性フィールドは、安全性イベントと治験の治験薬に関する重要な回答です。 Veeva Safety の選択肢には、追加のカスタム選択肢である「 一時的に中止 / 中断された薬剤」を追加できます。
EDC Vault が Veeva Safety と同期されると (次のセクション)、追加の選択肢が、研究デザインの EDC項目構成のValue Translationsに選択肢として表示されます。
例 2
安全性フィールド配信方法は、安全性ケース開始イベントおよび患者特性に使用可能で、3 つの標準の選択肢があります。 その ピックリスト の 不明 の 4 番目のカスタム選択肢は、Veeva Safety で次のように設定されます。
例 1 と同じように、EDC Vault が Veeva Safety と同期されると、Value Translations を構成するための 4 番目の選択肢が表示されます。
カスタム安全値をEDCに同期する
カスタム値に関して重要な考慮事項があります。
- カスタム安全性フィールドと同様に、この機能を正常に構成し、最大限に活用するために必要な計画と手順については、Veeva の担当者にご相談ください。
- 既存の研究への影響を考慮する必要があります。
- 同期安全性フィールドを誤って構成すると、Veeva EDC から Veeva Safety へのデータ転送が破損する可能性があります。
- カスタム安全性フィールド値を更新すると、EDC で値の変換が行われずに値が残っている場合、既存の研究で検証エラーが発生する可能性があります。EDC で値の翻訳が更新されると、既存のケースにフォローアップ メッセージが表示される場合があります。
- カスタム フィールドの場合、安全性フィールドの選択肢の追加または調整を慎重に計画するには、Veeva EDC と Veeva Safety 構成間の綿密な調整が必要です。また、EDC 設計チーム、Safety ユーザー、場合によっては他の Veeva Vault アプリケーション (RIM, CTMS, ..) を使用するメンバーも含めたプログラム レベルの決定も検討してください。
- Veeva EDC での設定に先立って、Veeva Safety でカスタム安全性フィールドを設定することをお勧めします。
- Veeva Safety では、選択肢を構成するには Vault 所有者のアクセスが必要です。
- Veeva EDCでは、 システムツール > 接続 > Safety の場所で語彙スキャンジョブを使用して選択肢が同期されます。
- 接続の EDC 側での構成は、開発タイプ環境 (「コントロール センター」) を含む EDC Vault で 1 回実行されます。開発用 Vault からテスト/UAT、実稼働、またはトレーニングに構成を移動するには、安全性オプションをオンにした状態で、システム ツールから Vault レベルの展開 を使用します。
Veeva Safety から新しく作成/更新された選択肢を Veeva EDC Studio 画面に同期するには:
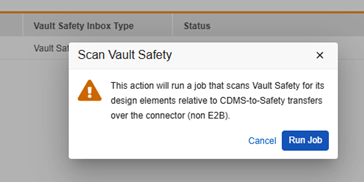
- [接続] [システム ツール] > [接続] > [Safety] に移動します。
- 接続の名前にカーソルを合わせると、スキャンボタンが表示されます。
- Vault Safety をスキャンダイアログでジョブの実行をクリックします。
Vault がジョブを完了すると、電子メール通知が届き、EDC 研究設定のすべての安全性フィールドの値の翻訳選択肢が、ペアの Veeva Safety の選択を反映します。
カスタム値の展開
- カスタム値の接続の EDC 側の設定は、開発環境 (「コントロール センター」) を含む EDC Vault で 1 回実行されます。
- 開発用ボールトから他のボールト (テスト/UAT、本番環境、トレーニング) に構成を移動する場合は、ダウンストリーム ボールトで手順を再実行しないでください。
-
代わりに、 [ツール] > [システム ツール] の [Vault デプロイメント] オプションを使用し、[ Safety コネクタ定義 ] をオンにします。

- Veeva EDC での Vault レベルの展開の詳細については、「 システム ツールでの Vault レベルの構成の展開」を参照してください。
安全性フィールド参照(システム生成)
このページには、 安全性ケース で Veeva Safety に送信される静的要素とシステム生成要素がリストされています。
| セーフティフィールド | データタイプ | ソース | 説明 |
|---|---|---|---|
| 試験ラベル | テキスト | 静的 | Veeva EDC のスタディラベル。安全性設定を使用して特別に上書きすることができます。 |
| スタディ番号 | テキスト | 静的 | Veeva EDC のスタディラベル。安全性設定を使用して特別に上書きすることができます。 |
| ソースからレポートを最初に受信した日付 | 日時 | システム生成済み | このフィールドは、イベント用にすべての必須フィールド (アイテム) がキャプチャされる場合に、日付と時刻をキャプチャします。 |
| 本レポートに関する直近の情報の日付 | 日時 | システム生成済み | 最後の安全性メッセージが送信された後に、データ入力ユーザが安全性ケースのデータ対して指定した日付に行った最初の変更が示されます。たとえば、最初に午前 8 時に「治療歴」フォームのデータを変更し、次に同日午前 10 時に [SAE] フォームのデータを変更し、最後に同日午前 11 時に 2 つの [併用薬] フォームをリンクし、同じ安全性ケースのデータにすべての変更を加えた場合、次回の転送予定での C.1.5 の値はその日の午前 8 時になります。 |
| 報告者の情報 | テキスト | 施設またはユーザーが入力した | 研究の報告者(安全性設定)のオプションに応じて、これは施設の主任研究員からのものです。Safety-EDC 接続では、特定の EDC フォーム項目を報告者情報の各部分にマッピングできます。記入すると、ベースサイト/主任研究員情報が上書きされます |
| 反応/イベントが起こった国の識別 | テキスト (2) | 施設またはユーザーから | 施設の試験国の 2 文字の国コード。または、施設のデータ入力フォームにマッピングして上書きすることもできます。(例:被験者が国外にいるときにイベントが発生する) |