配置 E2B 研究
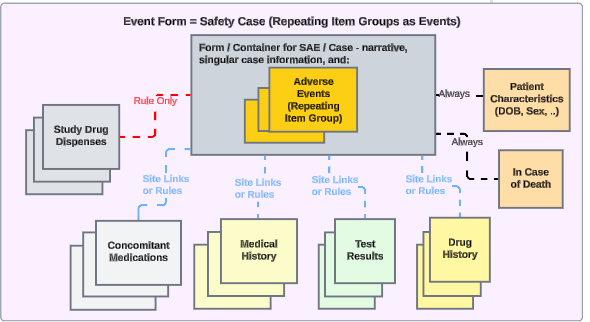
Veeva EDC 与任何第三方安全系统的安全集成均基于通过 AS2 网关交换 E2B XML 文件(R3 版本)实现。通过适当的集成配置,所有必需及补充的安全相关 EDC 数据会以安全病例形式发送至安全系统。触发数据传输的示例包括:临床试验中的严重不良事件、特别关注的不良事件以及意外妊娠。
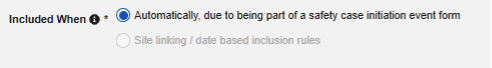
通过针对研究设计的集成设置,当研究中心创建符合安全病例启动标准的事件时,Veeva EDC 会自动生成首次发送并将数据传输至安全系统。
通过将以下位置归类为安全数据类型,相关数据也可插入安全病例:
- 研究药物(临床试验中正在测试的一种或多种产品)
- 伴随用药
- 病史
- 药物史
- 测试结果
- 患者特征
- 如果死亡
- 按系统划分的报告者/发送者评论
若安全病例的启动数据或相关数据发生任何更新,系统将在设定的时间间隔内自动生成后续发送任务,并传输至安全系统。
研究设计者需通过将 EDC 研究设计中的条目映射至 E2B R3 元素,完成集成配置。已映射的病例手册元素能否纳入安全病例还取决于已配置的纳入规则:可选择将映射条目纳入某一受试者的所有病例手册表单、由研究中心链接至安全病例启动表单的表单,或与启动事件相关且处于选定日期范围内的表单。
安全病例可由单个事件创建,也可整合多个事件构成,具体通过研究中心链接规则和/或基于日期的纳入规则进行配置。
系统接受来自安全系统的确认回执(“ACK 文件”),以确认数据已被接收并正确解析。该返回信息会说明病例状态、消息状态,并在存在错误时提供错误详情。
摘要信息可以在安全病例(V4)和安全消息 - E2B(V4)报告中获得,以确认集成状态和运行状况。安全集成还支持自动无效传输功能:当触发初始数据传输的条件不再成立时,将生成无效。例如表单重置(错误录入导致)或事件严重程度降级等场景。请参阅无效。
安全管理员负责设置首次发送的时间、后续发送的频率,以及集成相关的其他操作配置。请参阅“管理安全集成”中的“安全设置”,以了解详细信息。
先决条件
拥有 Vault 所有者安全配置文件的用户必须在 Veeva EDC 与安全系统之间建立连接。
拥有标准 CDMS Study Designer(CDMS 研究设计者)或 CDMS Librarian(CDMS 库管员)研究角色的用户均可查看和编辑安全配置。如果贵组织使用自定义研究角色,则你的角色必须授予以下权限:
| 类型 | 权限标签 | 控制 |
|---|---|---|
| “标准”选项卡 | Studio 选项卡 | 能够访问 Studio 选项卡 |
| “标准”选项卡 | “库”选项卡 | 能够访问库(Library)选项卡 |
| 功能权限 | 查看研究设计 | 仅查看研究设计 |
| 功能权限 | 设计研究 | 能够通过工作室创建研究设计定义和研究计划 |
| 功能权限 | 管理安全配置 | 能够为研究设计与配置安全集成,包括确定涉及的表单、表单中需发送至安全系统的条目,以及规定表单数据能否纳入安全病例的纳入标准。 |
| 功能权限 | 查看库 | 能够通过“工作室(Studio)”>“库(Library)”查看库集合 及其设计 |
| 功能权限 | 设计库 | 能够通过“工作室”>“库”为集合 创建研究设计定义和研究计划 |
安全集成类型
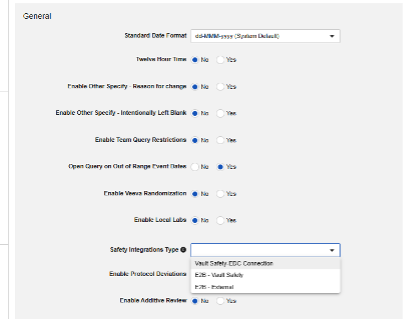
配置 Veeva EDC 安全集成的第一步是在研究设置中设置安全集成类型(Safety Integration Type)值。
一旦安全集成类型设置为非空值,该字段将变为只读状态。这是由 E2B 型集成与 Safety-EDC 连接型集成的本质差异决定的。若需在两种类型间切换,请联系 Veeva 代表获取协助与规划支持。
有关使用 Safety-EDC 连接进行安全集成的更多信息,请参阅“配置 Safety-EDC 连接研究”。
完成整体集成类型保存后,工作室导航菜单中将新增两个选项:安全设置(Safety Settings)和表单配置(Form Configurations):
安全设置
更新设置
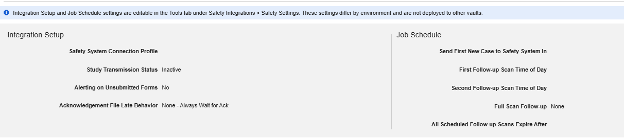
在工作室的主研究设置中设置了合适的安全集成类型后,下一步需配置安全病例设置。这些设置将影响研究中的所有安全病例,且可能因研究不同而有所差异。
注意:“安全设置”页面底部的附加设置无法在工作室内管理。这些信息会在已部署的研究中显示以作提醒,即当在生产环境或其他下游环境中操作工作室时。这些研究操作设置由安全管理员在工具 → 安全集成中进行管理。请参阅“管理安全集成”中的“安全设置”,以了解详细信息。
可用设置
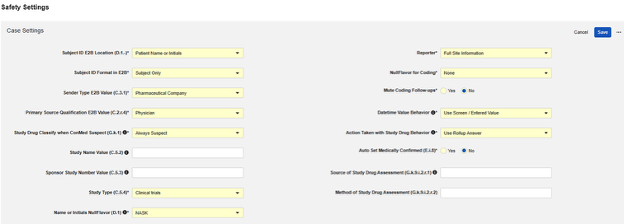
| 设置 | 默认值 | 说明 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 受试者 ID E2B 位置(D.1.-) | 患者姓名或姓名缩写(Patient Name or Initials) | 选择当前研究中 Veeva EDC 受试者 ID 的 E2B 传输目标位置:
|
||||||||||||||||||||||||
| E2B 中的受试者 ID 格式 | 仅受试者 | 选择用于将 Veeva EDC 受试者 ID 传输到安全系统的格式。
|
||||||||||||||||||||||||
| 发送者类型 E2B 值(C.3.1) | 制药公司 | 选择将安全病例从 Veeva EDC 发送到安全系统的组织类型。此值通过 C.3.1 传递。可以从以下组织类型中进行选择:
|
||||||||||||||||||||||||
| 主要来源资格认定 E2B 值(C.2.r.4) | 医生 | C.2.r.4 生成研究药物或治疗评估人的分类,因为它与安全病例 的每个事件 相关。可以从以下分类类型中进行选择:
|
||||||||||||||||||||||||
| 当 ConMed 可疑时,对研究药物分类(G.k.1) | 始终可疑 | 可选选项包括:
该设置仅适用于试验已配置为允许数据录入用户将归类为伴随用药的表单链接至安全病例启动事件,并可覆盖默认分类“伴随用药”(E2B 值为“2”)的场景。 示例:若用户在链接药物时选择可疑(SUSPECT),而系统设置为始终交互(Always Interacting),则传输时所有研究药物都会被标记为交互(Interacting),即便系统原本将其判定为可疑(Suspect)。 |
||||||||||||||||||||||||
| 研究名称值(C.5.2) | 可选:在 E2B 文件中设置研究名称的值。如果留空,则 E2B 内容中将省略该条目。 | |||||||||||||||||||||||||
| 申办方研究编号值(C.5.3) | 可选:输入研究编号以覆盖 E2B 文件中的值。如果留空,则使用现有的研究标签。 | |||||||||||||||||||||||||
| 研究类型(C.5.4) | 临床试验 | 选择研究类型 (C.5.4)。从以下选项中选择:
|
||||||||||||||||||||||||
| 名称或首字母缩写 E2B NullFlavor(D.1) | NASK |
将此设置用于 E2B 位置 D.1(名称或首字母缩写)的 Null Flavor 值,前提是它不是为研究设置受试者 E2B 位置(D.1.*)选择的位置。选项包括:
|
||||||||||||||||||||||||
| 报告者(Reporter) | 完整研究中心信息 | 从以下选项中进行选择:
E2B 的报告者信息将基于 Veeva EDC 中研究中心的设置信息自动填充。 |
||||||||||||||||||||||||
| 用于编码的 Null Flavor | 无 |
选择编码缺失值的处理方式(当无 MedDRA 编码值时)。该设置仅适用于 Veeva EDC 研究设计中已配置编码功能且已为安全传输应用目标位置的情况。从下列选项中进行选择:
E2B 中的编码位置如下:
|
||||||||||||||||||||||||
| 静音编码跟进 | 否(No) |
设置为是(Yes)时,若唯一变更改是对 Veeva EDC 中已编码医学术语(事件、病史、死亡原因等)分配新编码或更换编码,Veeva EDC 将不会发送后续数据。若安全病例相关数据发生其他任何更改,仍会触发后续发送。 设置为否(No)时,安全病例相关数据的任何更改(包括医学术语编码更改)都会触发 Veeva EDC 发送后续数据。 如果你主要在安全系统中执行编码,则建议将此选项设置为是,以避免因编码更改向安全系统发送不必要的后续数据。 |
||||||||||||||||||||||||
| 日期时间值行为 | 使用屏幕/输入值 | 针对 EDC 表单上的日期时间字段配置安全数据时,此选项指示要发送的值。你可以从使用屏幕/输入值(Use Screen / Entered Value)中进行选择,以使用研究中心输入的值,也可以选择使用标准化(UTC)值(Use Normalized (UTC) Value),以使用相对于屏幕值偏移的研究中心时区,将日期时间标准化为 UTC。 | ||||||||||||||||||||||||
| 对研究药物行为采取的操作 | 使用主要 SAE 答案 | 此设置仅适用于研究设计允许一个安全病例包含多个事件的场景。与启动安全病例的主事件相关的其他事件数据能否随主事件一同传输,可通过相应的纳入规则配置(参见“研究药物纳入标准”)。在这类场景下,安全病例将包含多个关于对研究药物所采取措施的答案,因此,需要一种确定在 E2B 传输中使用哪个答案的方法。从以下选项中进行选择:
若采用汇总答案,系统将综合安全病例中所有纳入事件的答案,将最严重的措施通过 G.k.8 传输至安全系统。优先级顺序如下:
例如,对于两个事件,一个答案是减少剂量,另一个答案是剂量不变,总体答案是减少剂量。 |
||||||||||||||||||||||||
| 自动设置医学确认(E.i.8) | 否(No) | 此设置确定在每个 Veeva EDC 传输的安全病例中包含“由医疗专业人员进行医学确认”(E.i.8)。选择是(Yes)以包含。如果选择否,则 E2B XML 中将省略 E.i.8。最常用设置为是,因为安全病例源自临床试验中心/研究者。 | ||||||||||||||||||||||||
| 研究药物评估来源(G.k.9.i.2.r.1) | 可选:对于“研究药物评估来源(Source of Study Drug Assessment)”(G.k.9.i.2.r.1) 和“研究药物评估方法(Method of Study Drug Assessment)”(G.k.9.i.2.r.2),输入一个要应用于所有病例的静态值。评估结果 (G.k.9.i.2.r.3) 是一个由研究中心用户回答的字段,在研究药物类型上配置。此设置最常用值为医疗专家(Healthcare Professional)。 | |||||||||||||||||||||||||
| 研究药物评估方法(G.k.9.i.2.r.2) | 可选:对于“研究药物评估方法”(G.k.9.i.2.r.2),输入适用于所有情况的静态值。此设置最常用值为全局评估(Global Introspection)。 | |||||||||||||||||||||||||
| 将次要事件研究中心链接包含到病例中 | 是(Yes) | 对此设置选择是将包括链接到案例次要事件的相关数据,而不仅仅包括主要安全病例启动事件。 |
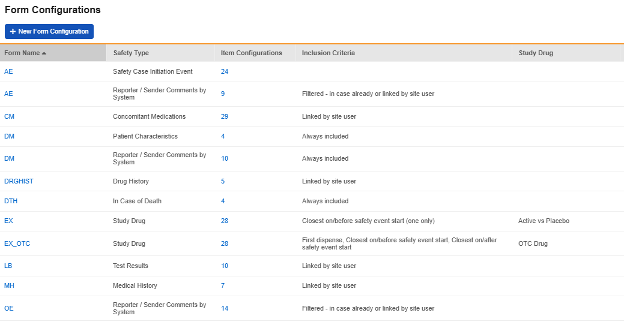
表单配置
完成主要安全设置(上一节)的更新后,下一步需配置完整研究设计中哪些特定表单参与安全集成。这些设置在工作室 > 表单配置中进行:
请注意,只有在完成安全设置配置后,新建表单配置(New Form Configuration)按钮才会激活。
研究表单配置汇总列表示例:
安全数据类型
每个为安全集成配置的表单都包含一个安全数据类型。这些类型对应各类安全系统中的标准数据模型/类型。
以下为 Veeva EDC 的安全配置类型说明:
| 类型 | E2B(R3)位置 | 备注 |
|---|---|---|
| 安全病例启动事件 | E.* |
|
| 研究药物 | G.* |
|
| 伴随用药 | G.* |
|
| 病史 | D.7.* |
|
| 药物史 | D.8.* |
|
| 测试结果 | F.* |
|
| 患者特征 | D.1 至 D.6 |
|
| 如果死亡 | D.9.* |
|
| 按系统划分的报告者/发送者评论 | H.2 或 H.4 |
|
表单配置的创建步骤
新安全表单配置的创建步骤如下:
若你拥有安全集成配置的更新权限,但未看到该按钮,请先确保已保存安全设置。
表单属性、条目配置和纳入标准选项的详细说明将按安全类型在本文档后续章节中介绍。
在每个步骤中,单击保存仅保存当前步骤的信息,不会进入下一步。单击保存并进入下一步按钮则会保存当前信息并前进到下一步。
删除表单配置
你可以删除单个表单配置或一次性删除所有表单配置以重新开始。如果你有与表单配置 关联的安全病例,则 Vault 将禁用删除选项。
要移除单个表单配置,请执行以下操作:
- 导航到研究 的工作室 > 表单配置。
- 将鼠标悬停在表单配置 的名称上以显示操作(Actions)菜单。
- 选择删除(Delete)。
- 在确认对话框中,单击删除。
删除安全表单配置不会对 EDC 表单设计本身造成任何影响。若删除研究中用于映射至安全表单的 EDC 表单,其关联的安全表单配置也会随之删除。
复制表单配置
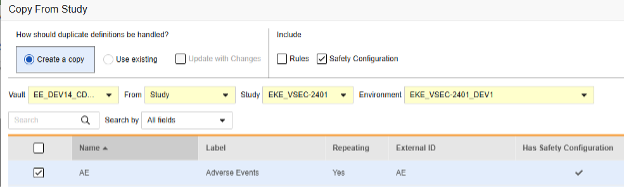
当前版本中,仅可通过“复制表单”功能复制表单的安全配置信息。其他复制级别(“复制事件组”和“复制事件”)不支持复制表单级别的安全配置。
如果从源库/研究中复制了事件组或事件(包含其中的表单),并且这些表单包含安全表单配置信息,只需在后续操作中使用“复制表单”功能并选择使用现有/使用更改进行更新(Use Existing / Update with Changes)选项即可。
执行核心表单复制时,是否同步复制安全表单配置为可选操作。
若需复制历史配置,需在包括(Include)部分中选择安全配置(Safety Configuration)。
复制时引入现有安全配置的场景:
-
后续复制:若先前已通过复制事件组或复制事件复制了表单,或最初使用复制表单时未包含安全配置,适用此场景。必须勾选使用更改进行更新。系统会根据表单的调整情况“匹配”可复制的配置内容。该场景适用于目标研究中已存在对应 AE 表单的情况:
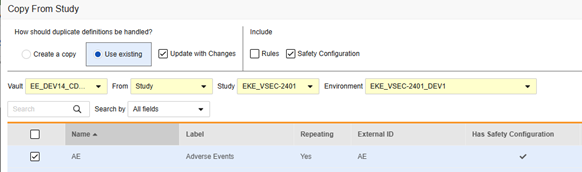
复制表单安全配置的操作步骤如下:
- 导航到工作室(Studio)> 表单(Forms)。
- 单击从研究中复制(Copy From Study)。
- 根据情况选择创建副本(Create a copy)或使用现有/使用更改进行更新(参见上面的示例)
- 选中安全配置复选框,以同时复制与表单关联的任何安全配置。Vault 会指示哪些表单在对话框的具有安全配置(Has Safety Configuration)列中具有安全配置。请注意,这需要具有管理安全配置 权限的研究角色。如果源研究和目标研究在安全配置方面不匹配,安全配置复选框将被禁用。两者都必须已设置安全配置,并且使用相同的安全集成类型。
- 选择 Vault。
- 对于从研究中复制,选择要从何处复制(从另一项研究中(From Another Study)或从库中(From Library))。
- 选择要从中复制的研究环境(Study Environment)。
- 搜索或滚动以找到要复制的表单定义。
- 选择要复制的表单。
- 单击复制表单(Copy Forms)。Vault 开始将表单定义 复制到你的研究 中。
- 可选:在从研究中复制对话框中:
- 单击查看摘要(View Summary)以查看已复制表单的列表和副本的状态。
- 如果复制的表单不超过 20 个,单击查看日志(View Log)以查看复制的每个对象记录的详细状态信息。
- 如果复制的表单 超过 20 个,完成复制后,Vault 会发送一封电子邮件通知,其中包含用于下载日志文件的链接。
- 完成后,单击关闭(Close)。单击关闭(Close)后,你将无法再访问摘要或日志文件。
- 复制表单后,请务必检查已复制表单的安全表单配置。可能需要对映射/值转换进行调整。
有关复制表单的更多信息,请参见“复制设计”。
如果源研究和目标研究在安全配置方面不匹配,安全配置复选框将被禁用。两者都必须已设置安全配置,并且使用相同的安全集成类型。
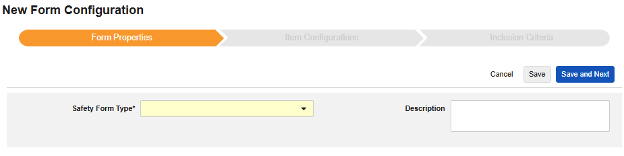
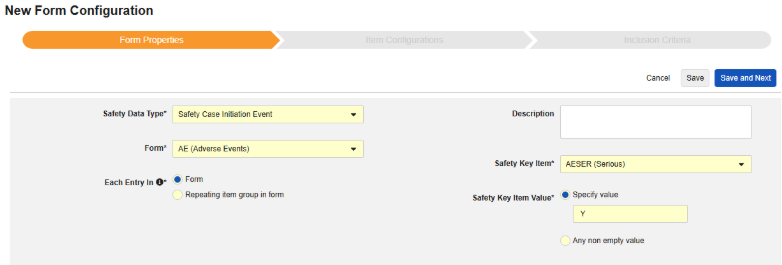
表单属性
安全表单配置的第一步是设置表单属性。从下拉菜单中选择安全类型后,系统将应用该配置的通用属性,不同安全类型对应的可用属性有所不同:
| 安全数据类型 | 属性 | |||||
|---|---|---|---|---|---|---|
| 表单 | 安全关键条目 | 以下范围内的每个条目 | 产品信息 | 系统评论目的地 | 说明 | |
| 安全病例启动事件 | * | * | * | |||
| 研究药物 | * | * | * | * | ||
| 伴随用药 | * | * | ||||
| 病史 | * | * | ||||
| 药物史 | * | * | ||||
| 测试结果 | * | * | ||||
| 患者特征 | * | |||||
| 如果死亡 | * | |||||
| 按系统划分的报告者/发送者评论 | * | * | ||||
|
* 表示该属性适用于此安全数据类型且为必填项。 表示该属性适用于此安全数据类型且为可选填项。 |
||||||
- 表单需选择待映射至安全相关条目的 EDC 表单。
- 安全关键条目是一个特殊属性,优先级高于其他所有标准,用于判定表单是否可启动病例或纳入病例。对于安全病例启动事件类型,它主导整个病例的首次发送(或后续无效)。对于研究药物类型,它是日期相关标准生效前,判定表单是否符合纳入条件的初始依据。
- 以下范围内的每个条目设置用于指示如何根据 EDC 表单的设计将信息分组为各类安全数据。详见下一章节示例与说明。理解这一点对于正确配置安全设置至关重要。
- 产品信息是关于试验中已知研究药物的信息,包括名称、是否设盲、适应症、适用于哪个研究组。
- 系统评论目的地仅适用于系统通过报告者/发送者评论以标准化方式传输 EDC 数据的场景。
- 描述是供研究设计者使用的可选帮助文本。
以下范围内的每个条目 - 设计注意事项
定义
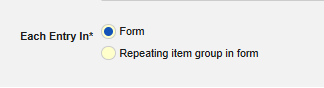
安全表单配置的表单属性中的以下范围内的每个条目概念对于数据传输配置至关重要。它用于明确告知 Veeva EDC:应提取整个(重复型)表单的数据,还是表单中重复条目组的数据。该选项包含两种选择:
- 表单:提取非重复条目组中录入的表单数据进行传输。表单可设为重复型(例如用于记录研究中的多个事件),但表单内的条目组不得为重复型。
- 表单中的重复条目组:提取表单中重复条目组的录入数据进行传输。此时多个事件通过条目组的每次重复体现,而非表单本身的重复。
表单的部分条目配置会因以下范围内的每个条目表单属性而具有不同的可用选项:该类型的大多数条目配置为“单次录入”类型,但部分特殊条目仅支持非重复型,或无限制(重复/非重复条目均可)。具体特殊条目说明详见文档后续按安全类型划分的“条目配置”小节。
以下范围内的每个条目:表单
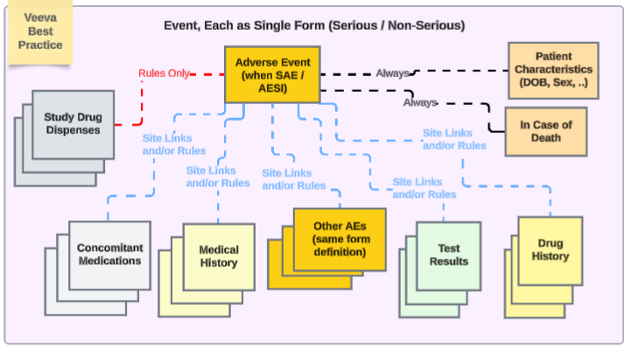
Veeva 针对具有安全集成的研究设计的最佳实践建议在不同安全类型中全程使用重复表单:
具体示例如下:
- 不良事件表单:无论非严重还是严重不良事件,均使用同一表单设计。避免研究中心用户因事件严重程度升级/降级,需在不同表单(非严重 AE 表单/严重 AE 表单)间迁移数据的问题。
- 若需 EDC 用户管理含多个事件的安全病例,可通过日期规则和/或特定研究中心链接,将其他严重/非严重事件纳入主事件。
-
其他安全数据类型:除单一答案信息(患者特征和如果死亡)外,其余均采用重复表单。请注意,此处“重复表单”包含两种情况:
- 表单本身定义为重复型(例如日志表单)
- 表单为非重复型,但在研究访视计划中多次出现(例如第 1 次访视、第 2 次访视等等均需填写的研究药物表单)
- 根据研究需要,基于研究中心意见(链接)和/或基于日期的纳入规则可以包含跨不同类型的适当相关数据。
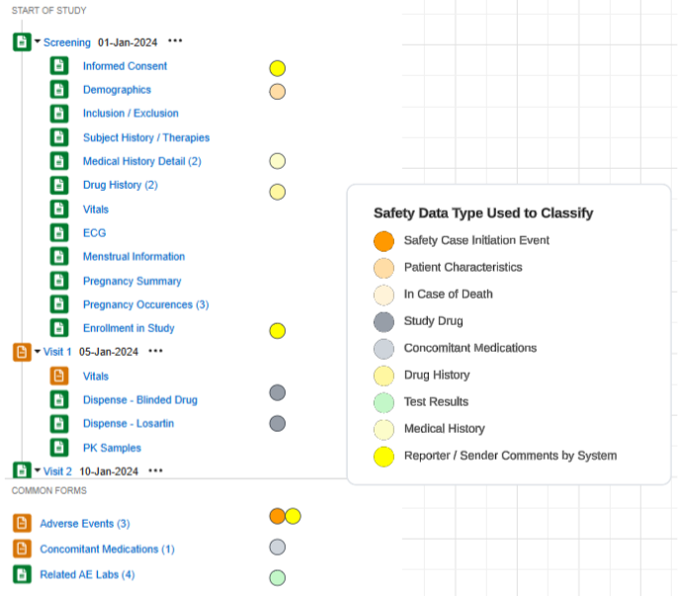
一个采用此配置的研究示例,以及应用于研究设计表单的安全数据类型:
以下范围内的每个条目:重复条目组与表单
以下示例展示以下范围内的每个条目两种选项的联合使用场景:
-
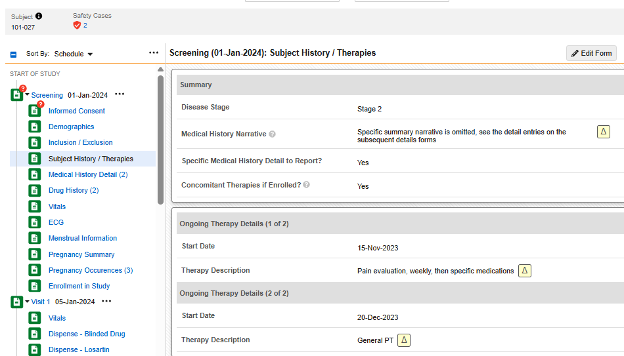
受试者病史/治疗表单在第一个条目组含少量非重复问题:
- 当对是否需报告特定病史详情?(Specific Medical History Detail to Report?)回答是时,一条动态规则(在表单提交时)会打开计划中的下一个病史详细信息表单。每份该表单记录一条病史信息。
- 当对入组后是否有伴随治疗?(Concomitant Therapies if Enrolled?)回答是时,使用渐进显示在同一表单上展示一个重复条目组。根据需要录入多条病史记录,作为该同一表单中的重复条目组。
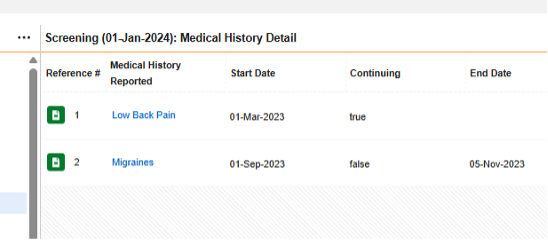
-
病史详细信息表单为重复表单,但其设计中包含的所有条目组/问题均为非重复型,因此以下范围内的每个条目 = 表单
-
在上图示例中,认为安全病例中存在四条病史记录的安全配置是:
- 表单 CTHERAPY(受试者病史/治疗情况):
- 类型 = 病史
- 以下范围内的每个条目 = 表单中的重复条目组
-
表单 MH(病史详细信息):
- 类型 = 病史
- 以下范围内的每个条目 = 表单
- 表单 CTHERAPY(受试者病史/治疗情况):
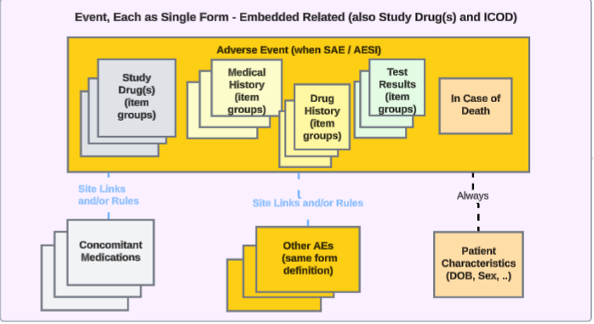
以下范围内的每个条目:嵌入在事件表单中的相关安全数据
对于将事件相关安全数据嵌入安全病例启动事件表单的研究,配置方式如下:
事件表单中嵌入的条目组(可重复)可涵盖:研究药物发放、药物史、病史或测试结果;嵌入的非重复条目组可涵盖:如果死亡。此类研究设计中,无需为嵌入数据单独设置独立表单。
为了在这种研究设计中传输安全相关数据(研究中心用户可以在事件启动安全病例时输入相关信息),已经映射到安全病例启动事件数据类型的 EDC 表单可以映射到其他安全数据类型,包括伴随用药、病史、药物史、研究药物、测试结果或如果死亡。
- 请注意,安全病例启动事件或患者特征安全数据类型不支持配置嵌入数据。按系统划分的报告者/发送者评论 数据类型已经支持在安全病例启动事件 数据类型上的双重使用。
- 如果已映射到安全病例启动事件数据类型的 EDC 表单正在映射到另一种安全数据类型,以下范围内的每个条目(Each Entry In)字段会自动选择表单中的重复条目组(Repeating item group in form)。
- 请注意,对于如果死亡、患者特征 和按系统划分的报告者/发送者评论安全数据类型,以下范围内的每个条目 字段仅允许该字段的表单(Form)选项。
以下范围内的每个条目:事件的重复条目组
若研究需在单个 EDC 表单设计中记录安全病例的多个事件,配置方式如下:
- 只要表单中存在事件记录,即可启动安全病例。
- 此研究设计需要将以下范围内的每个条目设置为表单中的重复条目组。
安全关键条目/值
表单属性设置中的安全关键条目和安全关键条目值用于评估病例启动或表单纳入病例的条件,适用于以下安全类型:
- 安全病例启动事件:系统判定结果为真时,触发首次向安全系统传输数据。相反,系统判定结果为假且此前已传输过安全病例时,向安全系统发送无效通知。
- 研究药物:系统判定结果为真时,表单中的用药发放信息具备纳入病例的资格。最终是否随安全病例传输数据,需结合研究药物纳入标准进一步判定。
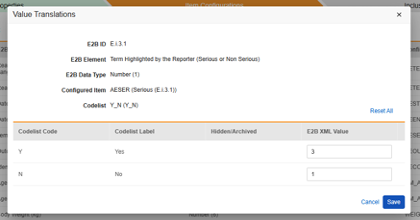
请注意,对于引用代码列表的安全关键条目值,需要指定代码列表代码,而不是代码列表标签。
以下是安全病例启动事件类型的几个常见示例:
示例 1:
-
安全关键条目关联代码列表条目“AESER”,要求代码列表代码为“Y”时启动安全病例。
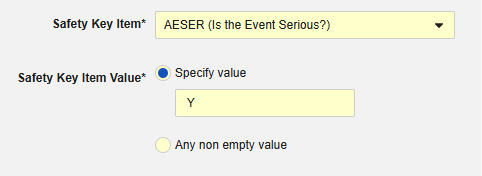
安全关键条目关联 AE 表单中的以下条目。请注意,安全关键条目值需要的是代码列表代码,而研究中心用户将从代码列表标签中进行选择。
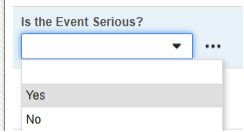
- 首次提交具有此指定答案的表单将使该表单有资格进行安全传输(包括该表单及其任何相关数据)。
- 传输将按操作层面的研究设置中配置的时间执行 - 详见此处。
- 此外,为确保传输正常进行,表单中 E2B 字段 E.i.1.1a(主要来源以母语报告的反应/事件(Reaction / Event as Reported by the Primary Source in Native Language))必须填写非空值。
- 此示例使用不良事件表单上的“是否严重”问题来判定是否发送安全病例。在任何研究/表单设计中,该字段通常也映射到 E2B 位置 E.i.3.1(报告者突出显示的术语(Term Highlighted by the Reporter))
在首次发送到 Safety 后的某个时间,上述任一条件可能不再满足。(例如,严重 = 否,或缺少“事件报告者/事件术语”值)。此时系统将自动向安全系统发送无效后续通知,表明它不再符合安全病例的条件。一旦研究中心用户修改了表单数据,无需针对安全集成采取特定操作。
示例 2:
- 示例 1 中使用 E2B 位置(E.i.3.1)作为安全关键条目。然而,任何字段都可以用于此目的,甚至是未用于映射到 E2B 字段的字段。
- 在此示例中,我们改用 AE 表单中一个更通用的问题:
虽然这不是表单上主要的“是否严重”问题,但可以为严重不良事件以及“特别关注的不良事件”(AESI,可能不严重但仍需要将数据发送到安全系统)启动安全病例。
示例 3:
- 在以下示例中,安全病例启动和无效操作对研究中心用户更加透明,同时仍使用一个安全关键条目值:
-
该代码列表的选项如下:
- “新建安全病例(New Safety Case)”(其代码列表代码)用于安全关键条目值。因此,只有此选择会启动安全病例。
- “链接至现有病例(Link to an Existing Case)”:选择此项后,系统会判定安全关键条目值为假。因此,该表单不会启动独立/额外病例。需通过工作室规则确保研究中心用户将当前表单关联至已启动安全病例的其他事件。
- “不再符合条件(No Longer..)”:适用于此前已符合安全病例标准并完成数据传输的事件。当研究中心用户选择此项表示事件降级或无效时,EDC 系统会判定该选项的代码列表代码为“假”,并针对此前启动的安全病例发送无效后续通知。
无效
每当安全病例中的数据发生更改,Veeva EDC 都会发送后续通知。无效是一种特殊的后续通知,具有以下特性:
-
满足以下任一条件即可触发:
- 安全关键条目和安全关键条目的判定结果变为假
- EDC 表单中 E.i.1.1a 的条目值变为空
- 它将在 E2B 消息中标记为无效类型
- 无效是该安全病例向安全系统的最后一次传输
- 注意:该病例的首次发送先前已发生。Veeva EDC 将在首次发送时(即初始发送计时器结束后)重新评估上述两个条件,并立即对该安全病例作无效处理而不向安全系统发送。这种情况最常见于研究中心用户在首次发送计时器结束前纠正错误、重置表单等。
- E2B 要求此类传输有作废理由。可将研究配置为让研究中心用户填写无效原因。若未配置该选项,或研究中心用户未填写,系统将使用默认原因:“该病例不再满足初始发送时的条件。这可能包括事件已降级为非严重、用户操作移除所有事件等情况。”
常见无效场景:
一旦 Veeva EDC 中的某安全病例无效,将不会恢复为活动状态。若后续修改该表单,再次使安全关键条目/值判定为“真”且 E.i.1.1a 值非空,系统会创建并发送新的安全病例,而非恢复原病例。
按安全数据类型
安全病例启动事件
此类安全数据类型的表单配置是触发安全病例传输流程的关键。其他所有安全数据类型随后将按其配置规则纳入病例。
该类型的新安全表单配置的创建步骤如下:
- 导航到工作室 > 表单配置中的研究。
- 单击新建表单配置(New Form Configuration)按钮。
- 选择安全病例启动事件作为安全数据类型(Safety Data Type)。
- 选择要应用此配置类型的表单(Form)。
- 选择合适的以下范围内的每个条目选项。(取决于表单设计)。请参阅“以下范围内的每个条目 - 设计注意事项”以获取更多信息和示例。
- (可选)填写描述(Description)。
- 指定对应的安全关键条目/安全关键条目值。注意:对于代码列表条目定义,必须指定代码列表代码。
- 单击保存或保存并进入下一步。
保存后,安全数据类型、表单和以下范围内的每个条目设置将不可编辑。条目配置和纳入标准选项卡的后续配置均依赖这些设置。若需更改这些设置,必须删除当前表单配置后重新创建。
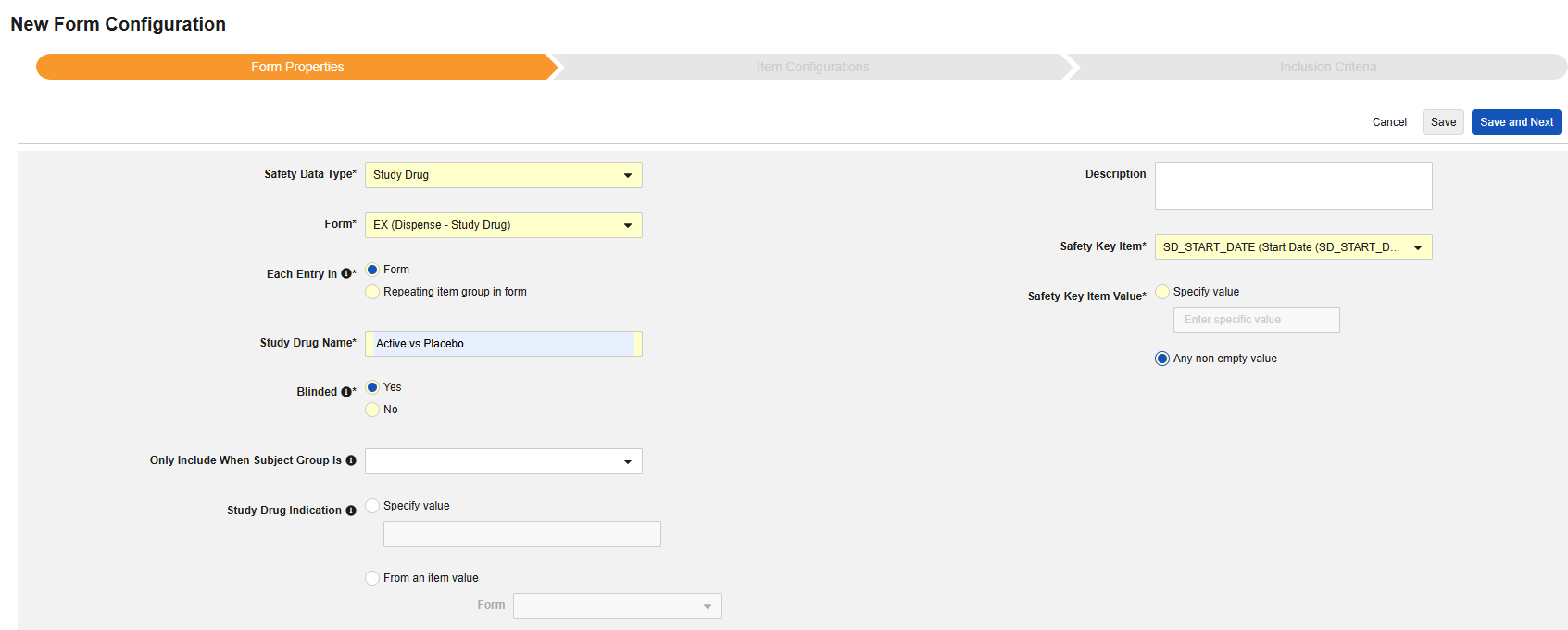
研究药物
此安全数据类型用于跟踪研究药物的剂量/配药信息,即临床研究中用于受试者的测试药物。相关信息将同步至安全病例的产品/药物部分。(E2B 的 G.* 部分)。可以使用多个具有此类型的表单。
该类型的新安全表单配置的创建步骤如下:
- 导航到工作室 > 表单配置中的研究。
- 单击新建表单配置(New Form Configuration)按钮。
- 选择研究药物(Study Drug)作为安全数据类型。
- 选择要应用此配置类型的表单。
- 选择合适的以下范围内的每个条目选项。(取决于表单设计)。请参阅“以下范围内的每个条目 - 设计注意事项”以获取更多信息和示例。
- 注意:若选择的 EDC 表单已映射到安全病例启动事件,则以下范围内的每个条目默认设为表单中的重复条目组(Repeating item group in form)。
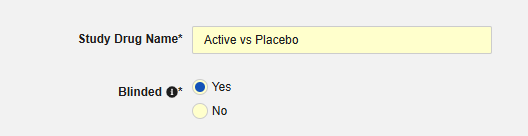
- 填写研究药物名称(Study Drug Name)。重要信息:该值通常需与目标安全系统中的药物名称完全一致。请查阅目标安全系统的文档,确认其对 E2B 中 G.* 位置研究药物传输的处理要求。
-
说明该研究药物在试验中是否设盲。此属性仅作为标识,用于报告用途。即使 EDC 中对数据设置了限制,所有传输至安全系统的数据均为非盲态。
-
(可选)选择该研究药物适用的研究设计中的受试者组(Subject Group)。设置后,未纳入该组的受试者对应的研究药物信息将不会纳入安全传输。
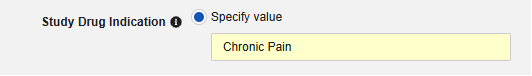
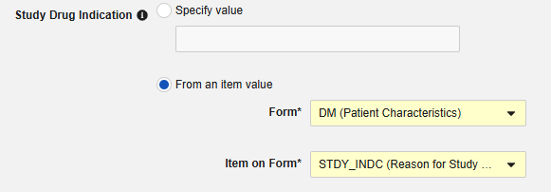
- (可选)填写适用于受试者所有病例的研究药物适应症(Study Drug Indication)。有两个选项:
- (可选)填写描述(Description)。
- 指定对应的安全关键条目/安全关键条目值。对于研究药物类型,该判定用于确定表单/用药发放记录是否具备纳入传输的资格。还需评估其他纳入标准(参阅研究药物纳入标准),以将相关的研究药物发放信息纳入安全病例。
- 单击保存或保存并进入下一步。
首次保存后,安全数据类型、表单和以下范围内的每个条目设置将变为只读状态。条目配置和纳入标准选项卡的后续配置均依赖这些设置。若需更改这些设置,必须删除当前表单配置后重新创建。
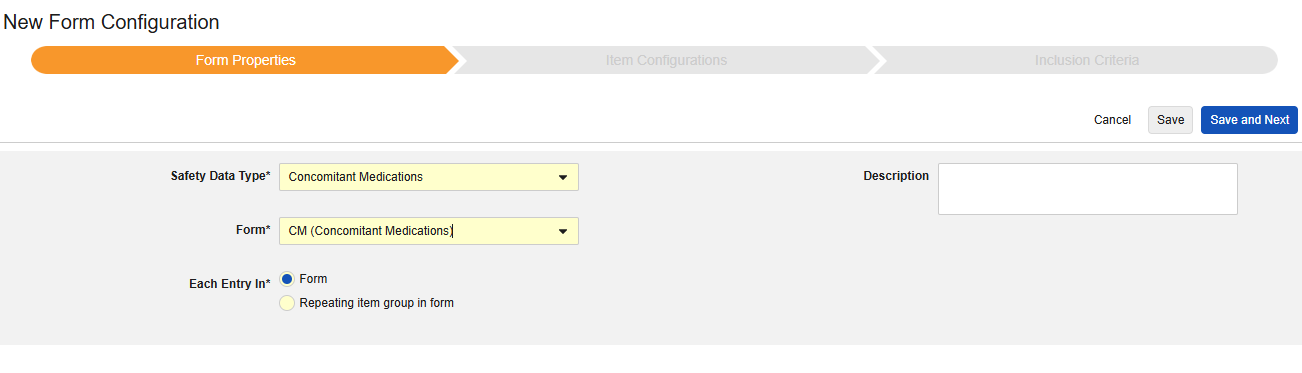
伴随用药
此类安全配置适用于研究中的伴随用药表单。相关信息将同步至安全病例的产品/药物部分。(E2B 的 G.* 部分)可以使用多个具有此类型的表单。
该类型的新安全表单配置的创建步骤如下:
- 导航到工作室 > 表单配置中的研究。
- 单击新建表单配置(New Form Configuration)按钮。
- 选择伴随用药(Concomitant Medications)作为安全数据类型。
- 选择要应用此配置类型的表单。
- 选择合适的以下范围内的每个条目选项。(取决于表单设计)。请参阅“以下范围内的每个条目 - 设计注意事项”以获取更多信息和示例。
- 注意:若选择的 EDC 表单已映射到安全病例启动事件,则以下范围内的每个条目默认设为表单中的重复条目组(Repeating item group in form)。
- (可选)填写描述(Description)。
- 单击保存或保存并进入下一步。
首次保存后,安全数据类型、表单和以下范围内的每个条目设置将变为只读状态。条目配置和纳入标准选项卡的后续配置均依赖这些设置。若需更改这些设置,必须删除当前表单配置后重新创建。
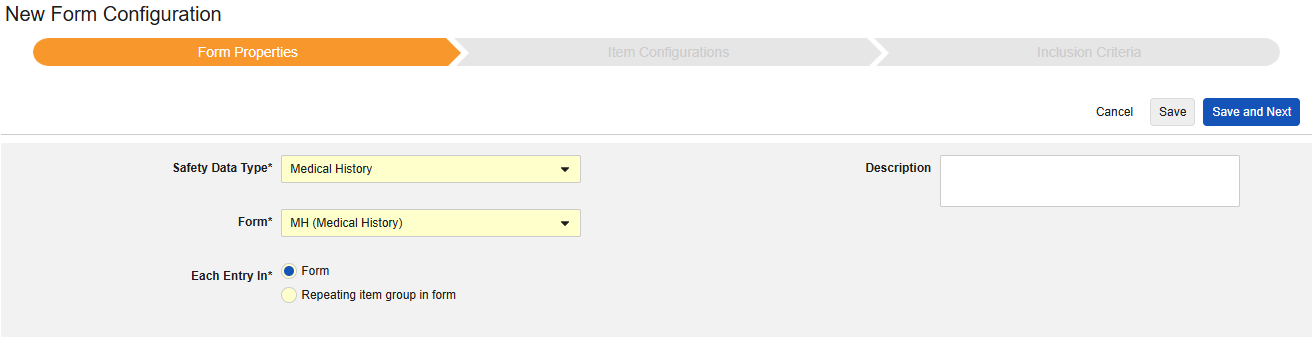
病史
此类安全配置适用于研究中的病史表单。相关信息将同步至安全病例的 E2B D.7 部分。可以使用多个具有此类型的表单。
该类型的新安全表单配置的创建步骤如下:
- 导航到工作室 > 表单配置中的研究。
- 单击新建表单配置(New Form Configuration)按钮。
- 选择病史(Medical History)作为安全数据类型。
- 选择要应用此配置类型的表单。
- 选择合适的以下范围内的每个条目选项。(取决于表单设计)。请参阅“以下范围内的每个条目 - 设计注意事项”以获取更多信息和示例。
- 注意:若选择的 EDC 表单已映射到安全病例启动事件,则以下范围内的每个条目默认设为表单中的重复条目组(Repeating item group in form)。
- (可选)填写描述(Description)。
- 单击保存或保存并进入下一步。
首次保存后,安全数据类型、表单和以下范围内的每个条目设置将变为只读状态。条目配置和纳入标准选项卡的后续配置均依赖这些设置。若需更改这些设置,必须删除当前表单配置后重新创建。
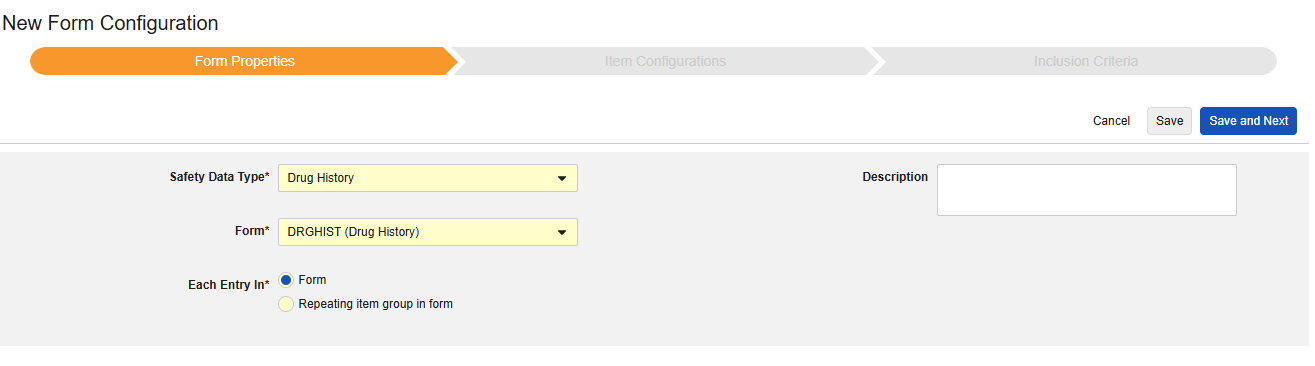
药物史
此类安全配置适用于研究中的药物史表单。相关信息将同步至安全病例的 E2B D.8 部分。
该类型的新安全表单配置的创建步骤如下:
- 导航到工作室 > 表单配置中的研究。
- 单击新建表单配置(New Form Configuration)按钮。
- 选择药物史(Drug History)作为安全数据类型。
- 选择要应用此配置类型的表单。
- 选择合适的以下范围内的每个条目选项。(取决于表单设计)。请参阅“以下范围内的每个条目 - 设计注意事项”以获取更多信息和示例。
- 注意:若选择的 EDC 表单已映射到安全病例启动事件,则以下范围内的每个条目默认设为表单中的重复条目组。
- (可选)填写描述(Description)。
- 单击保存或保存并进入下一步。
首次保存后,安全数据类型、表单和以下范围内的每个条目设置将变为只读状态。条目配置和纳入标准选项卡的后续配置均依赖这些设置。若需更改这些设置,必须删除当前表单配置后重新创建。
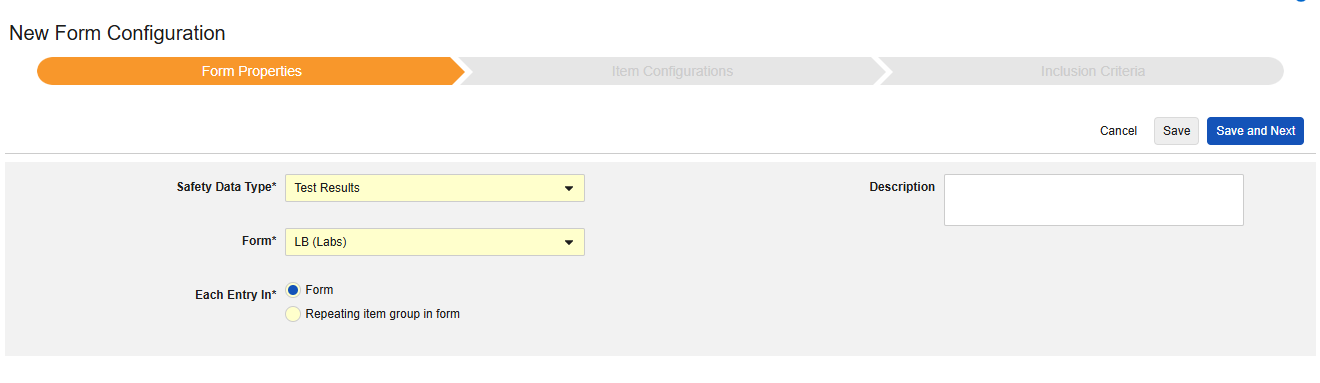
测试结果
此类安全配置适用于研究中的实验室/测试结果表单。相关信息将同步至安全病例的 E2B F.* 部分。可以使用多个具有此类型的表单。
当前系统不支持为 E2B 研究映射本地实验室模块表单(实验室面板)。
该类型的新安全表单配置的创建步骤如下:
1.导航到工作室 > 表单配置中的研究。
- 单击新建表单配置(New Form Configuration)按钮。
- 选择测试结果(Test Results)作为安全数据类型。
- 选择要应用此配置类型的表单。
- 选择合适的以下范围内的每个条目选项。(取决于表单设计)。请参阅“以下范围内的每个条目 - 设计注意事项”以获取更多信息和示例。
- 注意:若选择的 EDC 表单已映射到安全病例启动事件,则以下范围内的每个条目默认设为表单中的重复条目组(Repeating item group in form)。
- (可选)填写描述(Description)。
- 单击保存或保存并进入下一步。
首次保存后,安全数据类型、表单和以下范围内的每个条目设置将变为只读状态。条目配置和纳入标准选项卡的后续配置均依赖这些设置。若需更改这些设置,必须删除当前表单配置后重新创建。
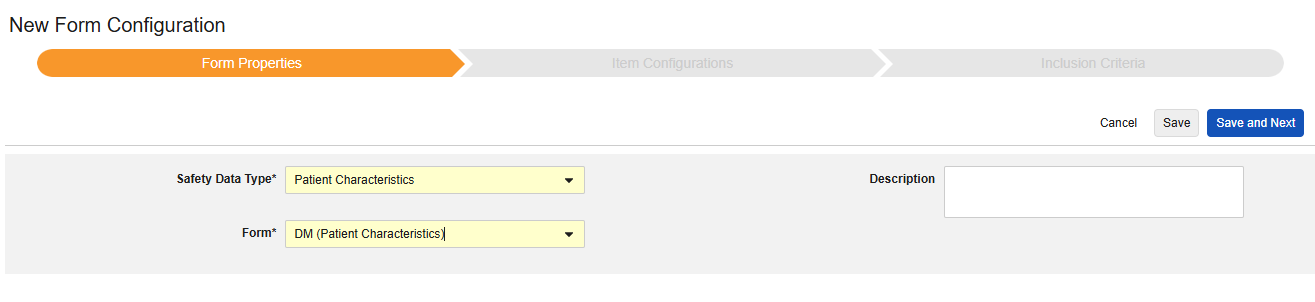
患者特征
此类安全配置适用于记录受试者一般信息的表单。此类型仅支持映射非重复条目组中的条目,且这些值在每个安全病例中仅出现一次,因此在受试者的病例手册中不得重复记录。可以使用多个具有此类型的表单(例如,一个表单记录性别,另一个表单记录出生日期)。
该类型的新安全表单配置的创建步骤如下:
1.导航到工作室 > 表单配置中的研究。
- 单击新建表单配置(New Form Configuration)按钮。
- 选择患者特征(Patient Characteristics)作为安全数据类型。
- 选择要应用此配置类型的表单。
- (可选)填写描述(Description)。
- 单击保存或保存并进入下一步。
首次保存后,安全数据类型和表单将变为只读状态。条目配置和纳入标准选项卡的后续配置均依赖这些设置。若需更改这些设置,必须删除当前表单配置后重新创建。该类型无以下范围内的每个条目选项。
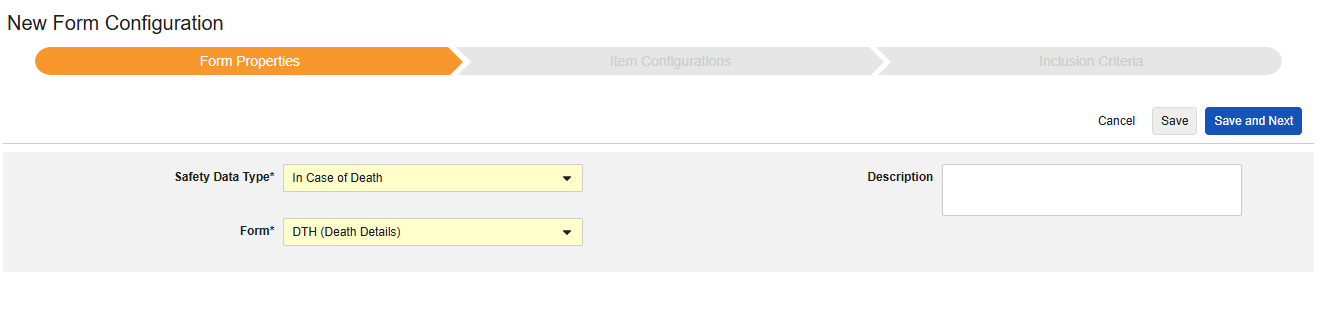
如果死亡
此类安全配置适用于记录受试者死亡详情的表单。该类型的部分字段必须为非重复型(例如死亡日期),其他字段可为重复型或非重复型(例如死亡原因)。可以使用多个具有此类型的表单(例如,一个表单记录死亡日期,另一个表单记录死亡原因)。
该类型的新安全表单配置的创建步骤如下:
1.导航到工作室 > 表单配置中的研究。
- 单击新建表单配置(New Form Configuration)按钮。
- 选择如果死亡(In Case of Death)作为安全数据类型。
- 选择要应用此配置类型的表单。
- 注意:若选择的 EDC 表单已映射到安全病例启动事件,则以下范围内的每个条目默认设为表单。
- (可选)填写描述(Description)。
- 单击保存或保存并进入下一步。
首次保存后,安全数据类型和表单将变为只读状态。条目配置和纳入标准选项卡的后续配置均依赖这些设置。若需更改这些设置,必须删除当前表单配置后重新创建。该类型无以下范围内的每个条目选项。
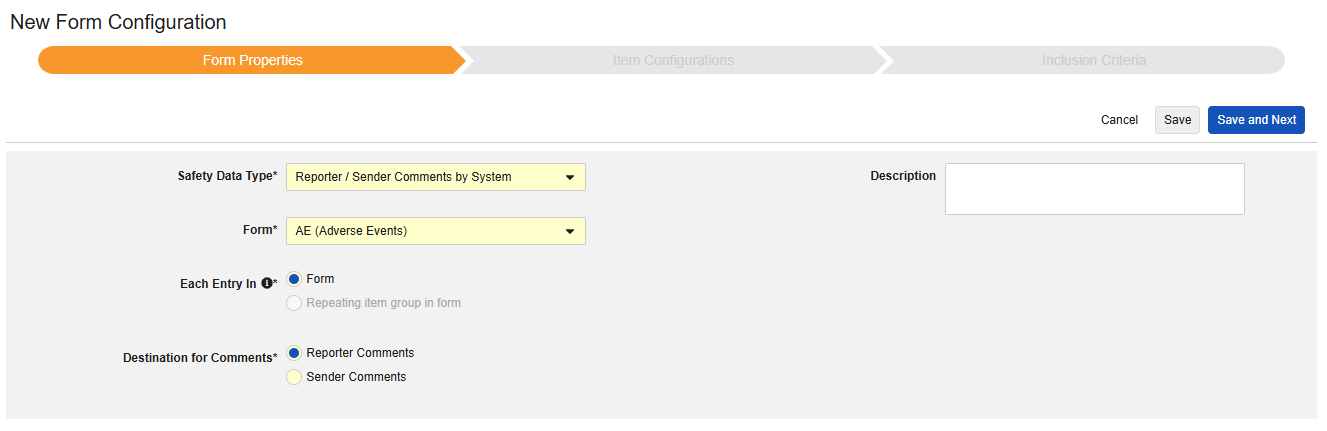
按系统划分的报告者/发送者评论
该安全配置类型可应用于病例手册中的任意表单。按系统划分的报告者/发送者评论功能专为传输 E2B 格式中无对应位置的数据而设计。
该类型的新安全表单配置的创建步骤如下:
- 导航到工作室 > 表单配置中的研究。
- 单击新建表单配置(New Form Configuration)按钮。
- 选择按系统划分的报告者/发送者评论(Reporter / Sender Comments by System)作为安全数据类型。
- 选择要应用此配置类型的表单。
- (可选)填写描述(Description)。
- 选择评论目标(Destination for Comments)。选择报告者评论(Reporter Comments)时,信息将传输至 E2B H.2 位置。选择发送者评论(Sender Comments)时,信息将传输至 E2B H.4 位置。也可将 H.2 和 H.4 配置至“安全病例启动事件”表单中的某个条目,此时研究中心录入的信息将优先于系统生成的信息,且两者可明确区分
. - 单击保存或保存并进入下一步。
首次保存后,安全数据类型和表单将变为只读状态。条目配置和纳入标准选项卡的后续配置均依赖这些设置。若需更改这些设置,必须删除当前表单配置后重新创建。该类型无以下范围内的每个条目选项。
条目配置
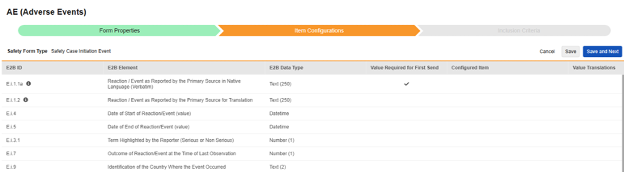
安全表单配置的第二步是条目配置选项卡。以下以不良事件(AE)表单设计为例,该表单已被归类为安全病例启动事件类型:
此表格的用途是将表单设计(条目定义)中对应的答案分配至 E2B 格式的对应位置。
表格中各列的摘要:
| 列 | 备注 |
|---|---|
| E2B ID | E2B(R3)格式中的位置 |
| E2B 元素 | E2B 位置标签 |
| E2B 条目类型 | 该 E2B 位置对应的数据类型。
|
| 首次发送时所需的值 |
|
| 配置条目 |
使用表单中的重复条目组时,需确保构成一条记录的所有条目定义(如病史、实验室数据等)均位于同一重复条目组中。部分 E2B 位置可能位于同一重复条目组外,但这种情况属于特例,参见本节后续按类型划分的详细信息以了解这些特殊情况。 |
| 值转换 |
|
值转换
每当映射到 E2B 位置的条目定义是代码列表或布尔值(复选框)数据类型,并且 E2B 位置需要非常特定的 E2B 值时,必须设置值转换(Value Translations)以确保传输正常工作。
- 在配置条目(Configured Item)列中指定条目定义。
- 对于每个代码列表或布尔类型条目,在自由文本字段中输入 E2B XML 值。
- 若代码列表代码本身对该 E2B 位置有效,无需重复输入 E2B XML 值。
- 如果研究设计中的代码列表条目多于可用 E2B 选项,则可以将多个代码列表条目映射到同一 E2B XML 值。
- 如果无效的代码列表代码未转换为 E2B XML 值,则工作室的验证作业将提示错误。
- 完成后,单击保存(Save)。
- 一旦指定了值转换,配置的转换数量将在单元格中指示。
转换值在此操作后仅被暂时保存。随后在选项卡级别使用保存或保存并进入下一步将保存这些转换。
对所有需要特定值的 E2B l位置重复上述操作(根据其各自的标准)。若存在缺失或对目标 E2B 位置无效的映射,工作室验证作业将提示错误(阻止部署)。已知/要求严格 E2B 值的字段均适用此规则,但药物或测试结果单位除外。即使是行业标准单位,目标安全系统通常也可能需要特殊配置才能接收值,因此工作室验证作业对单位类位置仅会提示警告(在每次运行时)。
按安全数据类型
安全病例启动事件
为此安全类型保存条目配置的操作步骤如下:
条目选择的选项通常取决于先前保存的表单属性 > 以下范围内的每个条目设置。一些 E2B 位置有特殊规则,表明它们只能在重复或非重复条目组中配置,或者有时两者都可以。请参阅这些步骤末尾的表格以了解这些特殊情况,以及有关此类型所有 E2B 位置的重要说明。
- 导航到工作室 > 表单配置中的研究
-
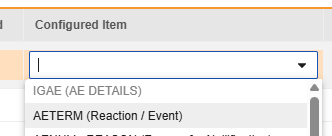
对于需映射的每一行,在配置条目列的单元格中,选择表单定义中对应的条目定义。例如,为 E2B 位置 E.i.1.1a 选择表单中的 AETERM 条目。
-
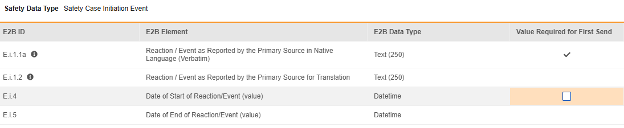
对于每个已配置的条目,指示是否首次发送时所需的值(Value Required for First Send)。E.i.1.1a 不可编辑(已勾选),因为所有安全系统均要求至少有一个非空术语/值的事件。其他行/E2B 位置通常不设置此属性,默认不勾选。
- 根据所选条目的条目定义类型及该行的 E2B ID,能需要值转换。请参阅此处设置值转换的概述。
- 单击保存(留在当前页面)或保存并进入下一步(进入下一个纳入标准选项卡)
| E2B ID | E2B 标签 | E2B 类型 | 备注 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| E.i.1.1a | 按本机语言的主要源报告的反应/事件(逐字术语) | 文本(250) |
|
||||||||||||||
| (E.i.2.1a) | 反应/事件对应的 MedDRA 版本 |
|
|||||||||||||||
| (E.i.2.1b) | 反应/事件(MedDRA 编码) |
|
|||||||||||||||
| E.i.1.2 | 主要来源以翻译语言报告的反应/事件 | 文本(250) |
|
||||||||||||||
| E.i.4 | 反应/事件的开始日期(值) | 日期时间 |
|
||||||||||||||
| E.i.5 | 反应/事件的结束日期(值) | 日期时间 |
|
||||||||||||||
| E.i.3.1 | 报告者重点标注的术语(严重或非严重) | 数字(1) |
|
||||||||||||||
| E.i.7 | 最后一次观察时的反应/事件的结果 | 数字(1) |
|
||||||||||||||
| E.i.9 | 发生事件的国家/地区的标识 | 文本(2) |
|
||||||||||||||
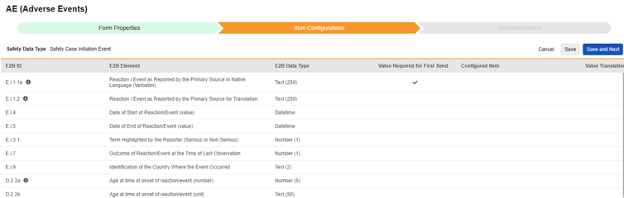
| D.2.2a | 反应/事件发作时的年龄(数字) | 数字(5) |
|
||||||||||||||
| D.2.2b | 反应/事件发作时的年龄(单位) | 文本(50) |
|
||||||||||||||
| D.3 | 体重(kg) | 数字(6) |
|
||||||||||||||
| D.4 | 身高(cm) | 数字(3) |
|
||||||||||||||
| D.6 | 末次月经日期 | 日期时间 |
|
||||||||||||||
| E.i.3.2a | 导致死亡(严重性标准) | 布尔值 |
|
||||||||||||||
| E.i.3.2b | 危及生命(严重性标准) | 布尔值 |
|
||||||||||||||
| E.i.3.2c | 导致/延长住院(严重性标准) | 布尔值 |
|
||||||||||||||
| E.i.3.2d | 致残/导致能力丧失(严重性标准) | 布尔值 |
|
||||||||||||||
| E.i.3.2e | 先天性异常/出生缺陷(严重性标准) | 布尔值 |
|
||||||||||||||
| E.i.3.2f | 其他医学重要状况(严重性标准) | 布尔值 |
|
||||||||||||||
| H.1 | 病例叙述,包括临床过程、治疗措施、结局和其他相关信息 | 文本(100000) |
|
||||||||||||||
| H.2 | 报告者的评论 | 文本(20000) |
|
||||||||||||||
| H.4 | 发送者的评论 | 文本(20000) |
|
||||||||||||||
| C.1.11.2 | 无效/修订原因 | 文本(2000) |
|
||||||||||||||
| E.i.6a | 反应/事件的持续时间(值) | 数字(5) |
|
||||||||||||||
| E.i.6b | 反应/事件的持续时间(单位) | 文本(50) |
|
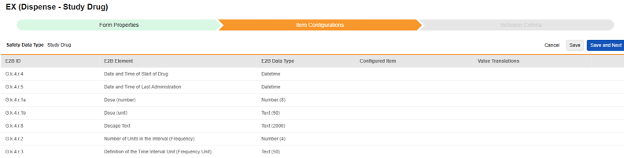
研究药物
目前,研究药物的名称(G.k.2.2)在工作室的表单属性选项卡中配置。未来版本将支持药物名称的条目配置。重要的G.k.1(药物分类)不是在此类型的 EDC 表单上映射的条目。相反,当在事件开始日期或之前至少存在一个分发表单时,系统会将其设置为可疑(E2B 值 1)。如果没有任何分发记录,系统将使用未给药(E2B 值 4)。
为此安全类型保存条目配置的操作步骤如下:
- 导航到工作室 > 表单配置中的研究
-
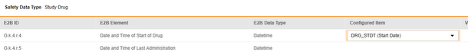
对于需映射的每一行,在配置条目列的单元格中,选择表单定义中对应的条目定义。例如,为 E2B 位置 G.k.4.r.4 选择表单中的 DRG_STDT 条目。
- 根据所选条目的条目定义类型及该行的 E2B ID,能需要值转换。请参阅此处设置值转换的概述。
- 单击保存(留在当前页面)或保存并进入下一步(进入下一个纳入标准选项卡)
条目选择的选项通常取决于先前保存的表单属性 > 以下范围内的每个条目设置。一些 E2B 位置有特殊规则,表明它们只能在重复或非重复条目组中配置,或者有时两者都可以。请参阅这些步骤末尾的表格以了解这些特殊情况,以及有关此类型所有 E2B 位置的重要说明。
该类型包含三个与研究药物相关的重要因果关系问题(G.k.8 / G.k.9.i.2.r.3 / G.k.9.i.4),涉及研究药物与安全病例及病例中事件的关联关系。用于映射这些条目定义的选择来源于映射到安全病例启动事件的 EDC 表单。这是因为这些问题的答案因病例、事件而异,必须在事件表单上回答。
| E2B ID | E2B 标签 | E2B 类型 | 备注 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| G.k.4.r.4 | 药物开始的日期和时间 | 日期时间 |
|
||||||||||||||||||||||||
| G.k.4.r.5 | 上次给药的日期和时间 | 日期时间 |
|
||||||||||||||||||||||||
| G.k.4.r.1a | 剂量(数字) | 数字(8) |
|
||||||||||||||||||||||||
| G.k.4.r.1b | 剂量(单位) | 文本(50) |
|
||||||||||||||||||||||||
| G.k.4.r.8 | 剂量文本 | 文本(2000) |
|
||||||||||||||||||||||||
| G.k.4.r.2 | 间隔内的单位数(频率) | 数字(4) |
|
||||||||||||||||||||||||
| G.k.4.r.3 | 时间间隔单位的定义(频率单位) | 文本(50) |
|
||||||||||||||||||||||||
| G.k.2.4 | 获得药物的国家/地区的标识 | 文本(2) |
|
||||||||||||||||||||||||
| G.k.4.r.10.1 | 给药途径(自由文本) | 文本(60) |
|
||||||||||||||||||||||||
| G.k.4.r.10.2a | 给药途径术语 ID 版本日期/编号 | 根据 ISO IDMP | |||||||||||||||||||||||||
| G.k.4.r.10.2b | 给药途径术语 ID | 数字(3) |
|
||||||||||||||||||||||||
| G.k.8 | 对药物采取的行动 | 数字(1) |
|
||||||||||||||||||||||||
| G.k.9.i.2.r.3 | 评估结果 | 文本(60) |
|
||||||||||||||||||||||||
| G.k.9.i.4 | 再次给药后反应是否复发? | 数字(1) |
|
||||||||||||||||||||||||
| G.k.10.r | 关于药物的其他信息(编码)(必要时重复) | 数字(2) |
|
||||||||||||||||||||||||
| G.k.11 | 关于药物的其他信息(自由文本) | 文本(2000) |
|
||||||||||||||||||||||||
| G.k.7.r.1 | 主要来源报告的适应症 | 文本(250) |
|
||||||||||||||||||||||||
| G.k.2.3.r.3a | 规格(数字) | 数字(10) |
|
||||||||||||||||||||||||
| G.k.2.3.r.3b | 规格(单位) | 文本(50) |
|
||||||||||||||||||||||||
| G.k.4.r.6a | 药物给药持续时间(数字) | 数字(5) |
|
||||||||||||||||||||||||
| G.k.4.r.6b | 药物给药持续时间(单位) | 文本(50) |
|
||||||||||||||||||||||||
| G.k.4.r.7 | 批次/批号(Batch / Lot Number) | 文本(35) | |||||||||||||||||||||||||
| G.k.4.r.9.2a | 药物剂型术语 ID 版本日期/编号 | 根据 ISO IDMP | |||||||||||||||||||||||||
| G.k.4.r.9.2b | 药物剂型术语 ID | 根据 ISO IDMP | |||||||||||||||||||||||||
| G.k.5a | 首次反应前的累积剂量(数字) | 数字(10) |
|
||||||||||||||||||||||||
| G.k.5b | 首次反应前的累积剂量(单位) | 文本(50) |
|
||||||||||||||||||||||||
| G.k.6a | 暴露时的妊娠期(数字) | 数字(3) | |||||||||||||||||||||||||
| G.k.6b | 暴露时的妊娠期(单位) | 文本(50) |
|
伴随用药
为此安全类型保存条目配置的操作步骤如下:
- 导航到工作室 > 表单配置中的研究
-
对于需映射的每一行,在配置条目列的单元格中,选择表单定义中对应的条目定义。例如,为 E2B 位置 G.k.2.2 选择表单中的 CMTRT 条目。
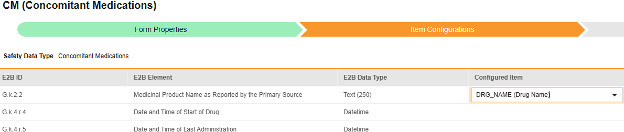
- 根据所选条目的条目定义类型及该行的 E2B ID,能需要值转换。请参阅此处设置值转换的概述。
- 单击保存(留在当前页面)或保存并进入下一步(进入下一个纳入标准选项卡)
条目选择的选项通常取决于先前保存的表单属性 > 以下范围内的每个条目设置。一些 E2B 位置有特殊规则,表明它们只能在重复或非重复条目组中配置,或者有时两者都可以。
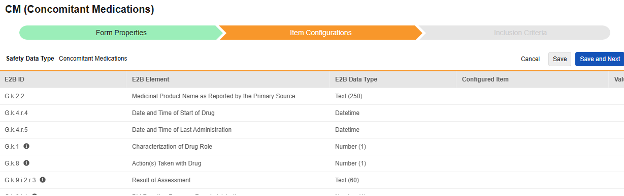
此外,还有三个与伴随用药相关的重要因果关系问题(G.k.1 / G.k.8 / G.k.9.i.2.r.3 / G.k.9.i.4),涉及伴随用药与安全病例及病例中事件的关联关系。这些问题的条目定义映射选项源自映射至安全病例启动事件的 EDC 表单,且仅能选择该表单中包含“条目至表单链接”类型条目定义。这是因为这些问题的答案因病例、事件而异,因为研究中心会链接到相关的药物。请参阅这些步骤末尾的表格以了解这些特殊情况,以及有关此类型所有 E2B 位置的重要说明。
| E2B ID | E2B 标签 | E2B 类型 | 备注 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| G.k.2.2 | 主要来源报告的医药产品名称 | 文本(250) |
|
||||||||||||||||||||||||
| G.k.4.r.4 | 药物开始的日期和时间 | 日期时间 |
|
||||||||||||||||||||||||
| G.k.4.r.5 | 上次给药的日期和时间 | 日期时间 |
|
||||||||||||||||||||||||
| G.k.1 | 药物角色的表征 | 数字(1) |
|
||||||||||||||||||||||||
| G.k.8 | 对药物采取的行动 | 数字(1) |
|
||||||||||||||||||||||||
| G.k.9.i.2.r.3 | 评估结果 | 文本(60) |
|
||||||||||||||||||||||||
| G.k.9.i.4 | 再次给药后反应是否复发? | 数字(1) |
|
||||||||||||||||||||||||
| G.k.4.r.1a | 剂量(数字) | 数字(8) |
|
||||||||||||||||||||||||
| G.k.4.r.1b | 剂量(单位) | 文本(50) |
|
||||||||||||||||||||||||
| G.k.4.r.8 | 剂量文本 | 文本(2000) |
|
||||||||||||||||||||||||
| G.k.4.r.2 | 间隔内的单位数(频率) | 数字(4) |
|
||||||||||||||||||||||||
| G.k.4.r.3 | 时间间隔单位的定义(频率单位) | 文本(50) |
|
||||||||||||||||||||||||
| G.k.2.4 | 获得药物的国家/地区的标识 | 文本(2) |
|
||||||||||||||||||||||||
| G.k.4.r.10.1 | 给药途径(自由文本) | 文本(60) |
|
||||||||||||||||||||||||
| G.k.4.r.10.2a | 给药途径术语 ID 版本日期/编号 | 根据 ISO IDMP | |||||||||||||||||||||||||
| G.k.4.r.10.2b | 给药途径术语 ID | 数字(3) |
|
||||||||||||||||||||||||
| G.k.10.r | 关于药物的其他信息(编码)(必要时重复) | 数字(2) |
|
||||||||||||||||||||||||
| G.k.11 | 关于药物的其他信息(自由文本) | 文本(2000) |
|
||||||||||||||||||||||||
| G.k.7.r.1 | 主要来源报告的适应症 | 文本(250) | |||||||||||||||||||||||||
| G.k.2.3.r.3a | 规格(数字) | 数字(10) |
|
||||||||||||||||||||||||
| G.k.2.3.r.3b | 规格(单位) | 文本(50) |
|
||||||||||||||||||||||||
| G.k.4.r.6a | 药物给药持续时间(数字) | 数字(5) |
|
||||||||||||||||||||||||
| G.k.4.r.6b | 药物给药持续时间(单位) | 文本(50) |
|
||||||||||||||||||||||||
| G.k.4.r.7 | 批次/批号(Batch / Lot Number) | 文本(35) | |||||||||||||||||||||||||
| G.k.4.r.9.1 | 药物剂型(自由文本) | 文本(60) | |||||||||||||||||||||||||
| G.k.5a | 首次反应前的累积剂量(数字) | 数字(10) |
|
||||||||||||||||||||||||
| G.k.5b | 首次反应前的累积剂量(单位) | 文本(50) |
|
||||||||||||||||||||||||
| G.k.6a | 暴露时的妊娠期(数字) | 数字(3) | |||||||||||||||||||||||||
| G.k.6b | 暴露时的妊娠期(单位) | 文本(50) |
|
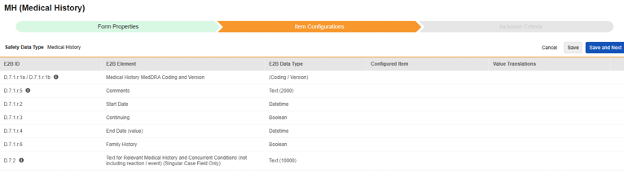
病史
为此安全类型保存条目配置的操作步骤如下:
- 导航到工作室 > 表单配置中的研究
-
对于需映射的每一行,在配置条目列的单元格中,选择表单定义中对应的条目定义。例如,为 E2B 位置 D.7.r.1.5 选择表单中的 MHTERM 条目。

- 根据所选条目的条目定义类型及该行的 E2B ID,能需要值转换。请参阅设置值转换的概述。
- 单击保存(留在当前页面)或保存并进入下一步(进入下一个纳入标准选项卡)。
条目选择的选项通常取决于先前保存的表单属性 > 以下范围内的每个条目设置。一些 E2B 位置有特殊规则,表明它们只能在重复或非重复条目组中配置,或者有时两者都可以。请参阅这些步骤末尾的表格以了解这些特殊情况,以及有关此类型所有 E2B 位置的重要说明。
| E2B ID | E2B 标签 | E2B 类型 | 备注 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| D.7.1.r.1a / D.7.1.r.1b | 病史 MedDRA 编码和版本 | (编码/版本) |
|
||||||||||||
| D.7.1.r.5 | 备注 | 文本(2000) |
|
||||||||||||
| D.7.1.r.2 | 开始日期 | 日期时间 |
|
||||||||||||
| D.7.1.r.3 | 继续 | 布尔值(或 NullFlavor) |
|
||||||||||||
| D.7.1.r.4 | 结束日期(值) | 日期时间 |
|
||||||||||||
| D.7.1.r.6 | 家族史 | 布尔值 | |||||||||||||
| D.7.2 | 相关病史和并发症的文本(不含反应/事件)(仅单个病例字段) | 文本(10000) |
|
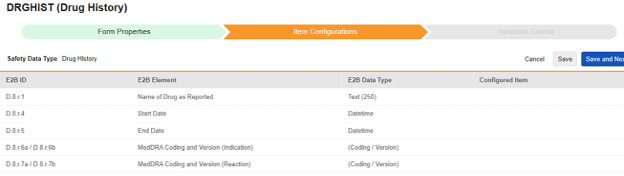
药物史
为此安全类型保存条目配置的操作步骤如下:
- 导航到工作室 > 表单配置中的研究
-
对于需映射的每一行,在配置条目列的单元格中,选择表单定义中对应的条目定义。例如,为 E2B 位置 D.8.r.1 选择表单中的 HIST_DRG_NAME 条目。
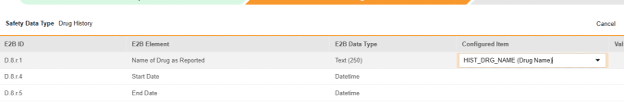
- 根据所选条目的条目定义类型及该行的 E2B ID,能需要值转换。请参阅设置值转换的概述。
- 单击保存(留在当前页面)或保存并进入下一步(进入下一个纳入标准选项卡)
条目选择的选项通常取决于先前保存的表单属性 > 以下范围内的每个条目设置。一些 E2B 位置有特殊规则,表明它们只能在重复或非重复条目组中配置,或者有时两者都可以。请参阅这些步骤末尾的表格以了解这些特殊情况,以及有关此类型所有 E2B 位置的重要说明。
| E2B ID | E2B 标签 | E2B 类型 | 备注 |
|---|---|---|---|
| D.8.r.1 | 报告的药物名称 | 文本(250) |
|
| D.8.r.4 | 开始日期 | 日期时间 |
|
| D.8.r.5 | 结束日期(End Date) | 日期时间 |
|
| D.8.r.6a/D.8.r.6b | MedDRA 编码和版本(适应症) | (编码/版本) |
|
| D.8.r.7a/D.8.r.7b | MedDRA 编码和版本(反应) | (编码/版本) |
|
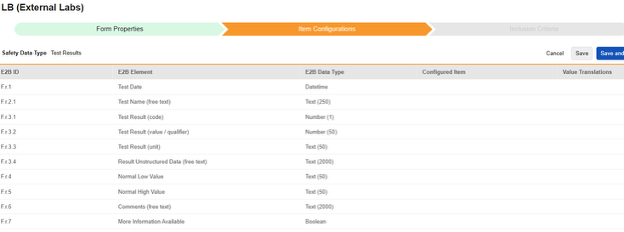
测试结果
为此安全类型保存条目配置的操作步骤如下:
- 导航到工作室 > 表单配置中的研究
-
对于需映射的每一行,在配置条目列的单元格中,选择表单定义中对应的条目定义。例如,为 E2B 位置 F.r.1 选择表单中的 LBDT 条目。
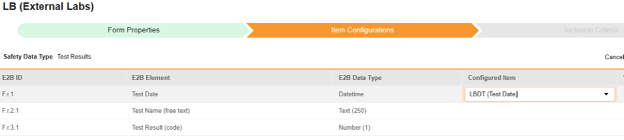
- 根据所选条目的条目定义类型及该行的 E2B ID,能需要值转换。请参阅设置值转换的概述。
- 单击保存(留在当前页面)或保存并进入下一步(进入下一个纳入标准选项卡)。
条目选择的选项通常取决于先前保存的表单属性 > 以下范围内的每个条目设置。一些 E2B 位置有特殊规则,表明它们只能在重复或非重复条目组中配置,或者有时两者都可以。请参阅这些步骤末尾的表格以了解这些特殊情况,以及有关此类型所有 E2B 位置的重要说明。
| E2B ID | E2B 标签 | E2B 类型 | 备注 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| F.r.1 | 检查日期(Test Date) | 日期时间 |
|
||||||||||
| F.r.2.1 | 测试名称(自由文本) | 文本(250) |
|
||||||||||
| (F.r.2.2a) | 测试名称对应的 MedDRA 版本 |
|
|||||||||||
| (F.r.2.2b) | 测试名称(MedDRA 编码) |
|
|||||||||||
| F.r.3.1 | 测试结果(编码) | 数字(1) |
|
||||||||||
| F.r.3.2 | 测试结果(值/限定符) | 数字(50) |
|
||||||||||
| F.r.3.3 | 测试结果(单位) | 文本(50) |
|
||||||||||
| F.r.3.4 | 结果非结构化数据(自由文本) | 文本(2000) |
|
||||||||||
| F.r.4 | 正常值下限 | 文本(50) | |||||||||||
| F.r.5 | 正常值上限 | 文本(50) | |||||||||||
| F.r.6 | 注释(自由文本) | 文本(2000) | |||||||||||
| F.r.7 | 提供更多信息(More Information Available) | 布尔值 |
|
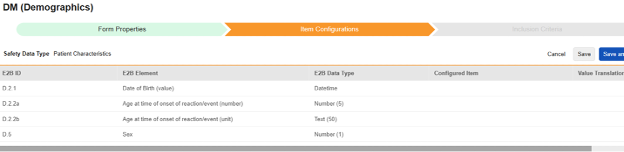
患者特征
该类型仅支持选择非重复条目组中的条目。
为此安全类型保存条目配置的操作步骤如下:
- 导航到工作室 > 表单配置中的研究
-
对于需映射的每一行,在配置条目列的单元格中,选择表单定义中对应的条目定义。例如,为 E2B 位置 D.2.1 选择表单中的 DOB 条目。
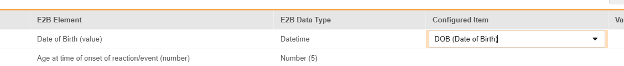
- 根据所选条目的条目定义类型及该行的 E2B ID,能需要值转换。请参阅设置值转换的概述。
- 单击保存(留在当前页面)或保存并进入下一步(进入下一个纳入标准选项卡)
| E2B ID | E2B 标签 | E2B 类型 | 备注 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| D.2.1 | 出生日期(值) | 日期时间 |
|
||||||||||||||
| D.2.2a | 反应/事件发作时的年龄(数字) | 数字(5) |
|
||||||||||||||
| D.2.2b | 反应/事件发作时的年龄(单位) | 文本(50) |
|
||||||||||||||
| D.5 | 性别 | 数字(1)(或 NullFlavor) |
|
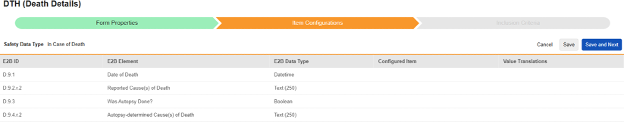
如果死亡
该类型的条目选择因 E2B ID 而异。若某值在病例中仅能使用一次,仅显示非重复条目组中的条目。若允许多个值,将显示重复或非重复位置中的选项。
为此安全类型保存条目配置的操作步骤如下:
- 导航到工作室 > 表单配置中的研究
-
对于需映射的每一行,在配置条目列的单元格中,选择表单定义中对应的条目定义。例如,为 E2B 位置 D.9.1 选择表单中的 DTHDT 条目。
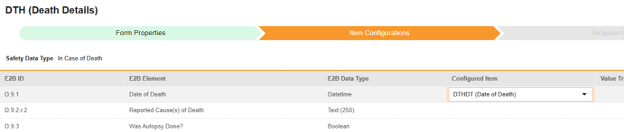
- 根据所选条目的条目定义类型及该行的 E2B ID,能需要值转换。请参阅设置值转换的概述。
- 单击保存(留在当前页面)或保存并进入下一步(进入下一个纳入标准选项卡)。
| E2B ID | E2B 标签 | E2B 类型 | 备注 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| D.9.1 | 死亡日期(Date of Death) | 日期时间 |
|
||||||||||||
| D.9.2.r.2 | 报告的死因 | 文本(250) |
|
||||||||||||
| (D.9.2.r.1a) | 报告的死因对应的 MedDRA 版本 |
|
|||||||||||||
| (D.9.2.r.1b) | 报告的死因(MedDRA 编码) |
|
|||||||||||||
| D.9.3 | 是否进行了尸检? | 布尔值(或 NullFlavor) |
|
||||||||||||
| D.9.4.r.2 | 尸检确定的死因 | 文本(250) |
|
||||||||||||
| (D.9.4.r.1a) | 尸检确定的死因对应的 MedDRA 版本 |
|
|||||||||||||
| (D.9.4.r.1b) | 尸检确定的死因(MedDRA 编码) |
|
按系统划分的报告者/发送者评论
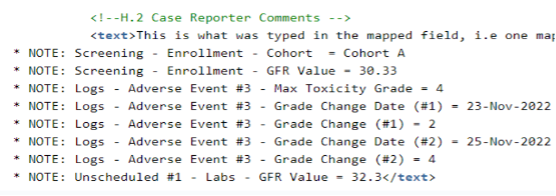
按系统划分的报告者/发送者评论支持将非 E2B 链接的 EDC 条目值配置为显示在报告者评论( H.2)或发送者评论(H.4)中,通过 E2B XML 传输。映射的条目值将以标准化注释的形式列在“评论”字段中,并追加至任何实际的“报告者评论”或“发送者评论”文本后。
配置标准化注释的方式:从表单中选择一个(或多个)项目,将其列示并追加至报告者评论(H.2)或 发送者评论(H.4)。
也可选择重复条目组、表单或事件纳入传输。当重复信息准备通过报告者评论或发送者评论传输时,每个列表条目将标注序列号,以便唯一追溯传输的数据。
已映射至其他安全数据类型的表单和条目可额外映射至 报告者评论或发送者评论。
以下示例中,关键实验室值、群组、毒性等级及毒性等级变化已被选择纳入传输。
请注意,额外的项目符号信息将追加至实际的报告者评论后,而这些报告者评论已映射至 H.2。
备注:
- 代码列表标签被列出
- 日期/日期时间按研究中心用户录入的格式显示
- 如果项目尚未输入,则列出“无值”
若额外选择的条目超出 H.2 或 H.4 字段的字符限制,追加信息将在最多 19,975 字符处截断。
示例 1:
不良事件表单通常会追踪不符合 E2B 格式、无法直接传输的数据。此 CTCAE 等级(CTCAE Grade)字段出现在不良事件表单上:
通过该类型,仅需简单选择即可将其纳入报告者评论或发送者评论字段:
每次纳入都会在 E2B 文件的报告者评论(或发送者评论)中生成一个格式化的项目符号。
示例 2:
包含此类字段的表单也可为未被其他类型使用的表单。关键入组详细信息可能对安全系统有用。可选择注册表单,将随机化编号、入组原因、群组等信息纳入报告者评论或发送者评论字段:
纳入标准
纳入标准经过评估,用于确定在超出触发安全病例数据传输的主要事件之外,是否将已映射的条目值纳入安全病例的范围。
说明/概念:
- 仅当满足以下两个条件时,才会评估纳入标准:
- 表单属性选项卡中所有纳入标准(尤其是安全关键条目)均判定为真
- 条目配置选项卡中,必填条目在 EDC 表单中已填写非空值
- 附加条件可包括特定类型的所有表单、基于研究中心用户操作(链接)和/或基于日期比较。这些配置可因类型、具体表单和/或研究不同而有所差异。
- 纳入标准选项卡中的判定条件为“或”逻辑:只要一系列适用条件中的任何一个为“真”,即判定为“纳入”,无论其他条件是否为“假”。
- 如果配置了与安全病例启动事件的结束日期进行比较以纳入病例,但数据录入屏幕上未设置该日期,系统会将事件的结束日期视为开放式截止日期用于评估。一旦主要事件(或相关表单)输入了结束日期,系统会重新评估纳入标准,并在适当时发送更正性后续通知。
- 纳入标准适用于所有相关安全类型:
- 安全病例启动事件
- 研究药物
- 伴随用药
- 病史
- 药物史
- 测试结果
- 按系统划分的报告者/发送者评论
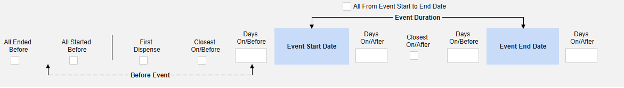
按安全类型划分的选项摘要
| 纳入标准 | 安全数据类型 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| SCIE | 研究药物 | Con Meds | Med Hist | Drug Hist | Test Res | Pat Chars | 死亡 | Rep/Sen Comm | |
| 全部 | |||||||||
| 由研究中心用户链接 | |||||||||
| 开始到结束时间与安全事件开始到结束时间重叠 | |||||||||
| 开始到结束时间与安全事件开始之前的 X 天重叠 | |||||||||
| 开始到结束时间与安全事件开始之后的 X 天重叠 | |||||||||
| 开始到结束时间与安全事件结束之前的 X 天重叠 | |||||||||
| 开始到结束时间与安全事件结束之后的 X 天重叠 | |||||||||
| 首次配药 | |||||||||
| 最接近安全事件开始日期/安全事件开始之前 | |||||||||
| 最接近安全事件开始日期/安全事件开始之后 | |||||||||
| 最接近安全事件/安全事件之前(仅限一种) | |||||||||
| 在安全事件开始前开始配药 | |||||||||
| 在安全事件开始前结束 | |||||||||
| 自动,因为是安全病例启动事件表单的一部分 | |||||||||
| 已筛选 - 如果已存在或由研究中心用户链接 | |||||||||
| 总是 | * | * | |||||||
|
表示该纳入标准适用于此安全数据类型 * 表示该纳入标准对于此安全数据类型不可修改 |
|||||||||
表头的安全数据类型缩写说明:
- SCIE:安全病例启动事件
- ConMeds:伴随用药
- Med His:病史
- Drug Hist:药物史
- Test Res:测试结果
- Pat Chars:患者特征
- 死亡:如果死亡
- Rep/Sen Comm:按系统划分的报告者/发送者评论
选项含义/示例
所有纳入标准选项总结如下。每个基于日期的选项均包含一系列示例以阐释用法。
按安全数据类型
安全病例启动事件
安全病例启动事件将是启动安全病例传输流程的主要事件。所有其他相关事件随后根据其配置的标准被纳入该病例。根据偏好和研究设计,启动事件可以包含来自启动表单的其他数据,或者与同类型的其他事件/表单相关联(但这些关联项本身不构成独立安全病例,例如,链接到启动严重事件的其他非严重事件)。
常见实际示例:
- 周一,受试者出现非严重不良事件“头痛”(AE 表单 #1)
- 周三,受试者出现非严重不良事件“头晕”(AE 表单 #2)
- 系统以周二的事件(“头晕”)作为新安全病例的主启动事件,发送安全病例。系统还根据配置的纳入标准,将周一事件的数据作为第二个事件添加到同一安全病例中。这是因为使用了当天/之前的天数 = 2(或以上)的配置。
有关每个纳入标准选项的更多详细信息和示例,请参阅上面的选项含义/示例。
为此安全类型保存纳入标准的操作步骤如下:
- 导航到工作室 > 表单配置中的研究
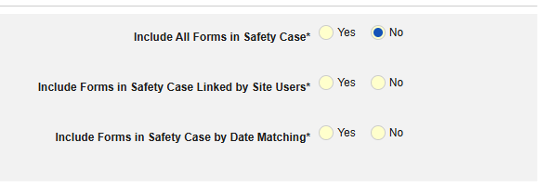
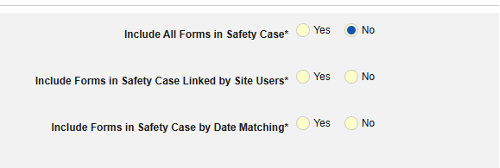
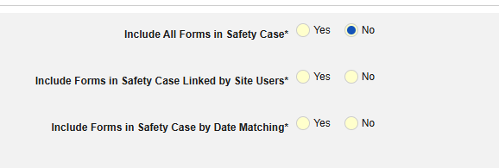
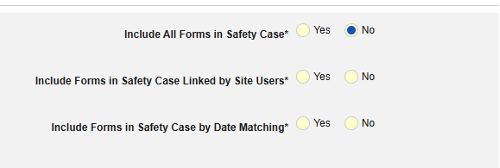
- 在安全病例中包含相关事件表单:
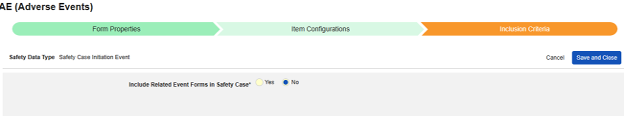
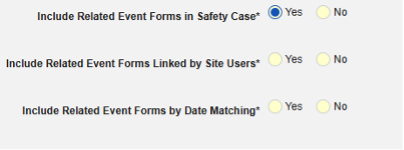
- 包括由研究中心用户链接的相关表单:如果由研究中心链接到主要启动事件的事件要纳入病例,请选择是。警告:选择是时,表单还必须配置表单至表单或条目至表单链接。
-
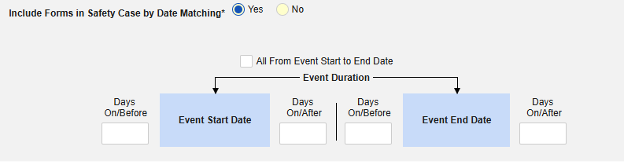
包含日期匹配的相关事件表单:如果要根据一个或多个基于日期的标准来评估是否纳入相关事件的数据,请选择是。有关每个纳入标准选项的更多详细信息和示例,请参阅上面的选项含义/示例。
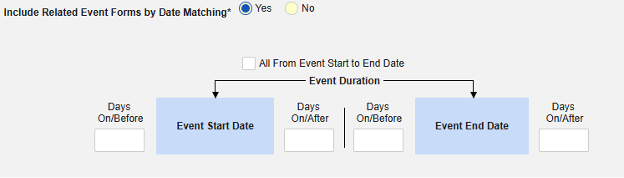
- 勾选所需选项或设置具体天数(Days)值。必须至少选择/设置其中一个选项。
- 单击保存并关闭完成配置。
研究药物
此类安全配置用于跟踪与研究药物相关的剂量/配药信息与启动事件的关系,即临床研究中用于受试者的测试药物。相关信息将同步至安全病例的产品/药物部分。(E2B 的 G.* 部分)。
实际示例:
- 3 月 1 日,受试者首次领取研究药物活性药物与安慰剂(设盲研究药物)
- 3 月 3 日,受试者再次领取药物
- 3 月 5 日,受试者再次领取药物
- 3 月 6 日,受试者出现严重不良事件(“头晕”),研究中心录入 AE 表单
- 系统以“头晕”作为主要事件创建并传输安全病例
- 研究配置为仅在安全病例中纳入部分配药记录。示例配置方案为:3 月 1 日(总体首次配药)和 3 月 5 日(最接近的日期/之前)。根据配置的标准,其他配药记录不纳入。
有关每个纳入标准选项的更多详细信息和示例,请参阅上面的选项含义/示例。
为此安全类型保存纳入标准的操作步骤如下:
- 导航到工作室 > 表单配置中的研究
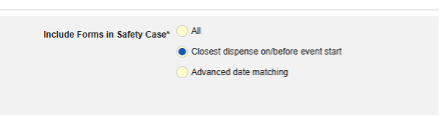
- 在安全病例中包含表单(有关每个纳入标准选项的更多详细信息和示例,请参阅上面的选项含义/示例):
- 单击保存并关闭完成配置。
伴随用药
此类安全配置适用于研究中的伴随用药表单。相关信息将同步至安全病例的产品/药物部分。(E2B 的 G.* 部分)可以使用多个具有此类型的表单。
实际示例:
- 3 月 1 日,受试者开始服用 Veeofen,每天一次,但在 3 月 3 日停药
- 3 月 3 日,受试者开始服用 Natevba,每天一次,无结束日期(仍在服用)
- 3 月 5 日,受试者服用一次 Deetoza(结束日期同为 3 月 5 日)
- 3 月 7 日,受试者出现严重不良事件(“头晕”),研究中心录入 AE 表单
- 系统以“头晕”作为主要事件创建并传输安全病例
-
研究设计规定使用以下两个规则纳入伴随用药:
- “SAE 开始时仍在持续”
- “已停止但停止时间距 SAE 开始不超过 3 天”
- 结果:3 月 3 日开始服用的 Natevba(仍在使用)和 3 月 5 日服用的 Deetoza(已停药但仅过去 2 天)均被纳入病例。3 月 1 日开始服用的另一药物阿司匹林(停药超过 3 天)未被纳入病例
有关每个纳入标准选项的更多详细信息和示例,请参阅上面的选项含义/示例。
为此安全类型保存纳入标准的操作步骤如下:
- 导航到工作室 > 表单配置中的研究
- 从以下选项中选择:
- 在安全病例中包含所有表单(默认:否):选择是,将所有当前伴随用药纳入病例,这将禁用所有其他选项。
- 包含由研究中心用户链接的相关事件表单。如果由研究中心链接到主要启动事件的伴随用药要纳入病例,请选择是。警告:选择是时,表单还必须配置表单至表单或条目至表单链接。
- 在安全病例中包含由研究中心用户链接的表单:选择是或否。警告:选择是时,表单还必须配置表单至表单或条目至表单链接。
-
按日期匹配在安全病例中包含表单:选择是或否。选择是时,系统将使用一个或多个标准来比较安全病例事件(主要事件)和相关数据(正在配置的表单,其开始和结束范围)的开始到结束范围。
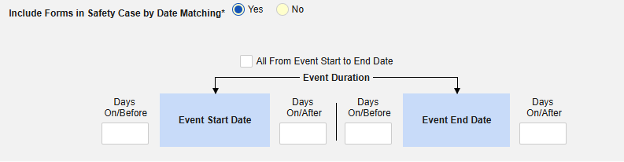
- 勾选所需选项或设置具体天数(Days)值。必须至少选择/设置其中一个选项。
- 单击保存并关闭完成配置。
有关每个纳入标准选项的更多详细信息和示例,请参阅上面的选项含义/示例。
病史
此类安全配置适用于研究中的病史表单。相关信息将同步至安全病例的 E2B D.7 部分。可以使用多个具有此类型的表单。
实际示例:
- 2024 年 1 月,受试者首次出现“轻微头晕”。病史记录为持续状态(无结束日期)
- 第二份病史记录“背痛”,开始于 2024 年 4 月,结束于 2024 年 5 月
- 第三份病史记录“偏头痛”,开始于 2024 年 6 月,结束于 2024 年 11 月
- 2025 年 3 月 7 日,受试者出现严重不良事件(“头晕”),研究中心录入 AE 表单
- 系统以“头晕”作为主要事件创建并传输安全病例
-
研究设计规定使用以下两个规则纳入病史:
- “SAE 开始时仍在持续”
- “已停止但停止时间距 SAE 开始不超过 182 天”
- 结果:“轻微头晕”(持续状态)和“偏头痛”(结束不足 1 年)均被纳入病例。另一病史“背痛”(停止超过 180 天)未被纳入病例
有关每个纳入标准选项的更多详细信息和示例,请参阅上面的选项含义/示例。
为此安全类型保存纳入标准的操作步骤如下:
- 导航到工作室 > 表单配置中的研究
- 从以下选项中选择:
- 在安全病例中包含所有表单(默认:否):选择是,将所有当前伴随用药纳入病例,这将禁用所有其他选项。
- 包含由研究中心用户链接的相关事件表单。如果由研究中心链接到主要启动事件的伴随用药要纳入病例,请选择是。警告:选择是时,表单还必须配置表单至表单或条目至表单链接。
- 在安全病例中包含由研究中心用户链接的表单:选择是或否。警告:选择是时,表单还必须配置表单至表单或条目至表单链接。
-
按日期匹配在安全病例中包含表单:选择是或否。选择是时,系统将使用一个或多个标准来比较安全病例事件(主要事件)和相关数据(正在配置的表单,其开始和结束范围)的开始到结束范围。
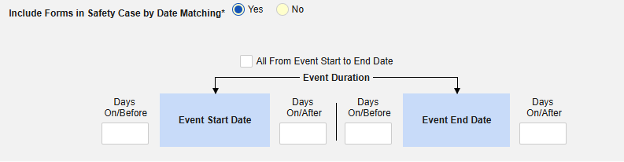
- 勾选所需选项或设置具体天数(Days)值。必须至少选择/设置其中一个选项。
- 单击保存并关闭完成配置。
有关每个纳入标准选项的更多详细信息和示例,请参阅上面的选项含义/示例。
药物史
此类安全配置适用于研究中的药物史表单。相关信息将同步至安全病例的 E2B D.8 部分。
实际示例:
- 研究设计在筛选访视时收集研究者认为合适和/或符合方案的药物史信息。这些特指在受试者进入试验之前服用(并已停药)的药物/产品。
- 2025 年 3 月 7 日,受试者出现严重不良事件(“头晕”),研究中心录入 AE 表单。
- 系统以“头晕”作为主要事件创建并传输安全病例
- 根据此安全数据类型的研究配置,所有药物史信息均需纳入该受试者的每一个安全病例。
- 也可选择使用基于日期和/或研究中心链接的选项。
有关每个纳入标准选项的更多详细信息和示例,请参阅上面的选项含义/示例。
为此安全类型保存纳入标准的操作步骤如下:
- 导航到工作室 > 表单配置中的研究
- 从以下选项中选择:
- 在安全病例中包含所有表单(默认:否):选择是,将所有当前伴随用药纳入病例,这将禁用所有其他选项。
- 包含由研究中心用户链接的相关事件表单。如果由研究中心链接到主要启动事件的伴随用药要纳入病例,请选择是。警告:选择是时,表单还必须配置表单至表单或条目至表单链接。
- 在安全病例中包含由研究中心用户链接的表单:选择是或否。警告:选择是时,表单还必须配置表单至表单或条目至表单链接。
-
按日期匹配在安全病例中包含表单:选择是或否。选择是时,系统将使用一个或多个标准来比较安全病例事件(主要事件)和相关数据(正在配置的表单,其开始和结束范围)的开始到结束范围。
- 勾选所需选项或设置具体天数(Days)值。必须至少选择/设置其中一个选项。
- 单击保存并关闭完成配置。
有关每个纳入标准选项的更多详细信息和示例,请参阅上面的选项含义/示例。
测试结果
此类安全配置适用于研究中的实验室/测试结果表单。相关信息将同步至安全病例的 E2B F.* 部分。可以使用多个具有此类型的表单。
实际示例:
- 研究设计根据研究者/研究中心的需要在日志表单上收集额外的实验室/测试结果(他们认为与严重不良事件相关的测试)。
- 2025 年 3 月 7 日,受试者出现严重不良事件(“头晕”),研究中心录入 AE 表单。
- 此外,研究中心添加了两个超出范围的实验室测试,并将每个测试链接到 AE 表单。
- 系统以“头晕”作为主要事件创建并传输安全病例
- 由于研究的安全配置规定纳入研究中心链接到事件的任何内容,因此两个测试结果都纳入病例中。
- 另外,可以使用基于日期的选项(或取而代之)。
有关每个纳入标准选项的更多详细信息和示例,请参阅上面的选项含义/示例。
为此安全类型保存纳入标准的操作步骤如下:
- 导航到工作室 > 表单配置中的研究
- 从以下选项中选择:
- 在安全病例中包含所有表单(默认:否):选择是,将所有当前伴随用药纳入病例,这将禁用所有其他选项。
- 包含由研究中心用户链接的相关事件表单。如果由研究中心链接到主要启动事件的伴随用药要纳入病例,请选择是。警告:选择是时,表单还必须配置表单至表单或条目至表单链接。
- 在安全病例中包含由研究中心用户链接的表单:选择是或否。警告:选择是时,表单还必须配置表单至表单或条目至表单链接。
-
按日期匹配在安全病例中包含表单:选择是或否。选择是时,系统将使用一个或多个标准来比较安全病例事件(主要事件)和相关数据(正在配置的表单,其开始和结束范围)的开始到结束范围。
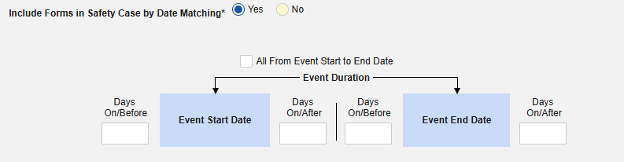
- 勾选所需选项或设置具体天数(Days)值。必须至少选择/设置其中一个选项。
- 单击保存并关闭完成配置。
有关每个纳入标准选项的更多详细信息和示例,请参阅上面的选项含义/示例。
患者特征
此类安全配置适用于记录患者一般信息的表单。此类型没有任何标准。归类为此类型的信息将纳入受试者的所有安全病例中。
当从条目配置选项卡进入纳入标准选项卡时,单击保存并进入下一步可返回表单配置列表。
如果死亡
此类安全配置适用于记录受试者死亡详情的表单。此类型没有任何标准。归类为此类型的信息将纳入受试者的所有安全病例中。
当从条目配置选项卡进入纳入标准选项卡时,单击保存并进入下一步可返回表单配置列表。
目前,每个病例都会收到此信息,即使是那些病例中没有任何事件结果为致命的病例。
按系统划分的报告者/发送者评论
该安全配置类型应用于病例手册中任意位置的表单。对于无法适配 E2B 结构中任何位置的数据,需使用该类型。
为此安全类型保存纳入标准的操作步骤如下:
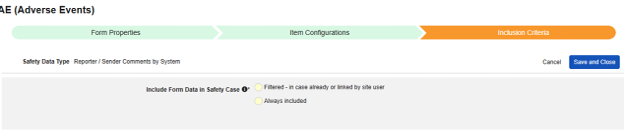
| 选项 | 含义/说明 |
|---|---|
| 已筛选 - 如果已存在或由研究中心用户链接 | 该选项包含两种可能含义:
|
| 始终包含 | 该表单设计下所有数据录入表单中的值都会以系统生成项目符号的形式纳入报告者(或发送者)评论。该选项最常用于每位受试者仅收集一次的数据。示例:
|
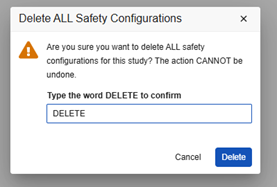
删除所有安全配置
删除研究设计的所有安全配置时请务必谨慎。此操作会将研究恢复至无任何安全配置的状态,需重新开始配置流程。
要执行此操作,开发环境的研究中必须不存在任何安全病例。若已在开发环境中创建安全病例,可以删除非生产测试数据。
上线后删除:如果下游环境(测试、培训、生产)已存在安全配置和安全病例,绝不可执行此操作。即使开发环境中的研究可删除安全病例及安全配置,后续向测试/培训/生产环境部署时也会失败。
删除研究的所有安全配置的操作步骤如下:
下载规范
你可以通过研究设计规范或所有 CRF PDF 导出来下载安全配置。当你配置了安全集成后,将生成两个附加选项卡:安全设置和安全表单配置(Safety Form Configurations)。
部署安全配置
在研究的 DEV 环境中完成配置后,你可以将其部署到 TST 进行测试,然后继续部署到培训和生产环境中。
你的安全集成配置会自动包含在研究的部署包中。部署研究时,Vault 将在包中包含当前配置。
由于此配置作为研究部署的一部分进行管理,因此你只能在 DEV 类型环境中进行更改。要进行更改,请在 DEV 环境中操作,然后将这些更改部署到其他环境。此配置作为病例手册版本发布的一部分进行验证。在验证过程中,将禁用编辑功能。可能的错误和警告列表位于此处。
了解如何部署研究。
E2B 元素参考(由系统生成)
以下表格汇总了系统生成的 E2B 元素,这些额外元素将与已配置的条目配置一同发送至安全系统的安全病例中。
| E2B ID | E2B 元素 | 数据类型 | 源 | 说明 |
|---|---|---|---|---|
| N.1.1 | 批量中的消息类型 | 数字(2) | 静态 | 对于 ICH ICSR,这始终设置为“1”。 |
| N.1.2 | 批号 | 数字(100) | 由系统生成 | 此值串联了受试者 的研究中心(ISO 两个字母编码)、EDC 系统的唯一标识符(对于该 Vault 中的所有研究 都是唯一的)、Vault 的 ID、对象记录的 ID、破折号(“-”)和病例第 N 条消息的数值(例如,“US-VAULTCDMS-110377V6800000000L003-1”)。在非生产环境中,EDC 系统标识符后面会附加“TEST”。对于消息编号,“0”为首次发送,“1”为首次跟进,依此类推。 |
| N.1.3 | 批量发送者标识符 | 文本(60) | 由系统生成 | 这是研究的传输配置文件 中指定的批量发送者标识符。这与安全系统中配置的发送者配置文件匹配。 |
| N.1.4 | 批量接收者标识符 | 文本(60) | 由系统生成 | 这是研究的传输配置文件 中指定的批量接收者标识符。这与安全系统中配置的接收者配置文件匹配。 |
| N.1.5 | 批量传输日期 | 日期时间 | 由系统生成 | Vault 创建安全消息 及其 XML 文件的完整日期和时间(基于 UTC)。 |
| N.2.r.1 | 消息标识符 | 文本(100) | 由系统生成 | 同“N.1.2”。 |
| N.2.r.2 | 消息发送者标识符 | 文本(60) | 由系统生成 | 同“N.1.3”。 |
| N.2.r.3 | 消息接收者标识符 | 文本(60) | 由系统生成 | 同“N.1.4”。 |
| N.2.r.4 | 消息创建日期 | 日期时间 | 由系统生成 | 同“N.1.5”。 |
| C.1.1 | 发送者的(病例)安全报告唯一标识符 | 文本(100) | 由系统生成 | 此值串联了受试者 的研究中心(ISO 两个字母编码)、EDC 系统的唯一标识符(对于该 Vault 中的所有研究 都是唯一的)、Vault 的 ID 和对象记录的 ID(例如,“US-VAULTCDMS-110377V6800000000L003”)。在非生产环境中,EDC 系统标识符后面会附加“TEST”。 |
| C.1.2 | 创建日期 | 日期时间 | 由系统生成 | Vault 在即将传输安全信息之前创建安全消息。此字段捕获的创建日期精确到秒,充当消息标识符。 |
| C.1.3 | 报告类型 | 数字(1) | 静态 | 对于“来自研究的报告”,这设置为“2”。 |
| C.1.4 | 首次从源收到报告的日期 | 日期时间 | 由系统生成 | 此字段捕获为 SAE 捕获所有必填字段(条目)的日期和时间。 |
| C.1.5 | 此报告的最新信息的日期 | 日期时间 | 由系统生成 | 指示在发送最后一条安全消息后,数据录入用户在给定日期所做的、涉及安全病例中的数据的第一次更改。例如,如果用户在同一日期上午 8 点先更改病史表单上的数据,然后在上午 10 点更改 SAE 表单上的数据,最后在上午 11 点链接两个伴随用药表单,所做的所有更改都是针对同一安全病例中的数据,则下一次计划传输中的 C.1.5 值将在该日期的上午 8 点。 |
| C.1.6.1 | 其他文档是否可用? | 布尔值 | 静态 | 此值始终为“false” |
| C.1.7 | 该病例是否符合加急报告的当地标准? | 布尔值 | 静态 | 此值始终为“NI”(“无信息”) |
| C.1.8.1 | 全球唯一病例识别号 | 文本(100) | 由系统生成 | 同“C.1.1”。 |
| C.1.8.2 | 此病例的首次发送者 | 数字(1) | 静态 | 对于“其他”,这始终设置为“2”。 |
| C.1.11.1 | 报告无效/修订 | 数字(1) | 由系统生成 | 如果消息类型 为“修订”,则 Vault 会将此字段设置为“2”。如果消息类型 为“无效”,则 Vault 会将此字段设置为“1”。 |
| C.2.r.1.2 | 报告者的名字 | 文本(60) | 来自研究中心 | 根据研究的“报告者(Reporter)”选项设置(安全设置),该信息将来自研究中心的主要研究者。 |
| C.2.r.1.4 | 报告者的姓氏 | 文本(60) | 来自研究中心 | 根据研究的“报告者(Reporter)”选项设置(安全设置),该信息将来自研究中心的主要研究者。 |
| C.2.r.3 | 报告者的国家/地区编码 | 文本(2) | 来自研究中心 | |
| C.2.r.5 | 用于监管目的的主要来源 | 数字(1) | 静态 | 此值始终为“1” |
| C.3.2 | 发送者的组织 | 文本(100) | 来自研究中心 | 这是研究组织 的名称(在 EDC 中为发送者)。 |
| C.5.3 | 申办方研究编号 | 文本(50) | 查找 | 若未在“研究安全设置”部分设置特定值,该字段将填充研究的名称/标签 |
| E.i.9 | 发生反应/事件的国家/地区的标识 | 文本(2) | 来自研究中心或用户 | 研究中心的研究国家/地区的 2 字符国家/地区编码。或者,可以在数据录入表单上映射,供研究中心覆盖。(例如,受试者在国外时发生的事件) |
| D.7.1.r.1a | MedDRA 病史版本 | 文本(4) | 查找 | “MedDRA”已从字符串中移除。此字段仅在已编码 或已自动编码 后发送,因为 E2B 中没有病史术语 的位置,只有编码值。 |
| D.7.1.r.1b | 病史(疾病/手术/操作/等等)(MedDRA 编码) | 数字(8) | 查找 |