配置 Safety-EDC 连接研究
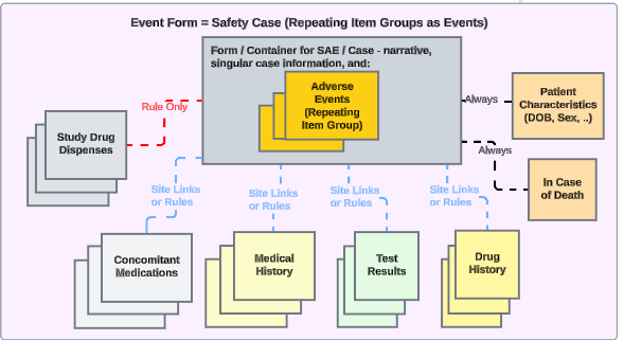
Veeva EDC 和 Veeva Safety 之间的安全集成基于 Veeva Vault 平台的专有通信交换。通过适当的集成配置,所有必需及补充的安全相关 EDC 数据会以安全病例形式发送至安全系统。触发数据传输的示例包括:临床试验中的严重不良事件、特别关注的不良事件以及意外妊娠。
通过针对研究设计的集成设置,当研究中心创建符合安全病例启动标准的事件时,Veeva EDC 会自动生成首次发送并将数据传输至安全系统。
通过将以下位置归类为安全数据类型,相关数据也可插入安全病例:
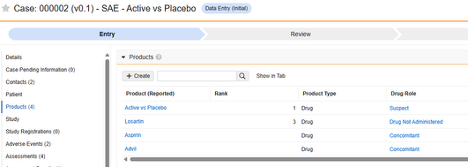
- 研究药物(临床试验中正在测试的一种或多种产品)
- 伴随用药
- 病史
- 药物史
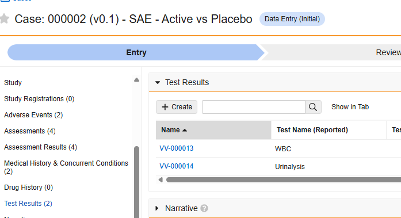
- 测试结果
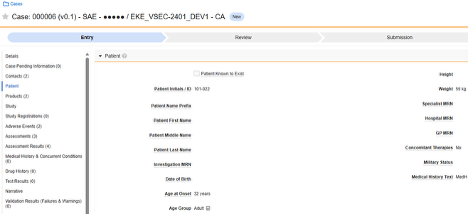
- 患者特征
- 如果死亡
若安全病例的启动数据或相关数据发生任何更新,系统将在设定的时间间隔内自动生成后续发送任务,并传输至安全系统。
研究设计者需通过将 EDC 研究设计中的条目映射至 Veeva Safety 的对应位置,完成集成配置。已映射的病例手册元素能否纳入安全病例还取决于已配置的纳入规则:可选择将映射条目纳入某一受试者的所有病例手册表单、由研究中心链接至安全病例启动表单的表单,或与启动事件相关且处于选定日期范围内的表单。
安全病例可由单个事件创建,也可整合多个事件构成,具体通过研究中心链接规则和/或基于日期的纳入规则进行配置。
安全集成还支持无效功能:当触发初始数据传输的条件不再成立时,将生成无效。例如表单重置(错误录入导致)或事件严重程度降级等场景。
Safety-EDC 连接与 E2B Link 之间的核心差异:
- Safety-EDC 连接在每次发送数据时,无需等待远程系统返回确认文件。无论该数据是否进一步升级为正式病例,Veeva EDC 都会记录其已送达 Vault Safety 的收件箱。后续若通过常规分类流程将其升级为正式安全病例,Veeva EDC 会记录该病例的位置信息。
- 除安全病例包含的实际传输数据外,一旦首次安全事件发生,所有映射至标准安全数据类型的试验参与者安全相关数据都会被发送至 Veeva Safety。这些数据可在 Veeva Safety 中作为额外受试者信息,根据安全病例处理需求予以显示。EDC 中的数据更改将同步更新 Veeva Safety 中的安全病例数据及额外受试者信息。“病例内”数据更改会生成新的后续收件箱条目,但额外受试者信息的更新将在后台执行,不会对病例造成改动。Veeva Safety 用户可通过系统中的额外受试者信息用户界面,便捷访问所有映射至标准安全数据类型但“未纳入病例”的信息,并可根据医疗决策选择保留或移除相关内容,全程无需退出系统,该选择将在 Veeva EDC 后续的传输任务中生效。
- Veeva Safety 中的操作会同步反馈至 Veeva EDC,尤其是需向研究中心和 CRA 展示的病例状态,以及在 Veeva Safety 中做出的安全决策。在 Veeva Safety 中,用户可通过简单选择将额外受试者信息添加至安全病例,也可从病例中移除相关信息。在另一种场景中,从 Veeva EDC 发送的安全病例可能包含多个事件,在 Safety 端可以拆分为单个病例,或者单个安全病例可以合并为一个。Veeva EDC 会同步记录这些在 Veeva Safety 中做出的决策。虽然 EDC 临床数据和研究中心链接决策保持不变,但在编制下一次后续发送时,会遵循在 Veeva Safety 中做出的有关添加、移除、拆分或合并的决策。
安全管理员负责设置首次发送的时间、后续发送的频率,以及集成相关的其他操作配置。请参阅“管理安全集成”中的“安全设置”,以了解详细信息。
先决条件
拥有 Vault 所有者安全配置文件的用户必须在 Veeva EDC 与 Veeva Safety 之间建立连接。
拥有标准 CDMS Study Designer(CDMS 研究设计者)或 CDMS Librarian(CDMS 库管员)研究角色的用户均可查看和编辑安全配置。如果贵组织使用自定义研究角色,则你的角色必须授予以下权限:
| 类型 | 权限标签 | 控制 |
|---|---|---|
| “标准”选项卡 | Studio 选项卡 | 能够访问 Studio 选项卡 |
| “标准”选项卡 | “库”选项卡 | 能够访问库(Library)选项卡 |
| 功能权限 | 查看研究设计 | 仅查看研究设计 |
| 功能权限 | 设计研究 | 能够通过工作室创建研究设计定义和研究计划 |
| 功能权限 | 管理安全配置 | 能够为研究设计与配置安全集成,包括确定涉及的表单、表单中需发送至安全系统的条目,以及规定表单数据能否纳入安全病例的纳入标准。 |
| 功能权限 | 查看库 | 能够通过“工作室(Studio)”>“库(Library)”查看库集合 及其设计 |
| 功能权限 | 设计库 | 能够通过“工作室”>“库”为集合 创建研究设计定义和研究计划 |
安全集成类型
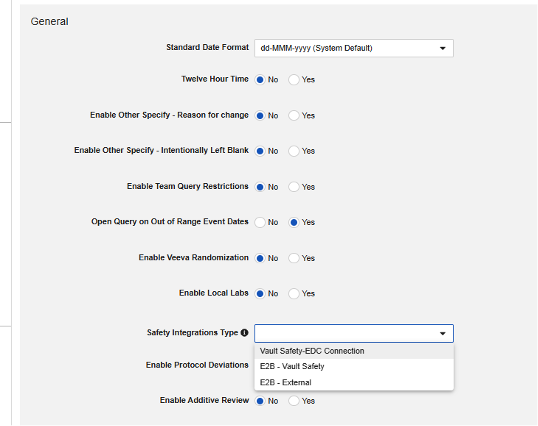
配置 Veeva EDC 安全集成的第一步是在研究设置中设置安全集成类型(Safety Integration Type)值。
-
点击保存。
一旦安全集成类型设置为非空值,该字段将变为只读状态。这是由 Safety-EDC 连接型集成与 E2B Link 型集成的本质差异决定的。若需在两种类型间切换,请联系 Veeva 代表获取协助与规划支持。
有关使用 E2B 进行安全集成的更多信息,请参阅“配置 E2B 研究”。
完成整体集成类型保存后,工作室导航菜单中将新增两个选项:安全设置(Safety Settings)和表单配置(Form Configurations):
安全设置
更新设置
为研究设计配置主要安全设置的操作步骤如下:
- 导航到研究 的工作室 > 安全设置。
- 单击编辑。
- 进行更改。下表列出了可用的病例设置。
- 点击保存。
可用设置
提供以下设置:
| 设置 | 默认值 | 说明 |
|---|---|---|
| 受试者 ID 位置 | 患者姓名或姓名缩写(Patient Name or Initials) | 选择当前研究中 Veeva EDC 受试者 ID 的传输目标位置:
|
| 受试者 ID 格式 | 仅受试者 | 从以下选项中选择受试者 ID 的格式:
|
| 主要来源资格认定值 | 医生 | 分类为研究药物或治疗评估人(与安全病例的每个事件相关)。可以从以下分类类型中进行选择:
|
| 当伴随用药可疑时,对研究药物分类 | 始终可疑 | 该设置仅适用于试验已配置为允许数据录入用户将归类为伴随用药的表单链接至安全病例启动事件,并可覆盖默认分类“伴随用药”的场景。
|
| 研究名称值 | 可选:你可以定义一个研究名称,以便在传输过程中使用。如果留空,则 Vault 会发送研究标签。 |
|
| 申办方研究编号值 | 可选:你可以定义一个申办方研究编号,以便在传输过程中使用。如果留空,则 Vault 会发送研究标签。 |
|
| 研究类型 | 临床试验 | 从以下选项中选择反应的研究类型(C.5.4):
|
| 报告者(Reporter) | 完整研究中心信息 | 这是安全病例上“报告者(Reporter)”字段的值。报告者信息将基于 Veeva EDC 中研究中心的定义信息自动填充。可选选项如下:
|
| 用于编码的 NullFlavor | 选择编码空值的处理方式(当无 MedDRA 编码值时)。该设置仅适用于 Veeva EDC 研究设计中已启用表单编码功能且已为安全传输分配目标位置的情况。可选选项如下:
连接的编码按安全数据类型分布在以下位置:
注意:无需为上述每个字段映射对应的配对字段(即“安全字段列表”下方标注有“……(编码 LLT)”的字段)。这些映射行仅用于特殊场景。更多信息请参阅本参考文档后续相关的“条目配置”部分。 |
|
| 静音编码跟进 | 否(No) | 设置为是(Yes)时,若唯一变更改是对 Veeva EDC 中已编码医学术语(事件、病史、死亡原因等)分配新编码或更换编码,Vault 将不会发送后续数据。若安全病例相关数据发生其他任何更改,仍会触发后续发送。 设置为否(No)时,安全病例相关数据的任何更改(包括医学术语编码更改)都会触发 Veeva EDC 发送后续数据。 如果你主要在安全系统中执行编码,则建议将此选项设置为是,以避免因编码更改向安全系统发送不必要的后续数据。 |
| 日期时间值行为 | 使用屏幕/输入值 | 针对 EDC 表单上的日期时间字段配置安全数据时,此选项指示要发送的值。你可以从使用屏幕/输入值(Use Screen / Entered Value)中进行选择,以使用研究中心输入的值,也可以选择使用标准化(UTC)值(Use Normalized (UTC) Value),以使用相对于屏幕值偏移的研究中心时区,将日期时间标准化为 UTC。 |
| SAE 开始进行当地实验测试之前的天数 | 该设置仅适用于研究使用“本地实验室”模块(在工作室的研究设置中启用)的场景。 输入需搜索实验室测试的天数(以安全病例启动事件的开始日期为基准向前推算)。设置后,系统将搜索该时间段内的所有本地实验室测试表单,并将测试数据发送至安全系统供审查。这些测试数据不会在传输时直接纳入任何病例,而是由医疗人员审查后决定是否纳入特定病例。 该字段允许输入 0 至 21 之间的数值(单位:天)。 |
|
| SAE 开始进行当地实验测试之后的天数 | 该设置仅适用于研究使用“本地实验室”模块(在工作室的研究设置中启用)的场景。 输入需搜索实验室测试的天数(以安全病例启动事件的开始日期为基准向后推算)。设置后,系统将搜索该时间段内的所有本地实验室测试表单,并将测试数据发送至安全系统供审查。这些测试数据不会在传输时直接纳入任何病例,而是由医疗人员审查后决定是否纳入特定病例。 该字段允许输入 0 至 7 之间的数值(单位:天)。 |
|
| 自动设置医学确认 | 否(No) | 此设置确定在每个 Veeva EDC 传输的安全病例中包含“由医疗专业人员进行医学确认”。选择是(Yes)以包含。若选择否,传输中将省略该值。最常用设置为是,因为安全病例源自临床试验中心/研究者。 |
| 将次要事件研究中心链接包含到病例中 | 是(Yes) | 对此设置选择是将包括链接到案例次要事件的相关数据,而不仅仅包括主要安全病例启动事件。 |
表单配置
完成主安全设置的更新后,下一步需配置研究方案中的哪些表单参与安全集成。这些设置在工作室 > 表单配置中进行。
请注意,只有在完成安全设置配置后,+ 新建表单配置(+ New Form Configuration)按钮才会激活。
你必须为严重不良事件(安全病例启动事件)表单和要用于将数据发送到安全系统的任何其他表单创建表单配置。从工作室(Studio)> 表单配置(Form Configurations)创建表单配置。
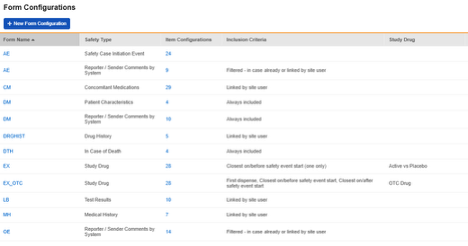
研究表单配置汇总列表示例:
每个表单配置 都有三个步骤:
- 表单属性(Form Properties):定义表单属性,包括安全数据类型和关键条目。
- 条目配置(Item Configurations):将安全字段映射到其对应的条目。
- 纳入标准(Inclusion Criteria):定义 Vault 将用于确定要包含到安全系统发送中的表单数据的纳入标准。
安全数据类型
每个为安全集成配置的表单都包含一个安全数据类型。这些类型对应各类安全系统中的标准数据模型/类型。
以下为 Veeva EDC 的安全配置类型说明。对于熟悉 E2B 格式(R3)的用户,标注了相关章节:
| EDC 类型 | 相关 E2B(R3)位置 | Veeva Safety | 备注 |
|---|---|---|---|
| 安全病例启动事件 | E.* | 不良事件 | 此类表单(原称为严重不良事件)会触发安全病例的传输。若先前发送的病例不再满足初始发送条件,病例将收到无效通知。 根据配置的纳入标准,一份安全病例既可以仅包含主事件表单的数据,也可整合多个不同事件表单的数据,甚至可纳入非严重事件相关数据。 在安全系统及安全病例中,这类数据均称为事件。 |
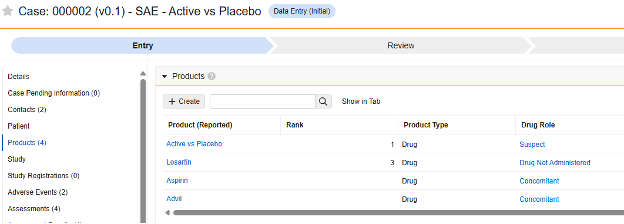
| 研究药物 | G.* | 产品/产品剂量 | 此类表单适用于记录研究过程中研究药物或产品发放情况的各类 EDC 表单。在安全系统中,这类信息被称为产品,并可分组整合单次或多次的发放/剂量数据。 EDC 会依据研究药物的纳入标准,关联匹配病例对应事件相关的研究药物发放记录。为确保相关研究药物发放记录能完整传输,且不受研究中心用户操作的影响,系统暂不支持为重要研究药物发放记录链接对应研究中心。 |
| 伴随用药 | G.* | 产品/产品剂量 | 此类表单用于记录受试者使用的、非研究方案规定的其他各类药物或产品相关信息。 在安全系统及对应病例中,这类信息同样被称为产品,并可分组整合单次或多次的发放/剂量数据。 |
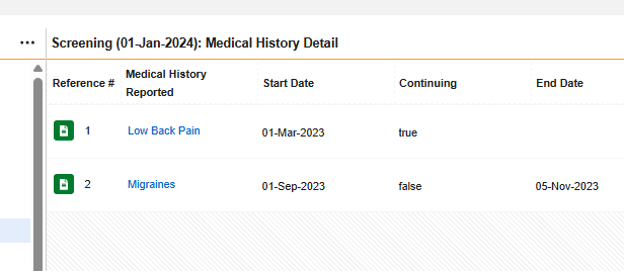
| 病史 | D.7.* | 病史和并发症 | 此类表单用于记录受试者(通常在参与研究前)的既往患病情况或接受的医疗操作等信息。 |
| 药物史 | D.8.* | 药物史 | 此类表单用于记录受试者(通常在参与研究前)的过往用药情况。 |
| 测试结果 | F.* | 测试结果 | 此类表单用于记录与受试者当前所遇事件相关的特定实验室检测及诊断结果。 |
| 患者特征 | D.1 至 D.6 | 患者 | 此类表单用于记录受试者的一般特征,例如出生日期、性别等。 |
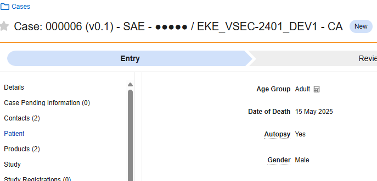
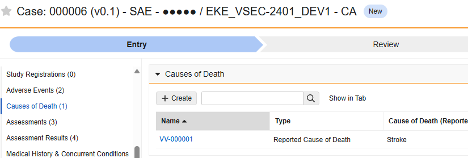
| 如果死亡 | D.9.* | 患者或死亡原因 | 若受试者发生死亡情况,此类表单用于记录相关信息,如死亡日期、已报告的死亡原因等。 |
表单配置的创建步骤
新表单配置的创建步骤如下:
- 导航到研究 的工作室 > 表单配置。
- 完成后,单击保存并关闭(Save and Close)。
缺少按钮:如果你拥有所需权限但看不到“+ 新建表单配置”按钮,请确保已完成安全设置的保存操作。
关于表单属性、条目配置和纳入标准的选项,本文档后续章节将按安全类型详细描述。
在每个步骤中,单击保存仅保存当前步骤的信息,不会进入下一步。单击保存并进入下一步按钮则会保存当前信息并前进到下一步。
删除表单配置
你可以删除单个表单配置或一次性删除所有表单配置以重新开始。如果你有与表单配置 关联的安全病例,则 Vault 将禁用删除选项。
要移除单个表单配置,请执行以下操作:
- 导航到研究 的工作室 > 表单配置。
- 将鼠标悬停在表单配置 的名称上以显示操作(Actions)菜单。
- 选择删除(Delete)。
- 在确认对话框中,单击删除。
复制表单配置
当前版本中,仅可通过“复制表单”功能复制表单的安全配置信息。其他复制级别(“复制事件组”和“复制事件”)不支持复制表单级别的安全配置。
如果从源库/研究中复制了事件组或事件(包含其中的表单),并且这些表单包含安全表单配置信息,只需在后续操作中使用“复制表单”功能并选择使用现有/使用更改进行更新(Use Existing / Update with Changes)选项即可。
执行核心表单复制时,是否同步复制安全表单配置为可选操作。
若需复制历史配置,需在包括(Include)部分中选择安全配置(Safety Configuration)。
复制时引入现有安全配置的场景:
-
后续复制:若先前已通过复制事件组或复制事件复制了表单,或最初使用复制表单时未包含安全配置,适用此场景。必须勾选使用更改进行更新。系统会根据表单的调整情况“匹配”可复制的配置内容。该场景适用于目标研究中已存在对应 AE 表单的情况:
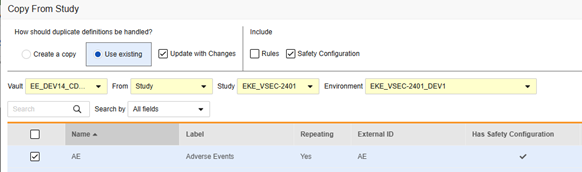
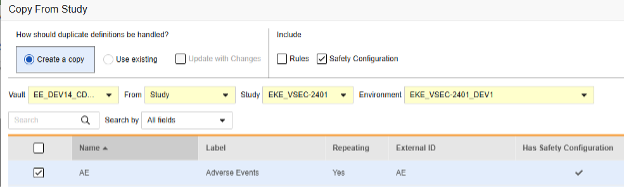
复制表单安全配置的操作步骤如下:
- 导航到工作室(Studio)> 表单(Forms)。
- 单击从研究中复制(Copy From Study)。
- 根据情况选择创建副本(Create a copy)或使用现有/使用更改进行更新(参见上面的示例)
- 选中安全配置复选框,以同时复制与表单关联的任何安全配置。Vault 会指示哪些表单在对话框的具有安全配置(Has Safety Configuration)列中具有安全配置。请注意,这需要具有管理安全配置 权限的研究角色。如果源研究和目标研究在安全配置方面不匹配,安全配置复选框将被禁用。两者都必须已设置安全配置,并且使用相同的安全集成类型。
- 选择 Vault。
- 对于从研究中复制,选择要从何处复制(从另一项研究中(From Another Study)或从库中(From Library))。
- 选择要从中复制的研究环境(Study Environment)。
- 搜索或滚动以找到要复制的表单定义。
- 选择要复制的表单。
- 单击复制表单(Copy Forms)。Vault 开始将表单定义 复制到你的研究 中。
- 可选:在从研究中复制对话框中:
- 单击查看摘要(View Summary)以查看已复制表单的列表和副本的状态。
- 如果复制的表单不超过 20 个,单击查看日志(View Log)以查看复制的每个对象记录的详细状态信息。
- 如果复制的表单 超过 20 个,完成复制后,Vault 会发送一封电子邮件通知,其中包含用于下载日志文件的链接。
- 完成后,单击关闭(Close)。单击关闭(Close)后,你将无法再访问摘要或日志文件。
- 复制表单后,请务必检查已复制表单的安全表单配置。可能需要对映射/值转换进行调整。
有关复制表单的更多信息,请参见“复制设计”。
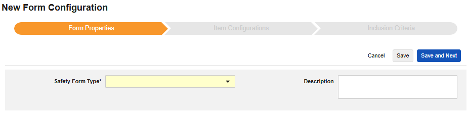
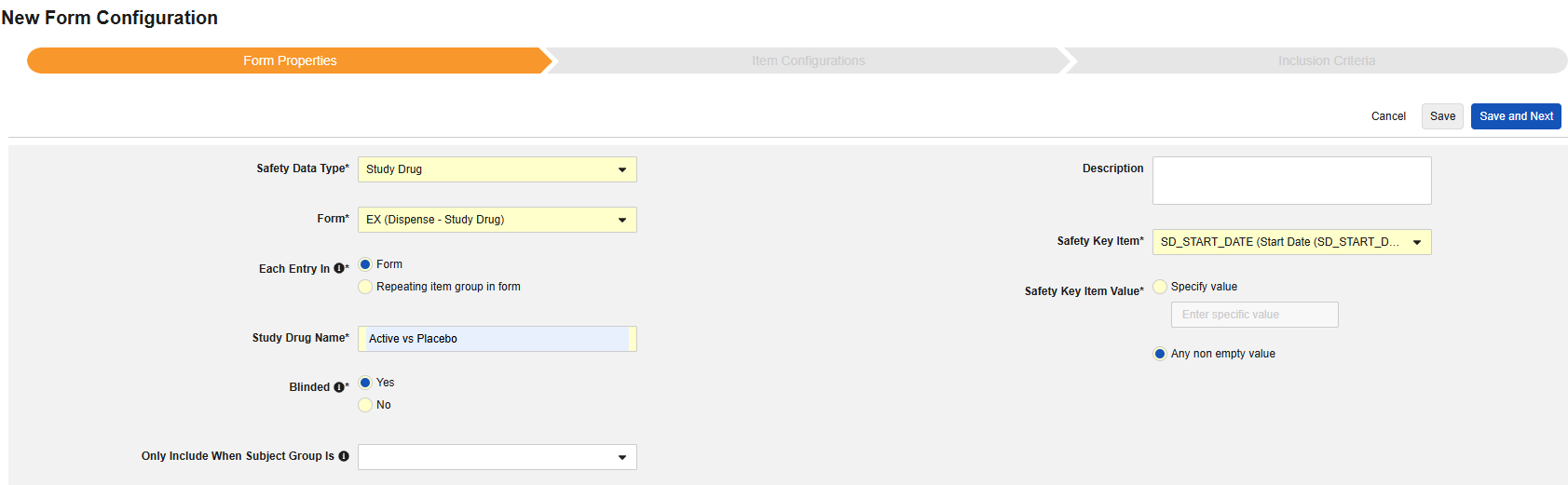
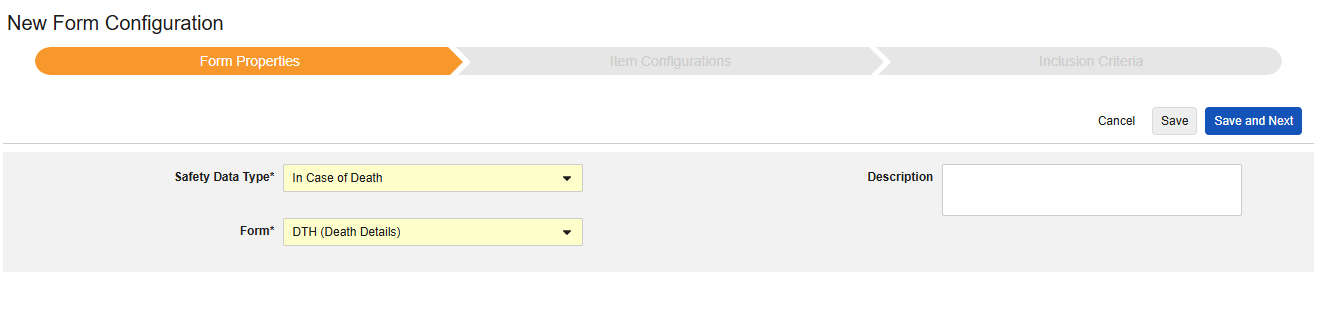
表单属性
表单配置的第一步是设置表单属性。从下拉菜单中选择安全类型(Safety Type)后,即可配置通用属性。这些属性会因安全数据类型不同而有所差异。
| 安全数据类型 | 属性 | ||||
|---|---|---|---|---|---|
| 表单 | 安全关键条目 | 以下范围内的每个条目 | 产品信息 | 说明 | |
| 安全病例启动事件 | * | * | * | ||
| 研究药物 | * | * | * | * | |
| 伴随用药 | * | * | |||
| 病史 | * | * | |||
| 药物史 | * | * | |||
| 测试结果 | * | * | |||
| 患者特征 | * | ||||
| 如果死亡 | * | ||||
|
* 表示该属性适用于此安全数据类型且为必填项 表示该属性适用于此安全数据类型且为可选填项 |
|||||
- 表单需选择待映射至安全相关条目的 EDC 表单。
- 安全关键条目是一个特殊属性,优先级高于其他所有标准,用于判定表单是否可启动病例或纳入病例。对于安全病例启动事件类型,它主导整个病例的首次发送(或后续无效)。对于研究药物类型,它是日期相关标准生效前,判定表单是否符合纳入条件的初始依据。
- 以下范围内的每个条目设置用于指示如何根据 EDC 表单的设计将信息分组为各类安全数据。详见下一章节示例与说明。理解这一点对于正确配置安全设置至关重要。
- 产品信息是关于试验中已知研究药物的信息,包括名称、是否设盲、适应症、适用于哪个研究组。
- 描述是供研究设计者使用的可选帮助文本。
以下范围内的每个条目 - 设计注意事项
安全表单配置的表单属性中的以下范围内的每个条目概念对于数据传输配置至关重要。它用于明确告知 Veeva EDC:应提取整个(重复型)表单的数据,还是表单中重复条目组的数据。该选项包含两种选择:
- 表单:提取非重复条目组中录入的表单数据进行传输。表单可设为重复型(例如用于记录研究中的多个事件),但表单内的条目组不得为重复型。
- 表单中的重复条目组:提取表单中重复条目组的录入数据进行传输。此时多个事件通过条目组的每次重复体现,而非表单本身的重复。
表单的部分条目配置会因以下范围内的每个条目表单属性而具有不同的可用选项:该类型的大多数条目配置为“单次录入”类型,但部分特殊条目仅支持非重复型,或无限制(重复/非重复条目均可)。具体特殊条目说明详见本页后续按安全类型划分的小节。
以下范围内的每个条目:表单
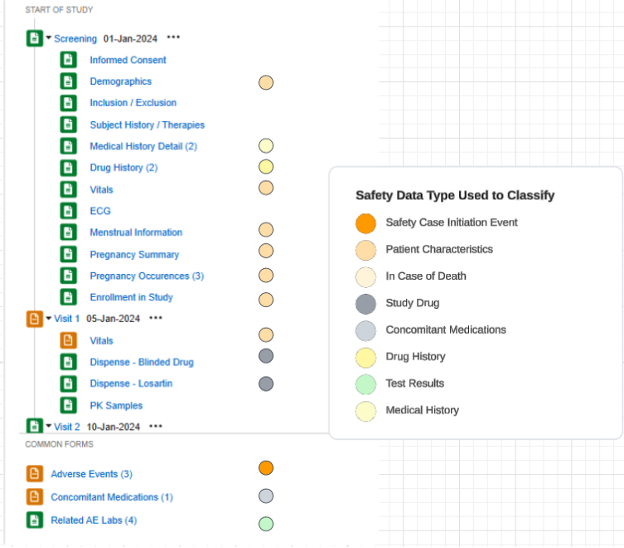
Veeva 针对具有安全集成的研究设计的最佳实践建议在不同安全类型中全程使用重复表单:
具体示例如下:
- 不良事件表单:无论非严重还是严重不良事件,均使用同一表单设计。避免研究中心用户因事件严重程度升级/降级,需在不同表单(非严重 AE 表单/严重 AE 表单)间迁移数据的问题。
- 若需 EDC 用户管理含多个事件的安全病例,可通过日期规则和/或特定研究中心链接,将其他严重/非严重事件纳入主事件。
- 其他安全数据类型:除单一答案信息(“患者特征”和“如果死亡”)外,其余均采用重复表单。请注意,此处“重复表单”包含两种情况:
- 表单本身定义为重复型(例如日志表单)
- 表单为非重复型,但在研究访视计划中多次出现(例如第 1 次访视、第 2 次访视等等均需填写的研究药物表单)
- 根据研究需要,基于研究中心意见(链接)和/或基于日期的纳入规则可以包含跨不同类型的适当相关数据。
一个采用此配置的研究示例,以及应用于研究设计表单的安全数据类型:
自定义字段:通过 Safety-EDC 连接,可以使用 Veeva Safety 中的自定义/配置字段来扩展可传输的表单/数据。
以下范围内的每个条目:重复条目组与表单
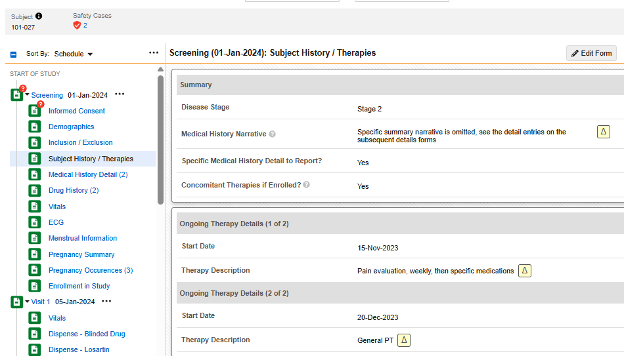
以下示例展示以下范围内的每个条目两种选项的联合使用场景:
- 受试者病史/治疗表单在第一个条目组含少量非重复问题:
- 当对是否需报告特定病史详情?(Specific Medical History Detail to Report?)回答是时,一条动态规则(在表单提交时)会打开计划中的下一个病史详细信息表单。每份该表单记录一条病史信息。
- 当对入组后是否有伴随治疗?(Concomitant Therapies if Enrolled?)回答是时,使用渐进显示在同一表单上展示一个重复条目组。根据需要录入多条病史记录,作为该同一表单中的重复条目组。
- 病史详细信息表单为重复表单,但其设计中包含的所有条目组/问题均为非重复型,因此以下范围内的每个条目 = 表单
- 在上图示例中,认为安全病例中存在四 (4) 条病史记录的安全配置是:
- 表单 CTHERAPY(受试者病史/治疗情况):
- 类型 = 病史
- 以下范围内的每个条目 = 表单中的重复条目组
- 表单 MH(病史详细信息):
- 类型 = 病史
- 以下范围内的每个条目 = 表单
- 表单 CTHERAPY(受试者病史/治疗情况):
以下范围内的每个条目:事件的重复条目组
若研究需在单个 EDC 表单设计中记录安全病例的多个事件,配置方式如下:
- 只要表单中存在事件记录,即可启动安全病例。
- 此研究设计需要将以下范围内的每个条目设置为表单中的重复条目组。
安全关键条目/值
表单属性设置中的安全关键条目和安全关键条目值用于评估病例启动或表单纳入病例的条件,适用于以下安全类型:
- 安全病例启动事件:系统判定结果为真时,触发首次向安全系统传输数据。相反,系统判定结果为假且此前已传输过安全病例时,向安全系统发送无效通知。
- 研究药物:系统判定结果为真时,表单中的用药发放信息具备纳入病例的资格。最终是否随安全病例传输数据,需结合研究药物纳入标准进一步判定。
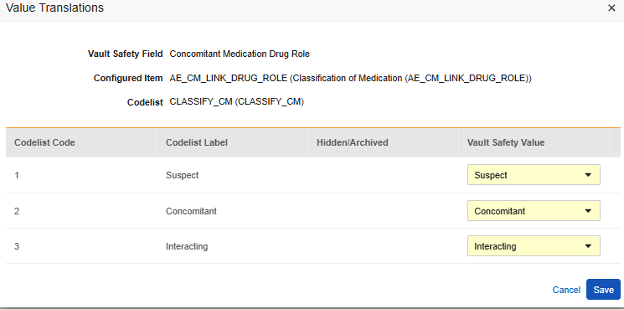
请注意,对于引用代码列表的安全关键条目值,需要指定代码列表代码,而不是代码列表标签。
以下是安全病例启动事件类型的几个常见示例:
示例 1
安全关键条目关联代码列表类型条目“AESER”,要求代码列表代码为“Y”时启动安全病例: 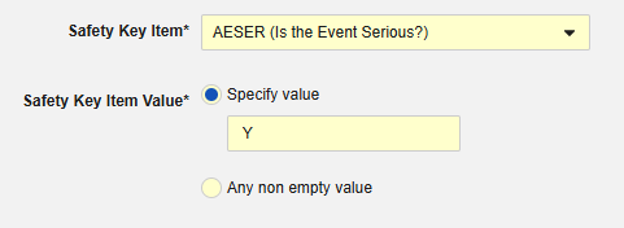
安全关键条目关联 AE 表单中的以下条目。请注意,安全关键条目值需要的是代码列表代码,而研究中心用户将从代码列表标签中进行选择:
- 首次提交具有此指定答案的表单将使该表单有资格进行安全传输(包括该表单及其任何相关数据)。
- 传输将在配置的时间进行。请参阅“管理安全集成”中的“安全设置”,以了解详细信息。
- 此外,为使传输继续进行,安全字段已报告事件在表单上也必须具有非空值。
- 此示例使用不良事件表单上的“是否严重”问题来判定是否发送安全病例。在任何研究/表单设计中,该字段通常也映射到安全字段严重
在首次发送到 Safety 后的某个时间,上述任一条件可能不再满足。(例如,严重 = 否,或缺少“已报告事件”值)。此时系统将自动向安全系统发送无效后续通知,表明它不再符合安全病例的条件。一旦研究中心用户修改了表单数据,无需针对安全集成采取特定操作。
示例 2
示例 1 使用“是否严重”问题作为安全关键条目。然而,任何字段都可以用于此目的,甚至是未用于映射到安全传输位置的字段。
在此示例中,我们改用 AE 表单中一个更通用的问题:
虽然这不是表单上主要的“是否严重”问题,但可以为严重不良事件以及“特别关注的不良事件”(AESI,可能不严重但仍需要将数据发送到安全系统)启动安全病例。
示例 3
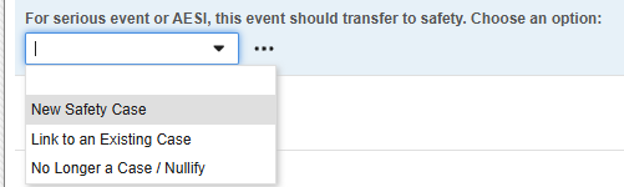
在以下示例中,安全病例启动和无效操作对研究中心用户更加透明,同时仍使用一个安全关键条目值:
代码列表条目中提供以下选项:
- 新建安全病例(New Safety Case)(其代码列表代码):用于安全关键条目。因此,只有此选择会启动安全病例。
- 链接至现有病例(Link to an Existing Case):选择此项后,系统会判定安全关键条目值为“假”。因此,该表单不会启动独立/额外病例。需通过设计规则确保研究中心用户将当前表单关联至已启动安全病例的其他事件。
- 不再符合条件(No Longer..):适用于此前已符合安全病例标准并完成数据传输的事件。当研究中心用户选择此项表示事件降级或无效时,EDC 系统会判定该选项的代码列表代码为“假”,并针对此前启动的安全病例发送无效后续通知。
无效
每当安全病例中的数据发生更改,Veeva EDC 都会发送后续通知。无效是一种特殊的后续通知,具有以下特性:
- 满足以下任一条件即可触发:
- 安全关键条目和安全关键条目的判定结果变为假
- EDC 表单中已报告事件安全字段的值变为空
- 下次向 Veeva Safety 发送消息时,会标注该通知为无效类型
- 无效是该安全病例向安全系统的最后一次传输
- 注意:该病例的首次发送先前已发生。Veeva EDC 将在首次发送时(即初始发送计时器结束后)重新评估上述两个条件,并立即对该安全病例作无效处理而不向安全系统发送。这种情况最常见于研究中心用户在首次发送计时器结束前纠正错误、重置表单等。
- 安全报告通常要求此类传输需注明无效原因。可将研究配置为让研究中心用户填写无效原因。若未配置该选项,或研究中心用户未填写,系统将使用默认原因:“该病例不再满足初始发送时的条件。这可能包括事件已降级为非严重、用户操作移除所有事件等情况。”
常见无效场景:
- EDC 表单重置
- 在先前表单提交后,将 EDC 表单标记为“故意留空”
- “降级”,例如此前通过安全关键条目/值判定符合安全病例条件,现该条件不再成立,但事件本身仍存在
一旦 Veeva EDC 中的某安全病例无效,将不会恢复为活动状态。若后续修改该表单,再次使安全关键条目/值判定为“真”且“已报告事件”安全字段值非空,系统会创建并发送新的安全病例,而非恢复原病例。
按安全数据类型
以下章节描述每种安全数据类型的表单配置步骤。
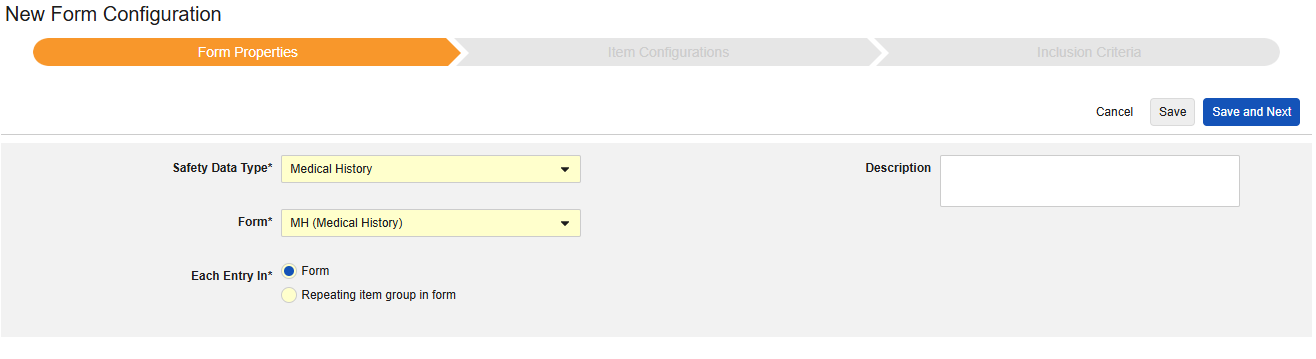
安全病例启动事件
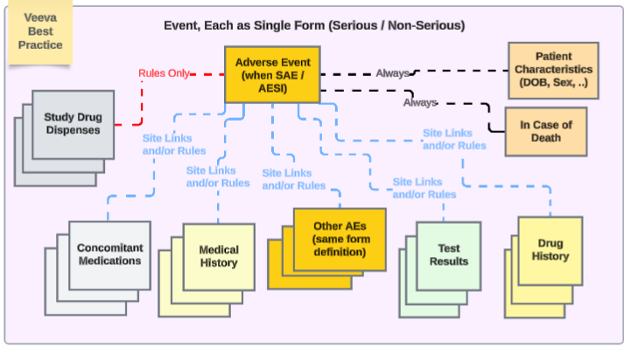
此类安全数据类型的表单配置是触发安全病例传输流程的关键。其他所有安全数据类型随后将按其配置规则纳入病例。事件将在 Veeva Safety 的对应部分中显示:
通过 Veeva Safety EDC 连接,可以将多个表单 配置为安全病例启动事件。这有助于提高不良事件表单设计的灵活性。利用此功能,可以为严重不良事件 以及必须向安全系统报告的其他情况(例如妊娠)创建单独的表单。
要配置安全病例启动事件(Safety Case Initiation Event)表单,请执行以下操作:
- 导航到研究 的工作室 > 表单配置。
- 单击 + 新建表单配置(New Form Configuration)。
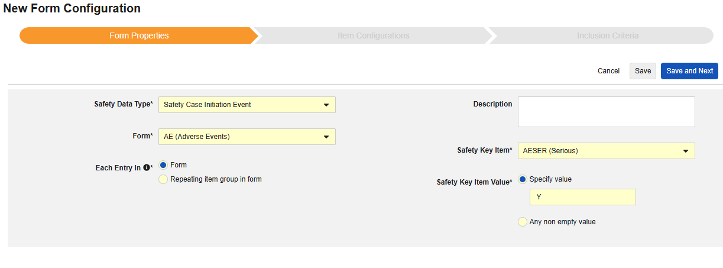
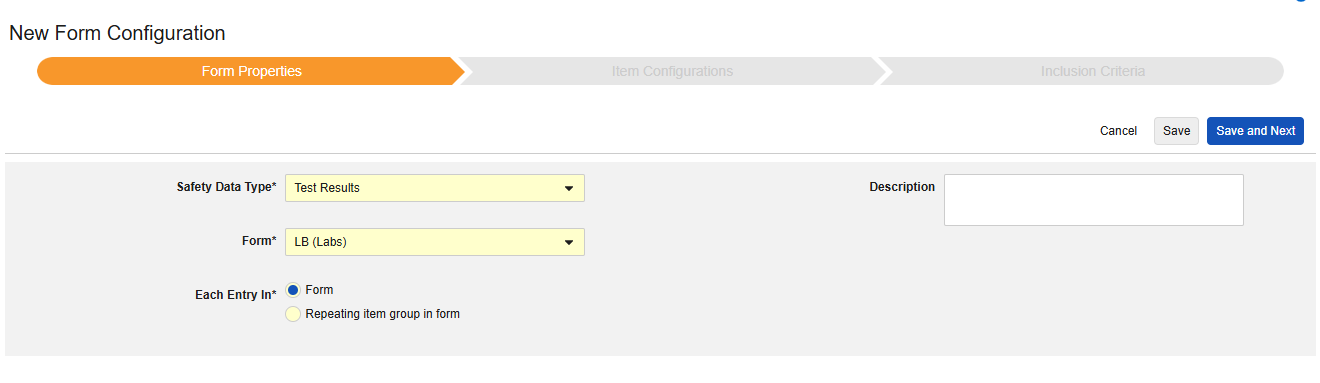
- 选择安全病例启动事件作为安全数据类型(Safety Data Type)。
- 选择表单(Form)。
- 对于以下范围内的每个条目(Each Entry In),选择确定单个病例的方法:
- 表单:选择此选项可将表单 的每个实例视为其自己的病例。
- 表单中的重复条目组:选择此选项可将重复条目组 的每个实例视为其自己的病例。
- 可选:输入描述(Description)。
- 定义安全关键条目值。从以下选项中选择:
- 指定值:选择此选项时,需输入具体的匹配值。请注意,对于代码列表类型的条目,必须提供代码列表条目的代码,而非标签。
- 任何非空值(Any non empty value):此选项将任何非空值视为匹配。
- 单击保存或保存并进入下一步,进入”条目配置“步骤。
首次保存后,安全数据类型、表单和以下范围内的每个条目设置将变为只读状态。“条目配置”和“纳入标准”选项卡的后续配置均依赖这些设置。若需更改这些设置,必须删除当前表单配置后重新创建。
研究药物
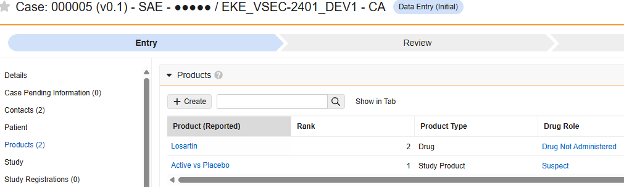
此安全数据类型用于跟踪研究药物的剂量/配药信息,即临床研究中用于受试者的测试药物。相关信息将同步至 Veeva Safety 的产品/产品剂量部分。以下示例展示了两种药物。
多表单:可将多个表单定义配置为 研究药物安全数据类型。
要包含研究药物 表单(以前标记为治疗)中的数据,请执行以下操作:
- 导航到研究 的工作室 > 表单配置。
- 单击 + 新建表单配置(New Form Configuration)。
- 选择研究药物(Study Drug)作为安全数据类型。
- 对于以下范围内的每个条目,选择确定单个研究药物的方法:
- 表单:选择此选项可将表单 的每个实例视为其自己的研究药物。
- 表单中的重复条目组:选择此选项可将重复条目组 的每个实例视为其自己的研究药物。
- 输入研究药物名称(Study Drug Name)。该值应与 Veeva Safety 中的药物名称一致。名称不匹配不会阻止数据传输/流动,但最终需要同步。
-
为盲态(Blinding)选择是或否。说明该研究药物在试验中是否设盲。此属性仅作为标识,用于报告用途。即使 EDC 中对数据设置了限制,所有传输至安全系统的数据均为非盲态。
-
可选:你可以选择仅在受试者 位于特定受试者组 中时包含此表单。具体操作方法为:为仅针对以下受试者组包含(Only Include When Subject Group Is)选择一个组(Group)。任何未在所选组中的受试者,其研究药物表单将不会包含在传输中。当此字段为空时,Vault 会在满足纳入标准时包含所有受试者的表单。
- 可选:输入描述(Description)。
- 选择安全关键条目(Safety Key Item)。这通常是指示已执行配药的条目。对于研究药物类型,该判定用于确定表单/用药发放记录是否具备纳入传输的资格。还需评估其他纳入标准,以将相关的研究药物发放信息纳入安全病例。
- 定义安全关键条目值。从以下选项中选择:
- 指定值:选择此选项时,需输入具体的匹配值。
- 任何非空值(Any non empty value):此选项将任何非空值视为匹配。
- 单击保存或保存并进入下一步,进入”条目配置“步骤。
首次保存后,安全数据类型、表单和以下范围内的每个条目设置将变为只读状态。“条目配置”和“纳入标准”选项卡的后续配置均依赖这些设置。若需更改这些设置,必须删除当前表单配置后重新创建。
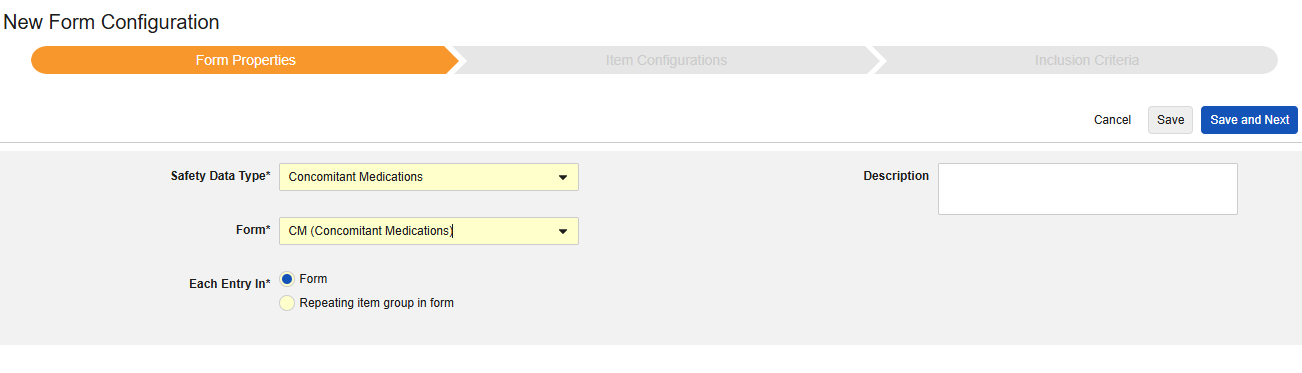
伴随用药
此类安全配置适用于研究中的伴随用药表单。相关信息将同步至 Veeva Safety 的产品/产品剂量部分。以下示例展示了阿司匹林和 Advil。
多表单:可将多个表单定义配置为 伴随用药安全数据类型。
要包含伴随用药,请执行以下操作:
- 导航到研究 的工作室 > 表单配置。
- 单击 + 新建表单配置(New Form Configuration)。
- 选择伴随用药作为安全数据类型。
- 对于以下范围内的每个条目,选择确定单个伴随用药的方法:
- 表单:选择此选项可将表单 的每个实例视为其自己的伴随用药
- 表单中的重复条目组:选择此选项可将重复条目组 的每个实例视为其自己的伴随用药。
- 可选:输入描述(Description)。
- 单击保存或保存并进入下一步,进入”条目配置“步骤。
首次保存后,安全数据类型、表单和以下范围内的每个条目设置将变为只读状态。“条目配置”和“纳入标准”选项卡的后续配置均依赖这些设置。若需更改这些设置,必须删除当前表单配置后重新创建。
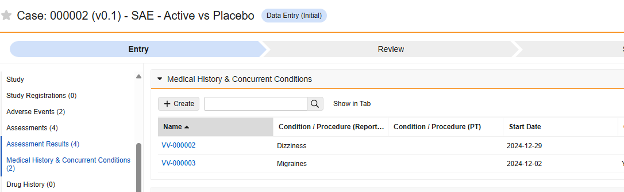
病史
此类安全配置适用于研究中的病史表单。相关信息将同步至 Veeva Safety 的病史和并发症(Medical History & Concurrent Conditions)部分。
多表单:可将多个表单定义配置为 病史安全数据类型。
要包含病史,请执行以下操作:
- 导航到研究 的工作室 > 表单配置。
- 单击 + 新建表单配置(New Form Configuration)。
- 选择病史作为安全数据类型。
- 对于以下范围内的每个条目,选择确定单个病史事件的方法:
- 表单:选择此选项可将表单 的每个实例视为其自己的病史
- 表单中的重复条目组:选择此选项可将重复条目组 的每个实例视为其自己的病史。
- 可选:输入描述(Description)。
- 单击保存或保存并进入下一步,进入”条目配置“步骤。
首次保存后,安全数据类型、表单和以下范围内的每个条目设置将变为只读状态。“条目配置”和“纳入标准”选项卡的后续配置均依赖这些设置。若需更改这些设置,必须删除当前表单配置后重新创建。
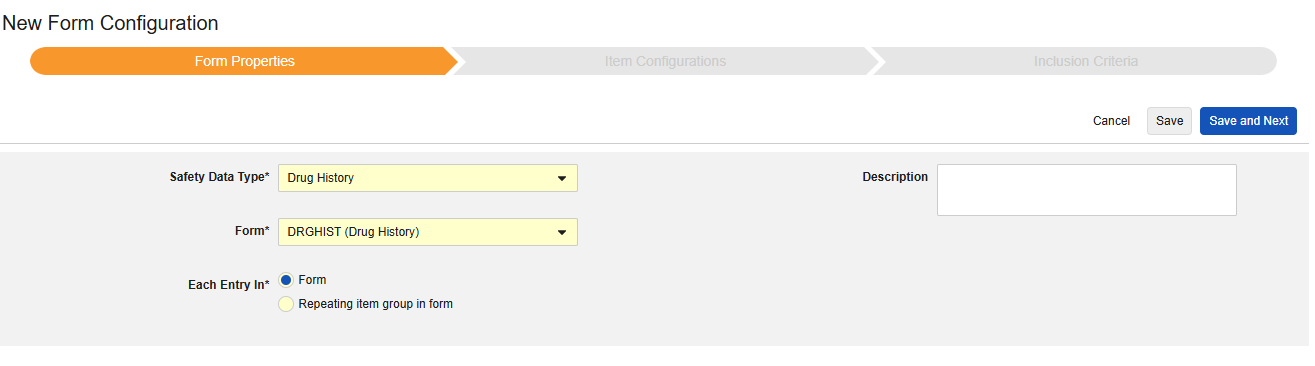
药物史
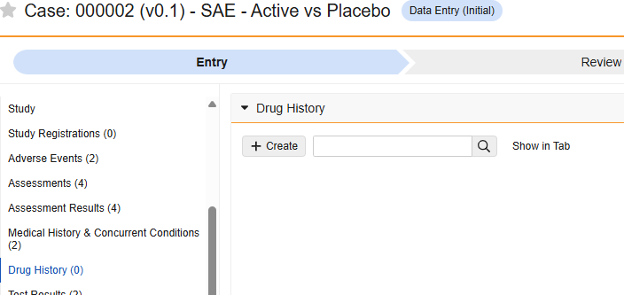
此类安全配置适用于研究中的药物史表单。相关信息将同步至 Veeva Safety 的药物史(Drug History)部分。
多表单:可将多个表单定义配置为 药物史安全数据类型。
要包含药物史 表单中的数据,请执行以下操作:
- 导航到研究 的工作室 > 表单配置。
- 单击 + 新建表单配置(New Form Configuration)。
- 选择药物史(Drug History)作为安全数据类型。
- 对于以下范围内的每个条目,选择确定单个药物史的方法:
- 表单:选择此选项可将表单 的每个实例视为其自己的药物史。
- 表单中的重复条目组:选择此选项可将重复条目组 的每个实例视为其自己的药物史。
- 可选:输入描述(Description)。
- 单击保存或保存并进入下一步,进入”条目配置“步骤。
首次保存后,安全数据类型、表单和以下范围内的每个条目设置将变为只读状态。“条目配置”和“纳入标准”选项卡的后续配置均依赖这些设置。若需更改这些设置,必须删除当前表单配置后重新创建。
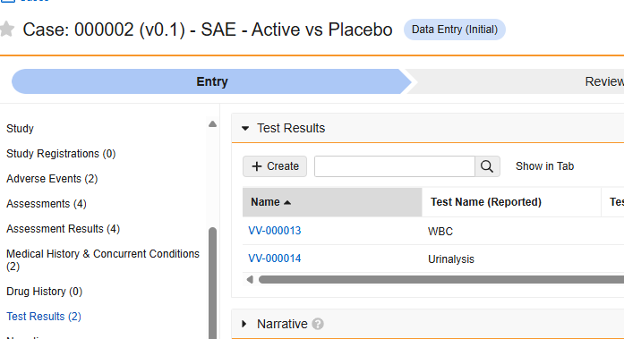
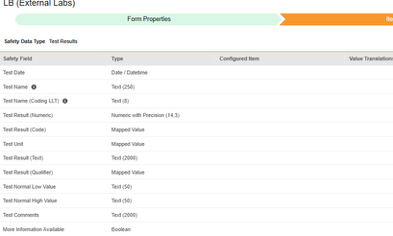
测试结果
此类安全配置适用于研究中的实验室/测试结果表单。相关信息将同步至 Veeva Safety 的测试结果(Test Results)部分。
多表单:可将多个表单定义配置为 测试结果安全数据类型。
若在 Veeva EDC 中使用本地实验室模块(实验室面板),无需为相关表单专门配置额外的安全设置。相反,所有实验室日期接近安全病例启动日期的测试都会被发送至 Veeva Safety 供审查。在 Veeva Safety 中,用户可根据医疗评估结果将特定测试纳入病例。病例日期前后的天数范围需在研究安全设置中配置。
要包含测试结果 的数据,请执行以下操作:
- 如果尚未进入编辑模式,单击编辑。
- 单击测试结果(Test Results)以展开该部分。
- 为包含测试结果(Include Test Results)选择是(Yes)。
- 选择测试结果表单(Test Results Form)。
- 为你在表单中包含的每个字段选择条目。请注意,条目 必须具有正确的数据类型。有关条目 及其预期数据类型 的列表,请参见下表。
- 单击保存或保存并进入下一步,进入”条目配置“步骤。
首次保存后,安全数据类型、表单和以下范围内的每个条目设置将变为只读状态。“条目配置”和“纳入标准”选项卡的后续配置均依赖这些设置。若需更改这些设置,必须删除当前表单配置后重新创建。
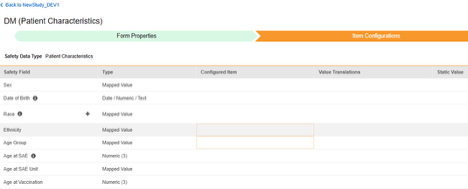
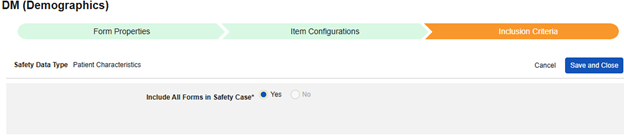
患者特征
此类安全配置适用于记录受试者一般信息的表单。相关信息将同步至 Veeva Safety 的患者(Patient)部分。
多表单:可将多个表单定义配置为 患者特征安全数据类型。例如,可以在一个表单中收集性别条目,在另一个表单中收集出生日期条目。
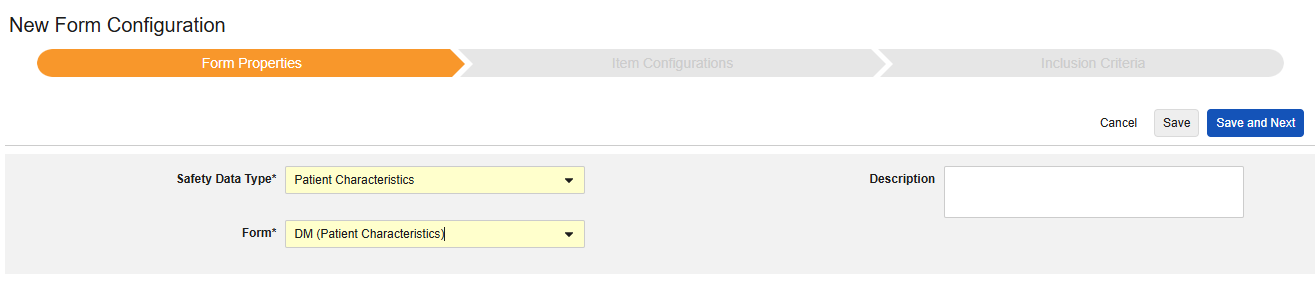
要包含患者特征,请执行以下操作:
- 导航到研究 的工作室 > 表单配置。
- 单击 + 新建表单配置(New Form Configuration)。
- 选择患者特征(Patient Characteristics)作为安全数据类型。
- 可选:输入描述(Description)。
- 单击保存或保存并进入下一步,进入”条目配置“步骤。
首次保存后,安全数据类型、表单和以下范围内的每个条目设置将变为只读状态。“条目配置”和“纳入标准”选项卡的后续配置均依赖这些设置。若需更改这些设置,必须删除当前表单配置后重新创建。
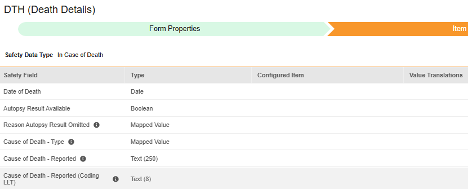
如果死亡
此类安全配置适用于记录受试者死亡详情的表单。该类型的部分字段必须为非重复型(例如死亡日期),其他字段可为重复型或非重复型(例如死亡原因)。相关信息将同步至 Veeva Safety 的两个位置:患者或死亡原因(Causes of Death)。
多表单:可将多个表单定义配置为 如果死亡安全数据类型。
要包含如果死亡 表单中的数据,请执行以下操作:
- 导航到研究 的工作室 > 表单配置。
- 单击 + 新建表单配置(New Form Configuration)。
- 选择如果死亡(In Case of Death)作为安全数据类型。
- 可选:输入描述(Description)。
- 单击保存或保存并进入下一步,进入”条目配置“步骤。
首次保存后,安全数据类型、表单和以下范围内的每个条目设置将变为只读状态。“条目配置”和“纳入标准”选项卡的后续配置均依赖这些设置。若需更改这些设置,必须删除当前表单配置后重新创建。
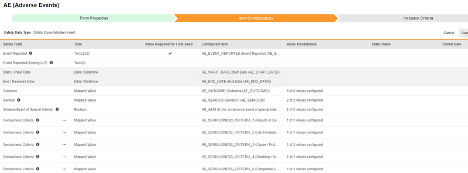
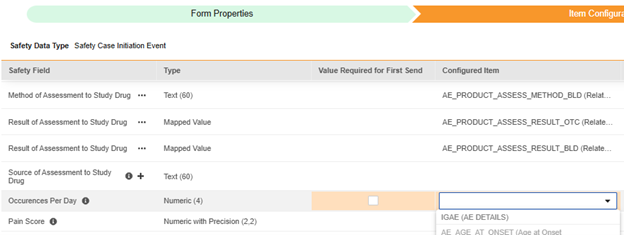
条目配置
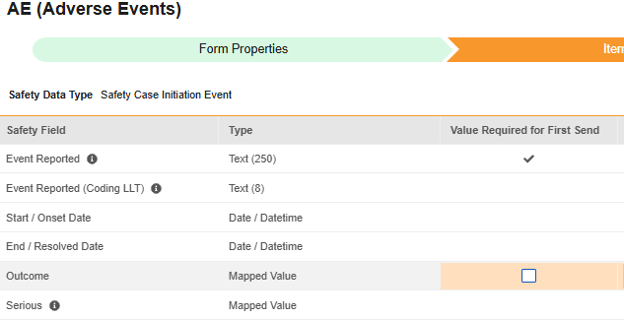
安全表单配置的第二步是“条目配置”选项卡。以下以不良事件(AE)表单设计为例,该表单已被归类为安全病例启动事件。
此表格的用途是将表单设计(条目定义)中对应的答案分配至 Veeva Safety 的对应位置。
以下是表格各列的说明:
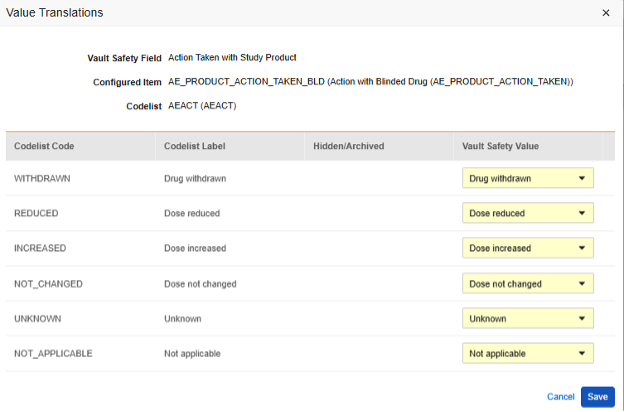
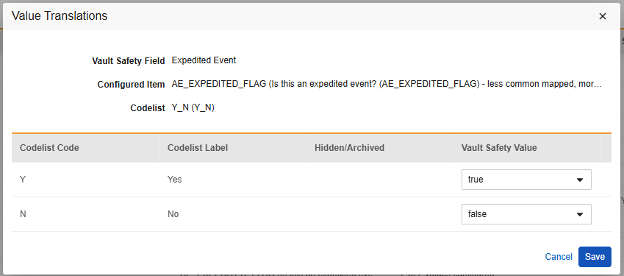
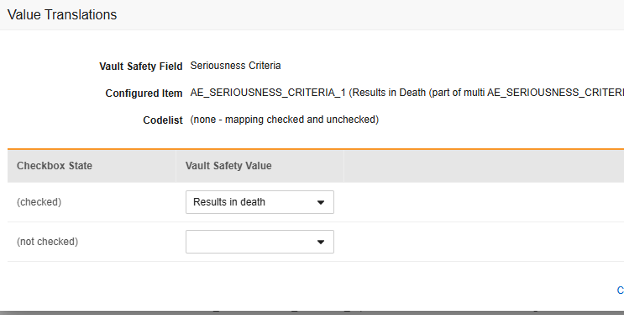
值转换
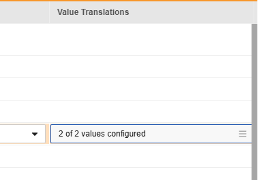
每当映射到 E2B 位置的条目定义是代码列表或布尔值(复选框)数据类型,并且 E2B 位置需要非常特定的 E2B 值时,必须设置值转换(Value Translations)以确保传输正常工作。
- 在配置条目列中选择条目定义。
- 对于每个代码列表类型的条目,在 Veeva Safety 中选择适当的值。
- 对于布尔类型的条目,映射(已勾选)或(未勾选)其中之一。例如,
- 完成后,单击保存(Save)。
- 一旦指定了值转换,配置的转换数量将在单元格中指示。
- 对所有需要特定值的位置重复这些步骤(根据其各自的标准)。如果缺少任何这些配置,工作室验证作业将指示错误并阻止部署。
转换值在此操作后仅被暂时保存。随后在选项卡级别使用保存或保存并进入下一步将保存这些转换。
静态值
一些安全字段允许使用静态值,而不是使用 EDC 表单定义的特定条目定义。请参阅下面的安全数据类型部分以获取逐字段详细信息,特别是哪些字段允许配置静态值。
示例:
配对日期
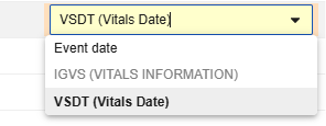
部分安全字段允许向 Veeva Safety 传输一系列值。每个值均需配对对应的日期。例如,生命体征表单中的体重数据可能在 EDC 研究设计中多次出现。该连接会传输所有这些值供参考。对于病例创建,Veeva Safety 将自动确定最接近病例开始日期或在该日期之前的值。其他值将作为附加受试者信息提供,并可在 Veeva Safety 中审查。与此类值配对的日期可以是事件日期或同一表单上另一个日期类型条目定义的值。
请参阅按安全数据类型划分的条目配置以获取逐字段详细信息,特别是哪些字段允许以这种方式配置。
示例:
研究药物关联
归类为“安全病例启动事件”的表单中,所有与研究药物相关的安全字段均需指明答案对应的特定研究药物。
请参阅按安全数据类型划分的条目配置以获取逐字段详细信息,特别是哪些字段必须“针对每种研究药物”进行回答。
示例:
-
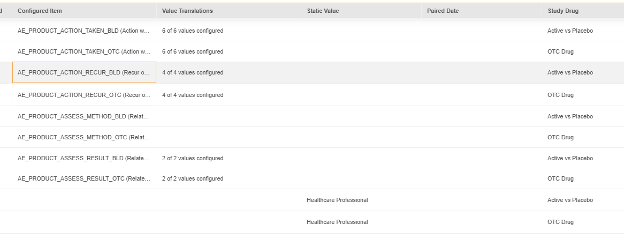
需为以下重要事件与研究药物问题配置答案(针对每种研究药物进行回答)对研究产品采取的行动、研究药物的评估结果、研究药物恢复时反应/事件是否再次出现:
-
上面的静态值也为每种药物设置(而不是表单上的条目),用于研究药物的评估来源。
条目至表单链接关联
目前,只有一个条目配置涉及条目至表单链接类型的条目定义与“通过链接”给出的答案之间的关系。具体来说是安全病例启动事件数据类型上的字段:伴随用药的药物角色:
在 EDC 表单上给出的答案涉及研究中心对伴随用药的意见。对于特定的安全病例/事件,研究中心会链接相关伴随用药,但给出不同(于伴随用药)的意见/答案:交互或可疑。以上条目定义 AE_CM_LINK_DRUG_ROLE 即为该问题,带有值转换:
由于安全病例启动事件表单设计上可能存在多个条目至表单链接,因此必须选择特定的条目至表单链接。在此示例中,一个名为 AE_TO_CM_LINK 的条目定义:
按安全数据类型
安全病例启动事件
此类安全数据类型的表单配置是触发安全病例传输流程的关键。其他所有安全数据类型随后将按其配置规则纳入病例。事件将在 Veeva Safety 的对应部分中显示:
此安全数据类型的条目配置步骤如下:
- 导航到工作室 > 表单配置中的研究。
-
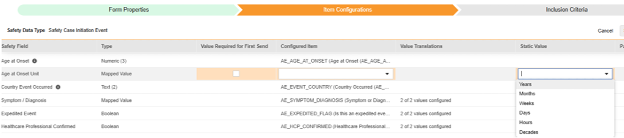
对于要映射的每一行,使用配置条目列中的单元格选择适当的条目定义。例如,从表单中选择 AETERM 条目用于 Veeva Safety 字段中的已报告事件(如下图)。条目选择的选项通常取决于先前保存的“表单属性”>“以下范围内的每个条目”设置。一些安全位置有特殊规则,表明它们只能在重复或非重复条目组中配置,或者有时两者都可以。请参阅这些步骤末尾的表格以了解这些特殊情况,以及有关此类型所有安全位置的重要说明。
- 根据配置条目和安全字段的数据类型,可能需要配置值转换。有关说明,请参阅上文“值转换”章节。
- 根据安全字段,可能需要补充额外信息。使用行中相应的单元格提供此信息:
- 单击保存(留在当前页面)或保存并进入下一步(进入下一个纳入标准选项卡)。
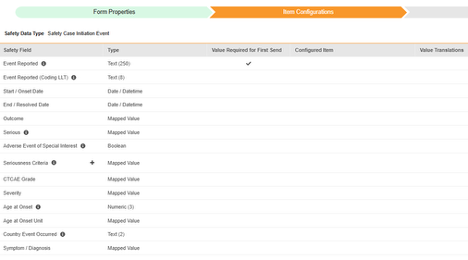
| EDC 安全数据类型 | EDC 字段标签 | 字段数据类型 | 备注 | 相关 E2B(R3)位置 | 收件箱条目/ 病例对象与字段 |
EDC 字段标识符 |
|---|---|---|---|---|---|---|
| 安全病例启动事件 | 报告的事件(Event Reported) | 文本(250) |
|
E.i.1.1a、E.i.1.2 | case_adverse_event__v、event_reported__v | AE_EVENT_REPORTED |
| 安全病例启动事件 | 报告的事件(编码 LLT)(Event Reported (Coding LLT)) | 文本(8) |
|
E.i.2.1a、E.i.2.1b | case_adverse_event__v、event_meddra__v | AE_CODING_LLT |
| 安全病例启动事件 | 开始/发生日期(Start / Onset Date) | 日期/日期时间 |
|
E.i.4 | case_adverse_event__v、onset_idate__v | AE_START_DATE |
| 安全病例启动事件 | 结束/解决日期(End / Resolved Date) | 日期 |
|
E.i.5 | case_adverse_event__v、resolved_idate__v | AE_END_DATE |
| 安全病例启动事件 | 结果(Outcome) | 映射值 |
|
E.i.7 | case_adverse_event__v、outcome__v | AE_OUTCOME |
| 安全病例启动事件 | 严重 | 映射值 |
|
E.i.3.1 | case_adverse_event__v、highlighted_term__v | AE_SERIOUS |
| 安全病例启动事件 | 特别关注的不良事件(Adverse Event of Special Interest) | 布尔值 |
|
case_adverse_event__v、aesi_watchlist__v | AE_AESI | |
| 安全病例启动事件 | 严重性标准(Seriousness Criteria) | 映射值 |
|
E.i.3.2a、E.i.3.2b、E.i.3.2c、E.i.3.2d、E.i.3.2e、E.i.3.2f | case_adverse_event__v、seriousness__v | AE_SERIOUSNESS_CRITERIA |
| 安全病例启动事件 | CTCAE 等级 | 映射值 |
|
case_adverse_event__v、ctcae_grade__v | AE_CTCAE_GRADE | |
| 安全病例启动事件 | 严重度 | 映射值 |
|
case_adverse_event__v、severity__v | AE_SEVERITY | |
| 安全病例启动事件 | 发病年龄(Age at Onset) | 数字(3) |
|
D.2.2a | case_version__v、age_value__v(age_calculation_status__v 设置为“Yes”) | AE_AGE_AT_ONSET |
| 安全病例启动事件 | 发病年龄单位(Age at Onset Unit) | 映射值 |
|
D.2.2b | case_version__v、age_unit__v | AE_AGE_AT_ONSET_UNIT |
| 安全病例启动事件 | 事件发生国家/地区(Country Event Occurred) | 文本(2) |
|
E.i.9 | case_adverse_event__v、event_country__v | AE_EVENT_COUNTRY |
| 安全病例启动事件 | 症状/诊断(Symptom / Diagnosis) | 映射值 |
|
case_adverse_event__v、symptom_diagnosis__v | AE_SYMPTOM_DIAGNOSIS | |
| 安全病例启动事件 | 加急事件(Expedited Event) | 布尔值 |
|
case_adverse_event__v、expedited_flag__v | AE_EXPEDITED_FLAG | |
| 安全病例启动事件 | 医疗专业人员已确认(Healthcare Professional Confirmed) | 布尔值 |
|
E.i.8 | case_adverse_event__v、hcp_confirmed__v | AE_HCP_CONFIRMED |
| 安全病例启动事件 | 入院日期(Hospital Admission Date) | 日期 |
|
case_adverse_event__v、hospital_admission_date__v | AE_HOSPITAL_ADM_DATE | |
| 安全病例启动事件 | 出院日期(Hospital Discharge Date) | 日期 |
|
case_adverse_event__v、hospital_discharge_date__v | AE_HOSPITAL_DISCHARGE_DATE | |
| 安全病例启动事件 | 住院天数(Days Hospitalized) | 数字(4) |
|
case_adverse_event__v、days_hospitalized__v | AE_DAYS_HOSPITALIZED | |
| 安全病例启动事件 | 医院名称(Hospital Name) | 文本(200) |
|
case_adverse_event__v、hospital_name__v | AE_HOSPITAL_NAME | |
| 安全病例启动事件 | 医院所在城市(Hospital City) | 文本(35) |
|
case_adverse_event__v、hospital_city__v | AE_HOSPITAL_CITY | |
| 安全病例启动事件 | 医院所在省份(Hospital State) | 文本(40) |
|
case_adverse_event__v、hospital_state__v | AE_HOSPITAL_STATE | |
| 安全病例启动事件 | 叙述(Narrative) | 文本(30000) |
|
H.1(作为研究中心叙述的标记) | case_version__v、site_narrative__v | AE_NARRATIVE |
| 安全病例启动事件 | 报告者评论 | 文本(20000) |
|
H.2 | case_version__v、reporters_comments__v | AE_REPORTER_COMMENTS |
| 安全病例启动事件 | 发送者评论(Sender Comments) | 文本(20000) |
|
H.4 | case_version__v、sender_comments__v | AE_SENDER_COMMENTS |
| 安全病例启动事件 | 无效原因(Nullification Reason) | 文本(200) |
|
C.1.11.2 | inbox_item__v、edc_reason__v(这仅在收件箱条目中可用,以向用户指示这是无效病例及其原因。对病例数据模型无影响。) | AE_NULLIFY_REASON |
| 安全病例启动事件 | 报告者资格认定(Reporter Qualification) | 映射值 |
|
C.2.r.4 | case_contact__v、qualification__v | AE_REPORTER_QUALIFICATION |
| 安全病例启动事件 | 已报告的语言(Reported Language) | 文本(20) |
|
E.i.1.1b | case_adverse_event__v、event_reported_language__v | AE_REPORTER_LANGUAGE |
| 安全病例启动事件 | 报告者所在的国家/地区 | 文本(2) |
|
C.2.r.3 | case_contact__v、country_value__v(如果是有效的 2 字符 ISO 国家/地区代码) | AE_REPORTER_COUNTRY |
| 安全病例启动事件 | 报告者名字(Reporter First Name) | 文本(50) |
|
C.2.r.1.2 | case_contact__v、firstname_value__v | AE_REPORTER_FIRST_NAME |
| 安全病例启动事件 | 报告者姓氏(Reporter Last Name) | 文本(50) |
|
C.2.r.1.4 | case_contact__v、lastname_value__v | AE_REPORTER_LAST_NAME |
| 安全病例启动事件 | 报告者组织 | 文本(100) |
|
C.2.r.2.1 | case_contact__v、organization_value__v | AE_REPORTER_ORGANIZATION |
| 安全病例启动事件 | 报告者的电子邮件 | 文本(100) |
|
case_contact__v、email_address__v | AE_REPORTER_EMAIL | |
| 安全病例启动事件 | 报告者的电话号码 | 文本(33) |
|
C.2.r.2.7 | case_contact__v、telephone_value__v | AE_REPORTER_TELEPHONE |
| 安全病例启动事件 | 报告者的街道 1 | 文本(100) |
|
C.2.r.2.3 | case_contact__v、street_value__v | AE_REPORTER_STREET |
| 安全病例启动事件 | 报告者的街道 2 | 文本(100) |
|
C.2.r.2.3 | case_contact__v、street_line_2_value__v | AE_REPORTER_STREET_2 |
| 安全病例启动事件 | 报告者的城市 | 文本(35) |
|
C.2.r.2.4 | case_contact__v、city_value__v | AE_REPORTER_CITY |
| 安全病例启动事件 | 报告者的州/省 | 文本(40) |
|
C.2.r.2.5 | case_contact__v、state_province_value__v | AE_REPORTER_STATE_PROVINCE |
| 安全病例启动事件 | 报告者的邮政编码/邮编 | 文本(15) |
|
C.2.r.2.6 | case_contact__v、postalcode_value__v | AE_REPORTER_POSTAL_ZIP |
| 安全病例启动事件 | 采取的总体行动(Overall Action Taken) | 映射值 |
|
G.k.8 | , | AE_ACTION_TAKEN |
| 安全病例启动事件 | 伴随用药的药物角色(Concomitant Medication Drug Role) | 映射值 |
|
G.k.1 | case_product__v、drug_role__v | |
| 安全病例启动事件 | 对研究产品采取的行动 | 映射值 |
|
G.k.8 | case_assessment_result__v、action_taken__v | AE_PRODUCT_ACTION_TAKEN |
| 安全病例启动事件 | 研究药物恢复时反应/事件是否再次出现(Did Reaction / Event Recur when Study Drug Resumed) | 映射值 |
|
G.k.9.i.4 | case_assessment__v、reaction_recurrence__v | AE_PRODUCT_ACTION_RECUR |
| 安全病例启动事件 | 研究药物的评估结果(Result of Assessment to Study Drug) | 映射值 |
|
G.k.9.i.2.r.3 | case_assessment_result__v、assessment_result__v 或 result_text__v | AE_PRODUCT_ASSESS_RESULT |
| 安全病例启动事件 | 研究药物的评估方法(Method of Assessment to Study Drug) | 文本(60) |
|
G.k.9.i.2.r.2 | case_assessment_result__v、method_of_assessment__v 或 method_text__v | AE_PRODUCT_ASSESS_METHOD |
| 安全病例启动事件 | 研究药物的评估来源(Source of Assessment to Study Drug) | 文本(60) |
|
G.k.9.i.2.r.1 | case_assessment_result__v、source_type__v 或 source_text__v | AE_PRODUCT_ASSESS_SOURCE |
| 安全病例启动事件 | 妊娠病例(Pregnancy Case) | 布尔值 |
|
case_version__v、pregnancy__v | AE_PREG_CASE | |
| 安全病例启动事件 | 妊娠事件 | 数字(2) |
|
case_version__v、gravida_gravidity__v | AE_PREG_INFO_GRAV | |
| 安全病例启动事件 | 出生数量(Number Given Birth) | 数字(2) |
|
case_version__v、para_parity__v | AE_PREG_INFO_PARA | |
| 安全病例启动事件 | 研究药物暴露时怀孕(Pregnant at Study Drug Exposure) | 布尔值 |
|
case_version__v、pregnancy_at_vaccination__v | AE_PREG_INFO_AT_VX | |
| 安全病例启动事件 | 末次月经日期(妊娠病例)(Last Menstrual Date (Pregnancy Case)) | 日期 |
|
D.6 | case_version__v、last_menstrual_idate__v | AE_PREG_LAST_MENSTRUAL_DATE |
| 安全病例启动事件 | 怀孕日期(Pregnancy Conception Date) | 日期 |
|
case_version__v、pregnancy_conception_idate__v | AE_PREG_INFO_CONC_DT | |
| 安全病例启动事件 | 预产期(Pregnancy Due Date) | 日期 |
|
case_version__v、pregnancy_due_idate__v | AE_PREG_INFO_DUE_DT | |
| 安全病例启动事件 | 怀孕结局日期(Date of Pregnancy Outcome) | 日期 |
|
case_version__v、idate_of_pregnancy_outcome__v | AE_PREG_INFO_OUTCOME_DT | |
| 安全病例启动事件 | 怀孕结局(Pregnancy Outcome) | 映射值 |
|
case_version__v、pregnancy_outcome__v | AE_PREG_INFO_OUTCOME | |
| 安全病例启动事件 | 分娩方式(Delivery Method) | 映射值 |
|
case_version__v、delivery_method__v | AE_PREG_INFO_DELV_METH |
研究药物
此安全数据类型用于跟踪研究药物的剂量/配药信息,即临床研究中用于受试者的测试药物。相关信息将同步至 Veeva Safety 的产品/产品剂量部分。以下示例展示了两种药物。
目前,研究药物的名称在工作室的表单属性选项卡中配置。未来版本将支持药物名称的条目配置。
重要的“药物分类”不是在此类型的 EDC 表单上映射的条目。相反,当在事件开始日期或之前至少存在一个分发表单时,系统会将其设置为“可疑”。如果没有任何分发记录,系统将使用“未给药”。
此安全数据类型的条目配置步骤如下:
- 导航到工作室 > 表单配置中的研究。
-
对于要映射的每一行,使用配置条目列中的单元格选择适当的条目定义。例如,从表单中选择 SD_START_DATE 条目用于开始日期位置(如下图)。条目选择的选项通常取决于先前保存的“表单属性”>“以下范围内的每个条目”设置。一些安全位置有特殊规则,表明它们只能在重复或非重复条目组中配置,或者有时两者都可以。请参阅这些步骤末尾的表格以了解这些特殊情况,以及有关此类型所有安全位置的重要说明。
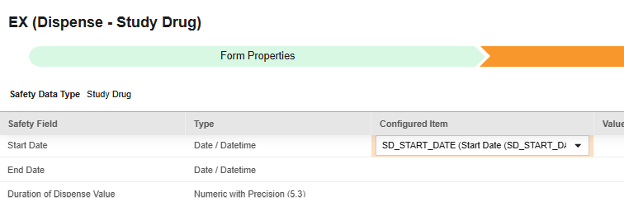
- 根据配置条目和安全字段的数据类型,可能需要配置值转换。有关说明,请参阅上文“值转换”章节。
- 根据安全字段,可能需要补充额外信息。使用行中相应的单元格提供此信息:
- 单击保存(留在当前页面)或保存并进入下一步(进入下一个纳入标准选项卡)。
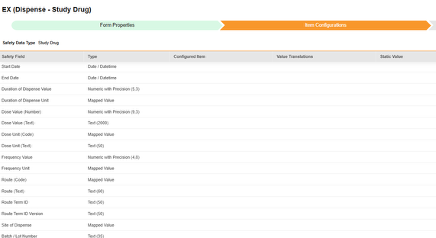
| EDC 安全数据类型 | EDC 字段标签 | 字段数据类型 | 备注 | 相关 E2B(R3)位置 | 收件箱条目/ 病例对象与字段 |
EDC 字段标识符 |
|---|---|---|---|---|---|---|
| 研究药物 | 开始日期 | 日期/日期时间 |
|
G.k.4.r.4 | case_product_dosage__v、firstadmin_idate__v | SD_START_DATE |
| 研究药物 | 结束日期(End Date) | 日期/日期时间 |
|
G.k.4.r.5 | case_product_dosage__v、lastadmin_idate__v | SD_END_DATE |
| 研究药物 | 配药持续时间值(Duration of Dispense Value) | 精确数字(5,3) |
|
G.k.4.r.6a | case_product_dosage__v、duration_number__v | SD_DURATION_VALUE |
| 研究药物 | 配药持续时间单位(Duration of Dispense Unit) | 映射值 |
|
G.k.4.r.6b | case_product_dosage__v、duration_unit__v | SD_DURATION_UNIT |
| 研究药物 | 剂量值(数字)(Dose Value (Number)) | 精确数字(9,3) |
|
G.k.4.r.1a | case_product_dosage__v、dose_number__v | SD_DOSE_VALUE_NUMBER |
| 研究药物 | 剂量值(文本)(Dose Value (Text)) | 文本(2000) |
|
G.k.4.r.8 | case_product_dosage__v、dose_text_long_text__v | SD_DOSE_VALUE_TEXT |
| 研究药物 | 剂量单位(编码)(Dose Unit (Code)) | 映射值 |
|
G.k.4.r.1b | case_product_dosage__v、dose_unit__v | SD_DOSE_UNIT_CODE |
| 研究药物 | 剂量单位(文本)(Dose Unit (Text)) | 文本(50) |
|
G.k.4.r.8 | case_product_dosage__v、dose_unit_text__v | SD_DOSE_UNIT_TEXT |
| 研究药物 | 频率值(Frequency Value) | 精确数字(4,8) |
|
G.k.4.r.2 | case_product_dosage__v、frequency_number__v | SD_FREQUENCY_VALUE |
| 研究药物 | 频率单位(Frequency Unit) | 映射值 |
|
G.k.4.r.3 | case_product_dosage__v、frequency_unit__v | SD_FREQUENCY_UNIT |
| 研究药物 | 途径(编码)(Route (Code)) | 映射值 |
|
G.k.4.r.10.2b | case_product_dosage__v、patient_adminroute__v | SD_ROUTE_CODE |
| 研究药物 | 途径(文本)(Route (Text)) | 文本(60) |
|
G.k.4.r.10.1 | case_product_dosage__v、patient_adminroute_text__v | SD_ROUTE_TEXT |
| 研究药物 | 途径术语 ID(Route Term ID) | 文本(50) |
|
G.k.4.r.10.2b | case_product_dosage__v、patient_adminroute_termid__v | SD_ROUTE_TERM_ID |
| 研究药物 | 途径术语 ID 版本(Route Term ID Version) | 文本(50) |
|
G.k.4.r.10.2a | case_product_dosage__v、patient_adminroute_termid_version__v | SD_ROUTE_TERM_ID_VERSION |
| 研究药物 | 配药研究中心(Site of Dispense) | 映射值 |
|
case_product_dosage__v、anatomical_site__v | SD_SITE_OF_DISPENSE | |
| 研究药物 | 批次/批号(Batch / Lot Number) | 文本(35) |
|
G.k.4.r.7 | case_product_dosage__v、batchlot_number__v | SD_BATCH_LOT_NUMBER |
| 研究药物 | 剂型术语 ID(Dose Form Term ID) | 文本(50) |
|
G.k.4.r.9.2b | case_product_dosage__v、dose_form_termid__v | SD_DOSE_FORM_TERM_ID |
| 研究药物 | 剂型术语 ID 版本(Dose Form Term ID Version) | 文本(50) |
|
G.k.4.r.9.2a | case_product_dosage__v、dose_form_termid_version__v | SD_DOSE_FORM_TERM_ID_VERSION |
| 研究药物 | 剂型文本(Dose Form Text) | 文本(128) |
|
G.k.4.r.9.1 | case_product_dosage__v、dose_form_text__v | SD_DOSE_FORM_TEXT |
| 研究药物 | 父级途径(文本)(Parent Route (Text)) | 文本(60) |
|
G.k.4.r.11.1 | case_product_dosage__v、parent_adminroute_text__v | SD_PARENT_ROUTE_TEXT |
| 研究药物 | 父级途径(编码)(Parent Route (Code)) | 映射值 |
|
G.k.4.r.11.2b | case_product_dosage__v、parent_adminroute__v | SD_PARENT_ROUTE_CODE |
| 研究药物 | 父级途径术语 ID(Parent Route Term ID) | 文本(50) |
|
G.k.4.r.11.2b | case_product_dosage__v、parent_adminroute_termid__v | SD_PARENT_ROUTE_TERM_ID |
| 研究药物 | 父级途径术语 ID 版本(Parent Route Term ID Version) | 文本(50) |
|
G.k.4.r.11.2a | case_product_dosage__v、parent_adminroute_termid_version__v | SD_PARENT_ROUTE_TERM_ID_VERSION |
伴随用药
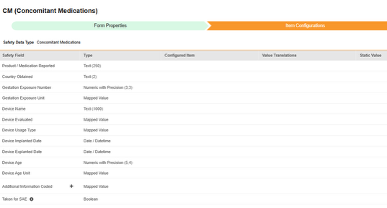
此类安全配置适用于研究中的伴随用药表单。相关信息将同步至 Veeva Safety 的产品/产品剂量部分。
此安全数据类型的条目配置步骤如下:
- 导航到工作室 > 表单配置中的研究。
-
对于要映射的每一行,使用配置条目列中的单元格选择适当的条目定义。例如,从表单中选择 CMTRT 条目用于报告的产品/药物位置(如下图)。条目选择的选项通常取决于先前保存的“表单属性”>“以下范围内的每个条目”设置。一些安全位置有特殊规则,表明它们只能在重复或非重复条目组中配置,或者有时两者都可以。请参阅这些步骤末尾的表格以了解这些特殊情况,以及有关此类型所有安全位置的重要说明。
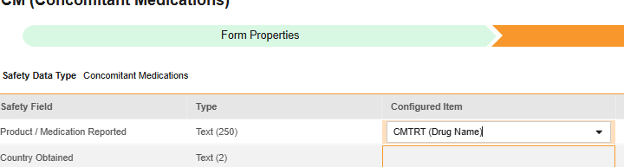
- 根据配置条目和安全字段的数据类型,可能需要配置值转换。有关说明,请参阅上文“值转换”章节。
- 单击保存(留在当前页面)或保存并进入下一步(进入下一个纳入标准选项卡)。
| EDC 安全数据类型 | EDC 字段标签 | 字段数据类型 | 备注 | 相关 E2B(R3)位置 | 收件箱条目/ 病例对象与字段 |
EDC 字段标识符 |
|---|---|---|---|---|---|---|
| 伴随用药 | 报告的产品/药物(Product / Medication Reported) | 文本(250) |
|
G.k.2.2 | case_product__v、product_reported__v | CM_REPORTED |
| 伴随用药 | 来源国家/地区(Country Obtained) | 文本(2) |
|
G.k.2.4 | case_product__v、country_obtained__v | CM_COUNTRY_OBTAINED |
| 伴随用药 | 妊娠期暴露量(Gestation Exposure Number) | 精确数字(3,3) |
|
G.k.6a | case_product__v、gestation_exposure_number__v | CM_GESTATION |
| 伴随用药 | 妊娠期暴露单位 | 映射值 |
|
G.k.6b | case_product__v、gestation_exposure_unit__v | CM_GESTATION_UNIT |
| 伴随用药 | 设备名称 | 文本(1000) |
|
case_product__v、device_name_part__v | CM_DEVICE_NAME | |
| 伴随用药 | 评估的器械(Device Evaluated) | 映射值 |
|
case_product__v、device_evaluated__v | CM_DEVICE_EVALUATED | |
| 伴随用药 | 器械使用类型(Device Usage Type) | 映射值 |
|
case_product__v、device_usage_type__v | CM_DEVICE_USAGE_TYPE | |
| 伴随用药 | 器械植入日期(Device Implanted Date) | 日期/日期时间 |
|
case_product__v、date_implanted_idate__v | CM_IMPLANTED_DATE | |
| 伴随用药 | 器械外植日期(Device Explanted Date) | 日期/日期时间 |
|
case_product__v、date_explanted_idate__v | CM_DEVICE_EXPLANTED_DATE | |
| 伴随用药 | 器械年限(Device Age) | 精确数字(5,4) |
|
case_product__v、date_age__v | CM_DEVICE_AGE | |
| 伴随用药 | 设备年限单位 | 映射值 |
|
case_product__v、device_age_unit__v | CM_DEVICE_AGE_UNIT | |
| 伴随用药 | 编码的其他信息(Additional Information Coded) | 映射值 |
|
G.k.10.r | case_product__v、additional_information_coded__v | CM_ADDITIONAL_INFO_CODED |
| 伴随用药 | 开始日期 | 日期/日期时间 |
|
G.k.4.r.4 | case_product_dosage__v、firstadmin_idate__v | CM_START_DATE |
| 伴随用药 | 结束日期(End Date) | 日期/日期时间 |
|
G.k.4.r.5 | case_product_dosage__v、lastadmin_idate__v | CM_END_DATE |
| 伴随用药 | 配药持续时间值(Duration of Dispense Value) | 精确数字(5,3) |
|
G.k.4.r.6a | case_product_dosage__v、duration_number__v | CM_DURATION_VALUE |
| 伴随用药 | 配药持续时间单位(Duration of Dispense Unit) | 映射值 |
|
G.k.4.r.6b | case_product_dosage__v、duration_unit__v | CM_DURATION_UNIT |
| 伴随用药 | 剂量值(数字)(Dose Value (Number)) | 精确数字(9,3) |
|
G.k.4.r.1a | case_product_dosage__v、dose_number__v | CM_DOSE_VALUE_NUMBER |
| 伴随用药 | 剂量值(文本)(Dose Value (Text)) | 文本(2000) |
|
G.k.4.r.8 | case_product_dosage__v、dose_text__v | CM_DOSE_VALUE_TEXT |
| 伴随用药 | 剂量单位(编码)(Dose Unit (Code)) | 映射值 |
|
G.k.4.r.1b | case_product_dosage__v、dose_unit__v | CM_DOSE_UNIT_CODE |
| 伴随用药 | 剂量单位(文本)(Dose Unit (Text)) | 文本(50) |
|
G.k.4.r.8 | case_product_dosage__v、dose_unit_text__v | CM_DOSE_UNIT_TEXT |
| 伴随用药 | 频率值(Frequency Value) | 精确数字(4,8) |
|
G.k.4.r.2 | case_product_dosage__v、frequency_number__v | CM_FREQUENCY_VALUE |
| 伴随用药 | 频率单位(Frequency Unit) | 映射值 |
|
G.k.4.r.3 | case_product_dosage__v、frequency_unit__v | CM_FREQUENCY_UNIT |
| 伴随用药 | 途径(编码)(Route (Code)) | 映射值 |
|
G.k.4.r.10.2b | case_product_dosage__v、patient_adminroute__v | CM_ROUTE_CODE |
| 伴随用药 | 途径(文本)(Route (Text)) | 文本(60) |
|
G.k.4.r.10.1 | case_product_dosage__v、patient_adminroute_text__v | CM_ROUTE_TEXT |
| 伴随用药 | 途径术语 ID(Route Term ID) | 文本(50) |
|
G.k.4.r.10.2b | case_product_dosage__v、patient_adminroute_termid__v | CM_ROUTE_TERM_ID |
| 伴随用药 | 途径术语 ID 版本(Route Term ID Version) | 文本(50) |
|
G.k.4.r.10.2a | case_product_dosage__v、patient_adminroute_termid_version__v | CM_ROUTE_TERM_ID_VERSION |
| 伴随用药 | 配药研究中心(Site of Dispense) | 映射值 |
|
case_product_dosage__v、anatomical_site__v | CM_SITE_OF_DISPENSE | |
| 伴随用药 | 批次/批号(Batch / Lot Number) | 文本(35) |
|
G.k.4.r.7 | case_product_dosage__v、batchlot_number__v | CM_BATCH_LOT_NUMBER |
| 伴随用药 | 剂型术语 ID(Dose Form Term ID) | 文本(50) |
|
G.k.4.r.9.2a | case_product_dosage__v、dose_form_termid__v | CM_DOSE_FORM_TERM_ID |
| 伴随用药 | 剂型术语 ID 版本(Dose Form Term ID Version) | 文本(50) |
|
G.k.4.r.9.1 | case_product_dosage__v、dose_form_termid_version__v | CM_DOSE_FORM_TERM_ID_VERSION |
| 伴随用药 | 剂型(文本)(Dose Form (Text)) | 文本(50) |
|
G.k.4.r.9.2b | case_product_dosage__v、dose_form_text__v | CM_DOSE_FORM_TEXT |
| 伴随用药 | 父级途径(文本)(Parent Route (Text)) | 文本(60) |
|
G.k.4.r.11.1 | case_product_dosage__v、parent_adminroute_text__v | CM_PARENT_ROUTE_TEXT |
| 伴随用药 | 父级途径(编码)(Parent Route (Code)) | 映射值 |
|
G.k.4.r.11.2b | case_product_dosage__v、parent_adminroute__v | CM_PARENT_ROUTE_CODE |
| 伴随用药 | 父级途径术语 ID(Parent Route Term ID) | 文本(50) |
|
G.k.4.r.11.2b | case_product_dosage__v、parent_adminroute_termid__v | CM_PARENT_ROUTE_TERM_ID |
| 伴随用药 | 父级途径术语 ID 版本(Parent Route Term ID Version) | 文本(50) |
|
G.k.4.r.11.2a | case_product_dosage__v、parent_adminroute_termid_version__v | CM_PARENT_ROUTE_TERM_ID_VERSION |
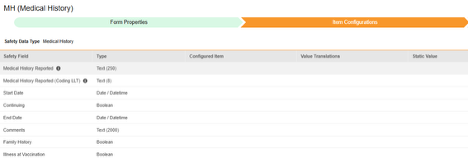
病史
此类安全配置适用于研究中的病史表单。相关信息将同步至 Veeva Safety 的病史和并发症(Medical History & Concurrent Conditions)部分。
此安全数据类型的条目配置步骤如下:
- 导航到工作室 > 表单配置中的研究。
-
对于要映射的每一行,使用配置条目列中的单元格选择适当的条目定义。例如,从表单中选择 MHTERM 条目用于报告的病史位置(如下图)。条目选择的选项通常取决于先前保存的“表单属性”>“以下范围内的每个条目”设置。一些安全位置有特殊规则,表明它们只能在重复或非重复条目组中配置,或者有时两者都可以。请参阅这些步骤末尾的表格以了解这些特殊情况,以及有关此类型所有安全位置的重要说明。
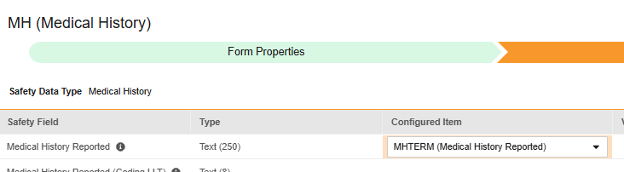
- 根据配置条目和安全字段的数据类型,可能需要配置值转换。有关说明,请参阅上文“值转换”章节。
- 单击保存(留在当前页面)或保存并进入下一步(进入下一个纳入标准选项卡)。
| EDC 安全数据类型 | EDC 字段标签 | 字段数据类型 | 备注 | 相关 E2B(R3)位置 | 收件箱条目/ 病例对象与字段 |
EDC 字段标识符 |
|---|---|---|---|---|---|---|
| 病史 | 报告的病史(Medical History Reported) | 文本(250) |
|
D.7.1.r.5(术语通常从注释中报告) | case_medical_history__v、name_reported__v | MH_REPORTED |
| 病史 | 报告的病史(编码 LLT)(Medical History Reported (Coding LLT)) | 文本(8) |
|
D.7.1.r.1a / D.7.1.r.1b | case_medical_history__v、name_meddra__v | MH_REPORTED_LLT |
| 病史 | 开始日期 | 日期/日期时间 |
|
D.7.1.r.2 | case_medical_history__v、startdate_idate__v | MH_START_DATE |
| 病史 | 继续 | 布尔值 |
|
D.7.1.r.3 | case_medical_history__v、continuing_value__v | MH_CONTINUING |
| 病史 | 结束日期(End Date) | 日期/日期时间 |
|
D.7.1.r.4 | case_medical_history__v、enddate_idate__v | MH_END_DATE |
| 病史 | 备注 | 文本(2000) |
|
D.7.1.r.5 | case_medical_history__v、comments__v | MH_COMMENTS |
| 病史 | 家族史 | 布尔值 |
|
D.7.1.r.6 | case_medical_history__v、family_history__v | MH_FAMILY_HISTORY |
| 病史 | 接种疫苗时的疾病(Illness at Vaccination) | 布尔值 |
|
case_medical_history__v、illness_at_vaccination__v | MH_ILLNESS_AT_VACCINATION |
药物史
此类安全配置适用于研究中的药物史表单。相关信息将同步至 Veeva Safety 的药物史(Drug History)部分。
此安全数据类型的条目配置步骤如下:
- 导航到工作室 > 表单配置中的研究。
-
对于要映射的每一行,使用配置条目列中的单元格选择适当的条目定义。例如,从表单中选择 DH_REPORTED 条目用于报告的药物史位置(如下图)。条目选择的选项通常取决于先前保存的“表单属性”>“以下范围内的每个条目”设置。一些安全位置有特殊规则,表明它们只能在重复或非重复条目组中配置,或者有时两者都可以。请参阅这些步骤末尾的表格以了解这些特殊情况,以及有关此类型所有安全位置的重要说明。
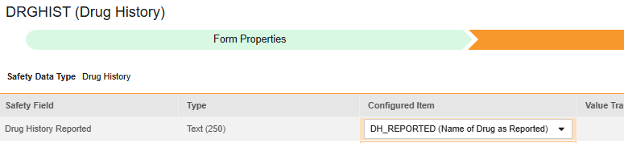
- 根据配置条目和安全字段的数据类型,可能需要配置值转换。有关说明,请参阅上文“值转换”章节。
- 单击保存(留在当前页面)或保存并进入下一步(进入下一个纳入标准选项卡)。
| EDC 安全数据类型 | EDC 字段标签 | 字段数据类型 | 备注 | 相关 E2B(R3)位置 | 收件箱条目/ 病例对象与字段 |
EDC 字段标识符 |
|---|---|---|---|---|---|---|
| 药物史 | 报告的药物史(Drug History Reported) | 文本(250) |
|
D.8.r.1 | case_drug_history__v、name_reported__v | DH_REPORTED |
| 药物史 | 开始日期 | 日期/日期时间 |
|
D.8.r.4 | case_drug_history__v、startdate_idate__v | DH_START_DATE |
| 药物史 | 结束日期(End Date) | 日期/日期时间 |
|
D.8.r.5 | case_drug_history__v、enddate_idate__v | DH_END_DATE |
| 药物史 | 接种疫苗时的年龄/使用(Age at Vaccination / Use) | 数字(3) |
|
case_drug_history__v、age_at_vaccination_number__v | DH_AGE_AT_USE | |
| 药物史 | 接种疫苗时的年龄/使用单位(Age At Vaccination / Use Unit) | 映射值 |
|
case_drug_history__v、age_at_vaccination_unit__v | DH_AGE_AT_USE_UNIT | |
| 药物史 | 产品类型(Product Type) | 映射值 |
|
case_drug_history__v、product_type__v | DH_PRODUCT_TYPE | |
| 药物史 | 报告的适应症(Indication Reported) | 文本(250) |
|
D.8.r.6a、D.8.r.6b | case_drug_history__v、indication_reported__v | DH_INDICATION |
| 药物史 | 报告的反应(Reaction Reported) | 文本(250) |
|
D.8.r.7a、D.8.r.7b | case_drug_history__v、reaction_reported__v | DH_REACTION |
测试结果
此类安全配置适用于研究中的实验室/测试结果表单。相关信息将同步至 Veeva Safety 的测试结果部分。
此安全数据类型的条目配置步骤如下:
- 导航到工作室 > 表单配置中的研究。
-
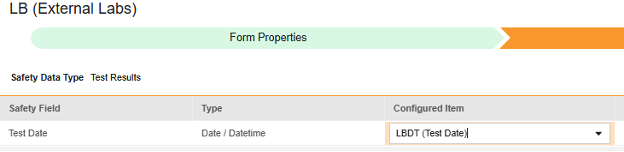
对于要映射的每一行,使用配置条目列中的单元格选择适当的条目定义。例如,从表单中选择 LBDT 条目用于测试日期位置(如下图)。条目选择的选项通常取决于先前保存的“表单属性”>“以下范围内的每个条目”设置。一些安全位置有特殊规则,表明它们只能在重复或非重复条目组中配置,或者有时两者都可以。请参阅这些步骤末尾的表格以了解这些特殊情况,以及有关此类型所有安全位置的重要说明。
- 根据配置条目和安全字段的数据类型,可能需要配置值转换。有关说明,请参阅上文“值转换”章节。
- 单击保存(留在当前页面)或保存并进入下一步(进入下一个纳入标准选项卡)。
| EDC 安全数据类型 | EDC 字段标签 | 字段数据类型 | 备注 | 相关 E2B(R3)位置 | 收件箱条目/ 病例对象与字段 |
EDC 字段标识符 |
|---|---|---|---|---|---|---|
| 测试结果 | 检查日期(Test Date) | 日期/日期时间 |
|
F.r.1 | case_test_result__v、date_idate__v | LAB_DATE |
| 测试结果 | 测试名称 | 文本(250) |
|
F.r.2.1 | case_test_result__v、name_reported__v | LAB_TEST_NAME |
| 测试结果 | 测试名称(编码 LLT)(Test Name (Coding LLT)) | 文本(8) |
|
F.r.2.2a、F.r.2.2b | case_test_result__v、name_meddra__v | LAB_TEST_NAME_MEDDRA |
| 测试结果 | 测试结果(数字)(Test Result (Numeric)) | 精确数字(14,3) |
|
F.r.3.2 | case_test_result__v、result_value__v | LAB_RESULT_NUMERIC |
| 测试结果 | 测试单位(Test Unit) | 映射值 |
|
F.r.3.3 | case_test_result__v、result_unit__v | LAB_RESULT_UNIT |
| 测试结果 | 测试结果(编码)(Test Result (Code)) | 映射值 |
|
F.r.3.1 | case_test_result__v、result_code__v | LAB_TEST_RESULT_CODE |
| 测试结果 | 测试结果(文本)(Test Result (Text)) | 文本(2000) |
|
F.r.3.4 | case_test_result__v、restult_text__v | LAB_RESULT_TEXT |
| 测试结果 | 测试结果(限定符)(Test Result (Qualifier)) | 映射值 |
|
F.r.3.2 | case_test_result__v、result_qualifier__v | LAB_RESULT_QUALIFIER |
| 测试结果 | 测试正常值下限(Test Normal Low Value) | 文本(50) |
|
F.r.4 | case_test_result__v、normal_low_value__v | LAB_LOW_VALUE |
| 测试结果 | 测试正常值上限(Test Normal High Value) | 文本(50) |
|
F.r.5 | case_test_result__v、normal_high_value__v | LAB_HIGH_VALUE |
| 测试结果 | 测试备注(Test Comments) | 文本(2000) |
|
F.r.6 | case_test_result__v、comments__v | LAB_COMMENTS |
| 测试结果 | 提供更多信息(More Information Available) | 布尔值 |
|
F.r.7 | case_test_result__v、more_information_available__v | LAB_MORE_INFO_AVAILABLE |
患者特征
此类安全配置适用于记录受试者一般信息的表单。相关信息将同步至 Veeva Safety 的患者(Patient)部分。
此安全数据类型的条目配置步骤如下:
- 导航到工作室 > 表单配置中的研究。
-
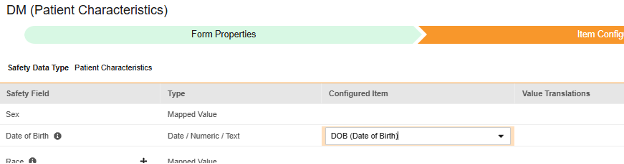
对于要映射的每一行,使用配置条目列中的单元格选择适当的条目定义。例如,从表单中选择 DOB 条目用于出生日期位置(如下图)。条目选择的选项通常取决于先前保存的“表单属性”>“以下范围内的每个条目”设置。一些安全位置有特殊规则,表明它们只能在重复或非重复条目组中配置,或者有时两者都可以。请参阅这些步骤末尾的表格以了解这些特殊情况,以及有关此类型所有安全位置的重要说明。
- 根据配置条目和安全字段的数据类型,可能需要配置值转换。有关说明,请参阅上文“值转换”章节。
- 单击保存(留在当前页面)或保存并进入下一步(进入下一个纳入标准选项卡)。
| EDC 安全数据类型 | EDC 字段标签 | 字段数据类型 | 备注 | 相关 E2B(R3)位置 | 收件箱条目/ 病例对象与字段 |
EDC 字段标识符 |
|---|---|---|---|---|---|---|
| 患者特征 | 性别(Gender) | 映射值 |
|
D.5 | case_version__v、gender_value__v | |
| 患者特征 | 出生日期(Date of Birth) | 日期/数字/文本 |
|
D.2.1 | case_version__v、dob_idate__v | PC_DOB |
| 患者特征 | 种族(Race) | 映射值 |
|
case_version__v、race__v | PC_RACE | |
| 患者特征 | 民族(Ethnicity) | 映射值 |
|
case_version__v、ethnicity__v | PC_ETHNICITY | |
| 患者特征 | 年龄组(Age Group) | 映射值 |
|
D.2.3 | case_version__v、age_group__v | PC_AGE_GROUP |
| 患者特征 | 发生 SAE 时的年龄(Age at SAE) | 数字(3) |
|
D.2.2a | case_version__v、age_value__v | PC_AGE_VALUE |
| 患者特征 | 发生 SAE 年龄时的单位(Age at SAE Unit) | 映射值 |
|
D.2.2b | case_version__v、age_unit__v | PC_AGE_UNIT |
| 患者特征 | 接种疫苗时的年龄(Age at Vaccination) | 数字(3) |
|
case_version__v、age_at_vaccination_number__v | PC_AGE_AT_VX | |
| 患者特征 | 接种疫苗时的年龄单位(Age at Vaccination Unit) | 映射值 |
|
case_version__v、age_at_vaccination_unit__v | PC_AGE_AT_VX_UNIT | |
| 患者特征 | 妊娠期值 | 数字(3) |
|
D.2.2.1a | case_version__v、gestation_value__v | PC_GESTATION |
| 患者特征 | 妊娠期单位(Gestation Unit) | 映射值 |
|
D.2.2.1b | case_version__v、gestation_unit__v | PC_GESTATION_UNIT |
| 患者特征 | 体重(公斤)(Weight (kg)) | 精确数字(4,4) |
|
D.3 | case_version__v、weight_normalized__kg__v | PC_WEIGHT_KG |
| 患者特征 | 身高(cm) | 精确数字(4,3) |
|
D.4 | case_version__v、height_normalized__cm__v | PC_HEIGHT_CM |
| 患者特征 | 患者姓名或姓名缩写(Patient Name or Initials) | 文本(60) |
|
D.1 | case_version__v、patient_id_value__v | PC_NAME_OR_INITIALS |
| 患者特征 | GP 病历编号(GP Medical Record Number) | 文本(20) |
|
D.1.1.1 | case_version__v、mrn_gp_value__v | PC_GPRN |
| 患者特征 | 医院记录编号(Hospital Record Number) | 文本(20) |
|
D.1.1.3 | case_version__v、mrn_hospital_value__v | PC_HRN |
| 患者特征 | 试验记录编号 | 文本(20) |
|
D.1.1.4 | case_version__v、mrn_investigation_value__v | PC_IRN |
| 患者特征 | 专家记录编号(Specialist Record Number) | 文本(20) |
|
D.1.1.2 | case_version__v、mrn_specialist__value | PC_SRN |
| 患者特征 | 随机化编号(Randomization Number) | 文本(20) |
|
case_version__v、patient_randomization_number__v | PC_RAND_NUM | |
| 患者特征 | 末次月经日期(Last Menstrual Date) | 日期 |
|
D.6 | case_version__v、last_menstrual_date | PC_LAST_MENSTRUAL_DATE |
| 患者特征 | 妊娠事件 | 数字(2) |
|
case_version__v、gravida_gravidity__v | ||
| 患者特征 | 出生数量(Number Given Birth) | 数字(2) |
|
case_version__v、para_parity__v | AE_PREG_INFO_PARA | |
| 患者特征 | 发生 SAE 时怀孕(Pregnant at SAE) | 布尔值 |
|
case_version__v、pregnancy_case__v | PC_PREG_CASE | |
| 患者特征 | 接种疫苗时怀孕(Pregnant at Vaccination) | 布尔值 |
|
case_version__v、pregnant_at_vaccination__v | PC_PREG_AT_VX | |
| 患者特征 | 怀孕日期(Pregnancy Conception Date) | 日期 |
|
case_version__v、pregnancy_conception_date__v | AE_PREG_INFO_CON_DT | |
| 患者特征 | 预产期(Pregnancy Due Date) | 日期 |
|
case_version__v、pregnancy_due_date__v | AE_PREG_INFO_DUE_DT | |
| 患者特征 | 怀孕结局(Pregnancy Outcome) | 映射值 |
|
case_version__v、pregnancy_outcome__v | AE_PREG_INFO_OUTCOME | |
| 患者特征 | 分娩方式(Delivery Method) | 映射值 |
|
case_version__v、delivery_method__v | AE_PREG_INFO_DELV_METH | |
| 患者特征 | 怀孕结局日期(Date of Pregnancy Outcome) | 日期 |
|
case_version__v、date_of_pregnancy_outcome__v | AE_PREG_INFO_OUTCOME_DT | |
| 患者特征 | 父级受试者编号 | 文本(128) |
|
case_version__v、parent_subject_number__v | PC_PARENT_SUBNUM | |
| 患者特征 | 一般病史(General Medical History) | 文本(10000) |
|
D.7.2 | case_version__v、medical_history_text__v | PC_MH_TEXT |
| 患者特征 | 受试者接受伴随治疗(Subject had Concomitant Therapies) | 布尔值 |
|
, | PC_CON_THERAPY |
如果死亡
此类安全配置适用于记录受试者死亡详情的表单。该类型的部分字段必须为非重复型(例如死亡日期),其他字段可为重复型或非重复型(例如死亡原因)。相关信息将同步至 Veeva Safety 的两个位置:患者或死亡原因(Causes of Death)。
此安全数据类型的条目配置步骤如下:
- 导航到工作室 > 表单配置中的研究。
-
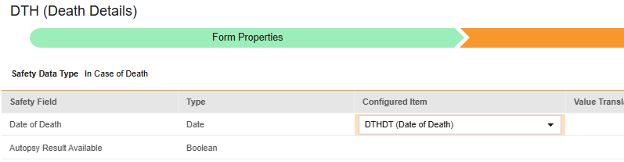
对于要映射的每一行,使用配置条目列中的单元格选择适当的条目定义。例如,从表单中选择 DTHDT 条目用于死亡日期位置(如下图)。条目选择的选项通常取决于先前保存的“表单属性”>“以下范围内的每个条目”设置。一些安全位置有特殊规则,表明它们只能在重复或非重复条目组中配置,或者有时两者都可以。请参阅这些步骤末尾的表格以了解这些特殊情况,以及有关此类型所有安全位置的重要说明。
- 根据配置条目和安全字段的数据类型,可能需要配置值转换。有关说明,请参阅上文“值转换”章节。
- 完成后,单击保存或保存并进入下一步,进入”纳入标准“步骤。
| EDC 安全数据类型 | EDC 字段标签 | 字段数据类型 | 备注 | 相关 E2B(R3)位置 | 收件箱条目/ 病例对象与字段 |
EDC 字段标识符 |
|---|---|---|---|---|---|---|
| 如果死亡 | 死亡日期(Date of Death) | 日期 |
|
D.9.1 | case_version__v、dod_idate__v | ICD_DEATH_DT |
| 如果死亡 | 尸检结果可用(Autopsy Result Available) | 布尔值 |
|
D.9.3 | case_version__v、autopsy_value__v | ICD_AUTOPSY_RES |
| 如果死亡 | 尸检结果省略原因(Reason Autopsy Result Omitted) | 映射值 |
|
case_version__v、autopsy_reason_omitted__v | ICD_AUTOPSY_REAS_OMIT | |
| 如果死亡 | 死因 - 类型(Cause of Death - Type) | 映射值 |
|
D.9.2.r、D.9.4.r | case_cause_of_death__v、type__v | ICD_CASE_TYPE |
| 如果死亡 | 死因 - 已报告(Cause of Death - Reported) | 文本(250) |
|
D.9.2.r、D.9.4.r | case_cause_of_death__v、name_reported__v | ICD_CAUSE_REPORTED |
| 如果死亡 | 死因 - 已报告(编码 LLT)(Cause of Death - Reported (Coding LLT)) | 文本(8) |
|
D.9.2.r、D.9.4.r | case_cause_of_death__v、name_meddra__v | ICD_CAUSE_LLT |
纳入标准
纳入标准经过评估,用于确定在超出触发安全病例数据传输的主要事件之外,是否将已映射的条目值纳入安全病例的范围。
说明/概念:
- 仅满足以下条件时,系统才会评估纳入标准:
- “表单属性”选项卡中所有纳入标准(尤其是“安全关键条目”)均判定为“真”
- (并且)
- “条目配置”选项卡中,必填条目在 EDC 表单中已填写非空值
- “表单属性”选项卡中所有纳入标准(尤其是“安全关键条目”)均判定为“真”
- 附加条件可包括特定类型的所有表单、基于研究中心用户操作(链接)和/或基于日期比较。这些配置可因类型、具体表单和/或研究不同而有所差异。
- “纳入标准”选项卡中的判定条件为“或”逻辑:只要一系列适用条件中的任何一个为“真”,即判定为“纳入”,无论其他条件是否为“假”(“排除”)。
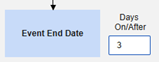
- 如果配置了与安全病例启动事件的结束日期进行比较以纳入病例,但数据录入屏幕上未设置该日期,系统会将事件的结束日期视为开放式截止日期用于评估。一旦主要事件(或相关表单)输入了结束日期,系统会重新评估纳入标准,并在适当时发送更正性后续通知。
- 纳入标准适用于所有相关安全类型:
- 安全病例启动事件
- 研究药物
- 伴随用药
- 病史
- 药物史
- 测试结果
按数据类型划分的选项摘要
| 纳入标准 | 安全数据类型 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| SCIE | 研究药物 | Con Meds | Med Hist | Drug Hist | Test Res | Pat Chars | 如果死亡 | ||
| 全部 | |||||||||
| 由研究中心用户链接 | |||||||||
| 开始到结束时间与安全事件开始到结束时间重叠 | |||||||||
| 开始到结束时间与安全事件开始之前的 X 天重叠 | |||||||||
| 开始到结束时间与安全事件开始之后的 X 天重叠 | |||||||||
| 开始到结束时间与安全事件结束之前的 X 天重叠 | |||||||||
| 开始到结束时间与安全事件结束之后的 X 天重叠 | |||||||||
| 首次配药 | |||||||||
| 最接近安全事件开始日期/安全事件开始之前 | |||||||||
| 最接近安全事件开始日期/安全事件开始之后 | |||||||||
| 最接近安全事件/安全事件之前(仅限一种) | |||||||||
| 在安全事件开始前开始配药 | |||||||||
| 在安全事件开始前结束 | |||||||||
| 总是 | * | * | |||||||
|
表示该纳入标准适用于此安全数据类型 * 表示该纳入标准对于此安全数据类型不可修改 |
|||||||||
表头的安全数据类型缩写说明:
- SCIE:安全病例启动事件
- ConMeds:伴随用药
- Med His:病史
- Drug Hist:药物史
- Test Res:测试结果
- Pat Chars:患者特征
选项含义/示例
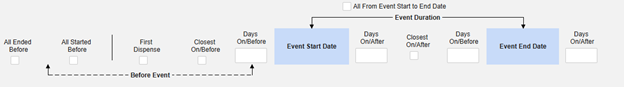
所有纳入标准选项总结如下。每个基于日期的选项均包含一系列示例以阐释用法。
按安全数据类型
安全病例启动事件
安全病例启动事件将是启动安全病例传输流程的主要事件。所有其他相关事件随后根据其配置的标准被纳入该病例。根据偏好和研究设计,启动事件可以包含来自启动表单的其他数据,或者与同类型的其他事件/表单相关联(但这些关联项本身不构成独立安全病例,例如,链接到启动严重事件的其他非严重事件)。
常见实际示例:
- 周一,受试者出现非严重不良事件“头痛”(AE 表单 #1)
- 周三,受试者出现非严重不良事件“头晕”(AE 表单 #2)
- 系统以周二的事件(“头晕”)作为新安全病例的主启动事件,发送安全病例。系统还根据配置的纳入标准,将周一事件的数据作为第二个事件添加到同一安全病例中。这是因为使用了当天/之前的天数 = 2(或以上)的配置。
为此安全类型保存纳入标准的操作步骤如下:
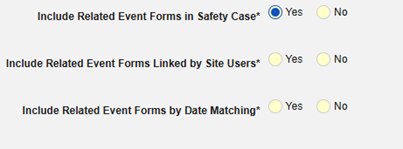
- 导航到工作室 > 表单配置中的研究
- 在安全病例中包含相关事件表单:
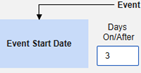
- 包括由研究中心用户链接的相关表单:如果由研究中心链接到主要启动事件的事件要纳入病例,请选择是。警告:选择是时,表单还必须配置“表单至表单”或“条目至表单”链接。
-
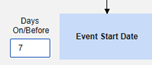
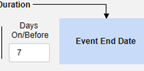
包含日期匹配的相关事件表单:如果要根据一个或多个基于日期的标准来评估是否纳入相关事件的数据,请选择是。
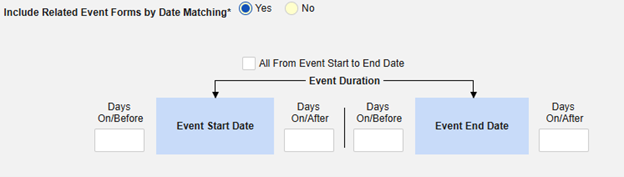
- 勾选所需选项或设置具体天数(Days)值。必须至少选择/设置其中一个选项。
- 单击保存并关闭完成配置。
有关每个纳入标准选项的更多详细信息和示例,请参阅上面的选项含义和示例。
研究药物
此类安全配置用于跟踪与研究药物相关的剂量/配药信息与启动事件的关系,即临床研究中用于受试者的测试药物。相关信息将同步至安全病例的产品/药物部分。
实际示例:
- 3 月 1 日,受试者首次领取研究药物活性药物与安慰剂(设盲研究药物)
- 3 月 3 日,受试者再次领取药物
- 3 月 5 日,受试者再次领取药物
- 3 月 6 日,受试者出现严重不良事件(“头晕”),研究中心录入 AE 表单
- 系统以“头晕”作为主要事件创建并传输安全病例
- 研究配置为仅在安全病例中纳入部分配药记录。示例配置方案为:3 月 1 日(总体首次配药)和 3 月 5 日(最接近的日期/之前)。根据配置的标准,其他配药记录不纳入。
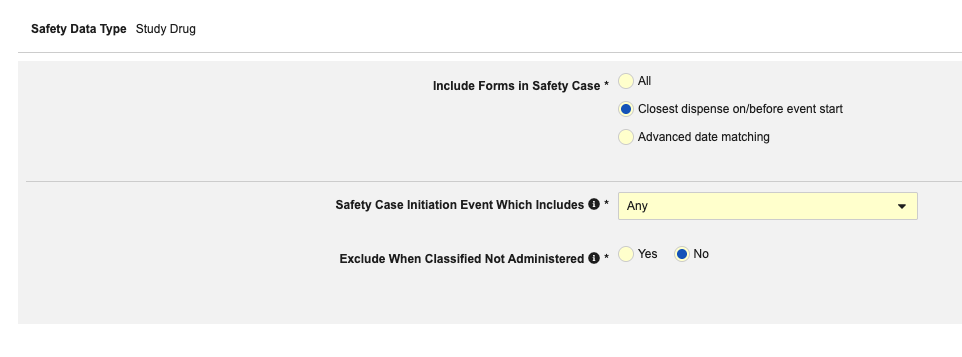
为此安全类型保存纳入标准的操作步骤如下:
- 导航到工作室 > 表单配置中的研究
- 在安全病例中包含表单:
- 当药物未给药(药物角色设置为“未给药”)时,要将研究药物信息排除在安全病例之外,请将分类为“未给药”时排除(Exclude When Classified Not Administered)设置保留为是。否则选择否。
- 单击保存并关闭完成配置。
有关每个纳入标准选项的更多详细信息和示例,请参阅上面的选项含义和示例。
伴随用药
此类安全配置适用于研究中的伴随用药表单。相关信息将同步至安全病例的产品/药物部分。
可以使用多个具有此类型的表单。
实际示例:
- 3 月 1 日,受试者开始服用 Veeofen,每天一次,但在 3 月 3 日停药
- 3 月 3 日,受试者开始服用 Natevba,每天一次,无结束日期(仍在服用)
- 3 月 5 日,受试者服用一次 Deetoza(结束日期同为 3 月 5 日)
- 3 月 7 日,受试者出现严重不良事件(“头晕”),研究中心录入 AE 表单
- 系统以“头晕”作为主要事件创建并传输安全病例
- 研究设计规定使用以下两个规则纳入伴随用药:
- “SAE 开始时仍在持续”
- “已停止但停止时间距 SAE 开始不超过 3 天”
- 结果:3 月 3 日开始服用的 Natevba(仍在使用)和 3 月 5 日服用的 Deetoza(已停药但仅过去 2 天)均被纳入病例。3 月 1 日开始服用的另一药物阿司匹林(停药超过 3 天)未被纳入病例
为此安全类型保存纳入标准的操作步骤如下:
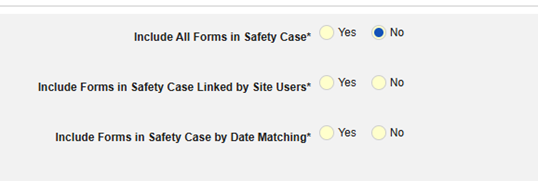
- 导航到工作室 > 表单配置中的研究
- 从以下选项中选择:
- 在安全病例中包含所有表单(默认为否):选择是,将所有当前伴随用药纳入病例,这将禁用所有其他选项。
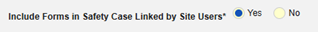
- 包括由研究中心用户链接的相关表单:如果由研究中心链接到主要启动事件的伴随用药要纳入病例,请选择是。警告:选择是时,表单还必须配置“表单至表单”或“条目至表单”链接。
- 在安全病例中包含由研究中心用户链接的表单:选择是或否。警告:选择是时,表单还必须配置“表单至表单”或“条目至表单”链接。
-
按日期匹配在安全病例中包含表单:选择是或否。选择是时,系统将使用一个或多个标准来比较安全病例事件(主要事件)和相关数据(正在配置的表单,其开始和结束范围)的开始到结束范围:
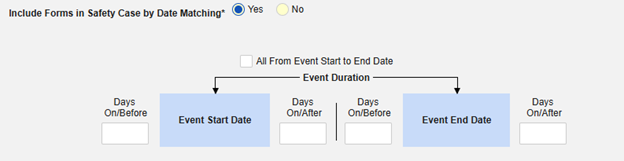
- 勾选所需选项或设置具体天数(Days)值。必须至少选择/设置其中一个选项。
- 单击保存并关闭完成配置。
有关每个纳入标准选项的更多详细信息和示例,请参阅上面的选项含义和示例。
病史
此类安全配置适用于研究中的病史表单。
实际示例:
- 2024 年 1 月,受试者首次出现“轻微头晕”。病史记录为持续状态(无结束日期)
- 第二份病史记录“背痛”,开始于 2024 年 4 月,结束于 2024 年 5 月
- 第三份病史记录“偏头痛”,开始于 2024 年 6 月,结束于 2024 年 11 月
- 2025 年 3 月 7 日,受试者出现严重不良事件(“头晕”),研究中心录入 AE 表单
- 系统以“头晕”作为主要事件创建并传输安全病例
- 研究设计规定使用以下两个规则纳入病史:
- “SAE 开始时仍在持续”
- “已停止但停止时间距 SAE 开始不超过 182 天”
- 结果:“轻微头晕”(持续状态)和“偏头痛”(结束不足 1 年)均被纳入病例。另一病史“背痛”(停止超过 180 天)未被纳入病例
为此安全类型保存纳入标准的操作步骤如下:
- 导航到工作室 > 表单配置中的研究
- 从以下选项中选择:
- 在安全病例中包含所有表单(默认为否):选择是,将所有当前伴随用药纳入病例,这将禁用所有其他选项。
- 包括由研究中心用户链接的相关表单:如果由研究中心链接到主要启动事件的伴随用药要纳入病例,请选择是。警告:选择是时,表单还必须配置“表单至表单”或“条目至表单”链接。
- 在安全病例中包含由研究中心用户链接的表单:选择是或否。警告:选择是时,表单还必须配置“表单至表单”或“条目至表单”链接。
-
按日期匹配在安全病例中包含表单:选择是或否。选择是时,系统将使用一个或多个标准来比较安全病例事件(主要事件)和相关数据(正在配置的表单,其开始和结束范围)的开始到结束范围:
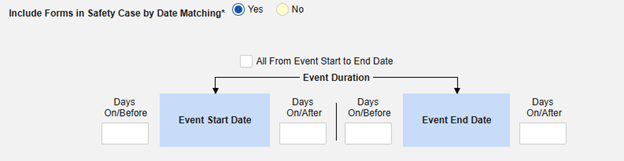
- 勾选所需选项或设置具体天数(Days)值。必须至少选择/设置其中一个选项。
- 单击保存并关闭完成配置。
有关每个纳入标准选项的更多详细信息和示例,请参阅上面的选项含义和示例。
药物史
此类安全配置适用于研究中的药物史表单。相关信息将同步至 Veeva Safety 的药物史(Drug History)部分。
实际示例:
- 研究设计在筛选访视时收集研究者认为合适和/或符合方案的药物史信息。这些特指在受试者进入试验之前服用(并已停药)的药物/产品。
- 2025 年 3 月 7 日,受试者出现严重不良事件(“头晕”),研究中心录入 AE 表单。
- 系统以“头晕”作为主要事件创建并传输安全病例
- 根据此安全数据类型的研究配置,所有药物史信息均需纳入该受试者的每一个安全病例。
- 也可选择使用基于日期和/或研究中心链接的选项。
为此安全类型保存纳入标准的操作步骤如下:
- 导航到工作室 > 表单配置中的研究
- 从以下选项中选择:
- 在安全病例中包含所有表单(默认为否):选择是,将所有当前伴随用药纳入病例,这将禁用所有其他选项。
- 包括由研究中心用户链接的相关表单:如果由研究中心链接到主要启动事件的伴随用药要纳入病例,请选择是。警告:选择是时,表单还必须配置“表单至表单”或“条目至表单”链接。
- 在安全病例中包含由研究中心用户链接的表单:选择是或否。警告:选择是时,表单还必须配置“表单至表单”或“条目至表单”链接。
-
按日期匹配在安全病例中包含表单:选择是或否。选择是时,系统将使用一个或多个标准来比较安全病例事件(主要事件)和相关数据(正在配置的表单,其开始和结束范围)的开始到结束范围:
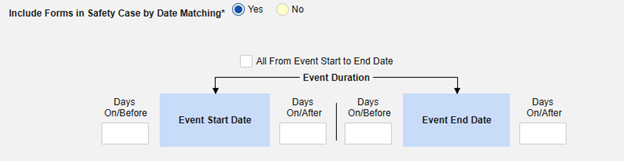
- 勾选所需选项或设置具体天数(Days)值。必须至少选择/设置其中一个选项。
- 单击保存并关闭完成配置。
有关每个纳入标准选项的更多详细信息和示例,请参阅上面的选项含义和示例。
测试结果
此类安全配置适用于研究中的实验室/测试结果表单。相关信息将同步至 Veeva Safety 的测试结果(Test Results)部分。
实际示例:
- 研究设计根据研究者/研究中心的需要在日志表单上收集额外的实验室/测试结果(他们认为与严重不良事件相关的测试)。
- 2025 年 3 月 7 日,受试者出现严重不良事件(“头晕”),研究中心录入 AE 表单。
- 此外,研究中心添加了两个超出范围的实验室测试,并将每个测试链接到 AE 表单。
- 系统以“头晕”作为主要事件创建并传输安全病例
- 由于研究的安全配置规定纳入研究中心链接到事件的任何内容,因此两个测试结果都纳入病例中。
- 另外,可以使用基于日期的选项(或取而代之)。
为此安全类型保存纳入标准的操作步骤如下:
- 导航到工作室 > 表单配置中的研究
- 从以下选项中选择:
- 在安全病例中包含所有表单(默认为否):选择是,将所有当前伴随用药纳入病例,这将禁用所有其他选项。
- 包括由研究中心用户链接的相关表单:如果由研究中心链接到主要启动事件的伴随用药要纳入病例,请选择是。警告:选择是时,表单还必须配置“表单至表单”或“条目至表单”链接。
- 在安全病例中包含由研究中心用户链接的表单:选择是或否。警告:选择是时,表单还必须配置“表单至表单”或“条目至表单”链接。
-
按日期匹配在安全病例中包含表单:选择是或否。选择是时,系统将使用一个或多个标准来比较安全病例事件(主要事件)和相关数据(正在配置的表单,其开始和结束范围)的开始到结束范围:
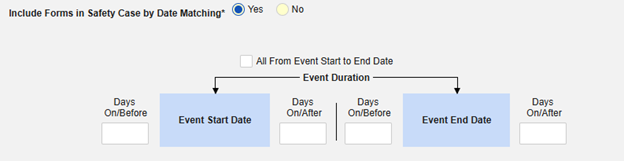
- 勾选所需选项或设置具体天数(Days)值。必须至少选择/设置其中一个选项。
- 单击保存并关闭完成配置。
有关每个纳入标准选项的更多详细信息和示例,请参阅上面的选项含义和示例。
患者特征
此类安全配置适用于记录患者一般信息的表单。此类型没有任何标准。归类为此类型的信息将纳入受试者的所有安全病例中。
当从条目配置选项卡进入纳入标准选项卡时,单击保存并进入下一步可返回表单配置列表。
如果死亡
此类安全配置适用于记录受试者死亡详情的表单。此类型没有任何标准。归类为此类型的信息将纳入受试者的所有安全病例中。
目前,每个病例都会收到此信息,即使是那些病例中没有任何事件结果为“致命”的病例。
当从条目配置选项卡进入纳入标准选项卡时,单击保存并进入下一步可返回表单配置列表。
删除所有安全配置
删除研究设计的所有安全配置时请务必谨慎。此操作会将研究恢复至无任何安全配置的状态,需重新开始配置流程。
要执行此操作,开发环境的研究中必须不存在任何安全病例。若已在开发环境中创建安全病例,可以删除非生产测试数据。
上线后删除:如果下游环境(测试、培训、生产)已存在安全配置和安全病例,绝不可执行此操作。即使开发环境中的研究可删除安全病例及安全配置,后续向测试/培训/生产环境部署时也会失败。
删除研究的所有安全配置的操作步骤如下:
下载规范
你可以通过研究设计规范或所有 CRF PDF 导出来下载安全配置。当你配置了安全集成后,将生成两个附加选项卡:安全设置和安全表单配置(Safety Form Configurations)。
部署安全配置
在研究的 DEV 环境中完成配置后,你可以将其部署到 TST 进行测试,然后继续部署到培训和生产环境中。
除集成设置 和连接 外,你的安全配置将自动包含在研究的部署包中。部署研究时,Vault 将在包中包含当前配置。
由于此配置作为研究部署的一部分进行管理,因此你只能在 DEV 类型环境中进行更改。要进行更改,请在 DEV 环境中操作,然后将这些更改部署到其他环境。此配置作为病例手册版本发布的一部分进行验证。在验证过程中,将禁用编辑功能。可能的错误和警告列表位于此处。
了解如何部署研究。
自定义安全字段
Safety-EDC 连接提供了最常见的安全相关字段(E2B 和非 E2B)作为标准安全字段以供映射。为了进一步灵活地从 EDC 向 Veeva Safety 传输信息,可配置额外的自定义安全字段。自定义字段会显示在其适用的安全数据类型的条目配置菜单中,与其他标准字段并列。
- 在 Veeva Safety 中,一个安全病例包含若干子部分,包括不良事件、评估等。该结构通过层级对象结构呈现。“病例”对象是所有相关病例部分对象的父对象,对应 UI 中的安全病例子部分,包括病例不良事件、病例死亡原因、病例评估等。
- 因此,可通过在 Veeva Safety 中相应的“病例”子对象中添加条目,为病例的各个子部分补充自定义安全字段。更多详情请参考 Veeva Safety 帮助。
- 在 Veeva Safety 中修改“病例”子对象时,下信息对后续 Veeva EDC 中的配置至关重要:
- 子对象(例如 case_medical_history__v)
- 确切的自定义字段名称(例如,对于“慢性疾病(Chronic Condition)”这一新自定义字段,字段名称可设为 chronic_condition__c)。
- 要在 Veeva EDC 中创建自定义安全字段,必须创建新的 Safety Connector 字段定义条目。如需为某个安全数据类型配置正确的映射位置,需重点设置分组属性(Grouping Property)(即该条目显示在哪个安全数据类型下)和显示顺序(Display Order)(详情见下文)。
- EDC 向 Veeva Safety 的数据传输基于 JSON 格式。为确保正确传输到 Veeva Safety,还需理解并在新的 Safety Connector 字段定义中配置 JSON 结构,其中 JSON 节点名称必须与 Veeva Safety 中的自定义字段名称完全一致,以实现数据匹配(详情见下文)。
- 自定义安全字段在 Vault 级别配置,配置后所有现有研究和新建研究均可使用该字段进行映射。
- 虽然新的自定义安全字段未在现有研究中映射,但现有病例不会受影响,该配置也不会触发任何后续消息。
示例 1
-
Veeva Safety 中安全病例的不良事件子部分用于存储病例的事件信息。病例不良事件对象(case_adverse_event__v)提供了该子部分中显示的字段。该子部分的数据大多来自 EDC 研究中的 AE/SAE 表单。从 Veeva EDC 传输至 Veeva Safety 的字段对应安全病例启动事件数据类型的字段,在 Safety 用户界面中显示如下:
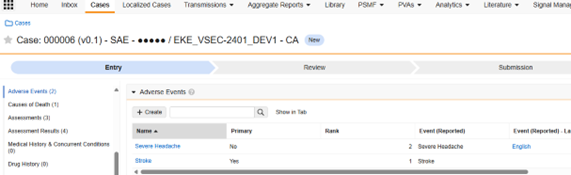
-
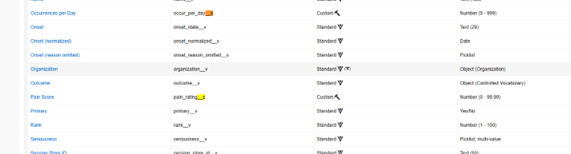
下文中,我们在 Veeva Safety 的对应对象中新增了两个自定义安全字段。这些注意字段名称末尾带有“__c”:疼痛评分(Pain Score)(pain_rating__c)和每日发生次数(Occurrence per Day)(occur_per_day__c):
示例 2
- Veeva Safety 中“测试结果”子部分显示安全病例的所有测试结果相关配置字段,对应病例测试结果对象(case_test_result__v)。这些记录通常在 EDC 的实验室结果表单中配置,并映射至测试结果数据类型,
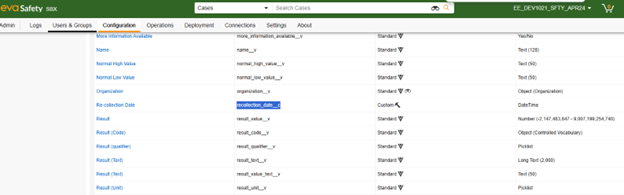
-
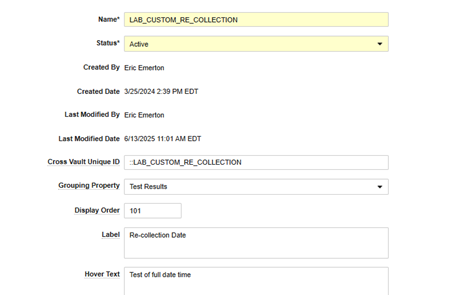
下文中,我们在 Veeva Safety 的对应对象中新增了一个自定义字段:重新采集日期(Re-collection Date)(recollection_date__c):
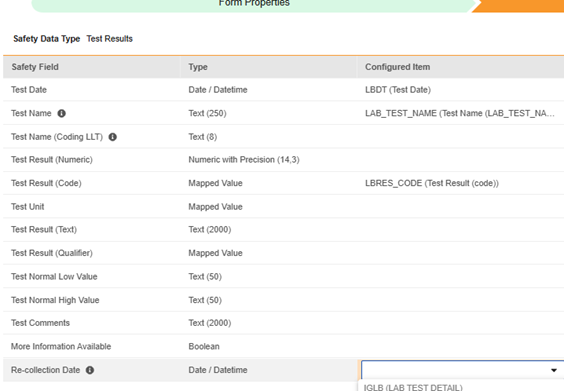
- 在 EDC 端完成相关配置后,这些字段将与标准安全字段并列,可供使用:
在 EDC 中添加自定义安全字段
Veeva EDC 中的自定义安全字段在 Vault 级别配置。新增字段后所有现有研究和新建研究均可使用该字段进行映射。
配置自定义安全字段需注意以下重要事项:
- 请咨询 Veeva 代表,了解顺利配置和充分运用此功能所需的规划和步骤。
- 创建或更新自定义安全字段时需要在 Veeva EDC 和 Veeva Safety 配置之间进行仔细协调。
- 自定义安全字段配置错误可能导致 Veeva EDC 向 Veeva Safety 的数据传输损坏。
- 还要考虑项目层面的决策,涉及 EDC 设计团队、Safety 用户,甚至可能包括使用其他 Veeva 应用程序的成员。
- 建议先在 Veeva Safety 中配置自定义安全字段,再在 Veeva EDC 中进行配置。
- 在 Veeva Safety 和 Veeva EDC 中配置都需要使用具有 Vault 所有者安全配置文件的帐户。
- EDC 连接端的配置仅需在开发环境 Vault/“控制中心”中执行一次。要将配置从开发环境 Vault 移动到测试、生产或培训环境,请使用系统工具中的 Vault 级别部署,并勾选安全选项。
需要 Vault 所有者权限:必须由具备 Vault 所有者安全配置文件的用户配置自定义安全字段。
要在 Veeva EDC 中配置与 Veeva Safety 对应的自定义安全字段,操作步骤如下:
-
导航到业务管理员(Business Admin)> 对象(Objects)> Safety Connector 字段定义(Safety Connector Field Definitions)。
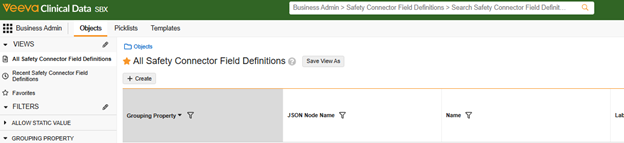
- 单击创建(Create)以添加新记录。
- 根据以下字段级别信息指南填写新记录。
- 点击保存。
| Vault 字段 | 值 | 备注 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 名称 | (文本) | 建议命名与列表中现有同安全数据类型的其他标准/字段名称保持一致。例如,用于收集病史是否为“慢性疾病”的字段可命名为 MH_CHRONIC_CONDITION。前缀“MH_”与其他 MH 字段的命名方式一致。 | ||||||||||||||||||||||||
| 交叉 Vault 唯一 ID | (::名称) | 必须以两个冒号开头。建议使用与“名称”相同的值,并加上前缀“::”。例如 ::MH_CHRONIC_CONDITION | ||||||||||||||||||||||||
| 分组属性 | (选项列表) | 此字段是安全数据类型(领域),建议与 Veeva Safety 中安全病例的目标子部分匹配。例如,用于“不良事件”部分的信息应位于安全病例启动事件上。
|
||||||||||||||||||||||||
| 显示顺序 | (整数值) | 通常这是一个大于该安全数据类型(分组属性)下所有其他现有值的数值,决定该行在该安全数据类型的条目配置列表中出现的位置(从上往下读)。如果选择了现有值,则与重复条目的相对显示顺序不确定。 | ||||||||||||||||||||||||
| 标签 | (文本) | 在工作室中为该安全数据类型的自定义安全字段显示的用于映射的标签(例如“重新采集日期”) | ||||||||||||||||||||||||
| 悬停文本 | (文本) | 可选,指示出现在标签旁边“i”悬停图标中的任何文本 | ||||||||||||||||||||||||
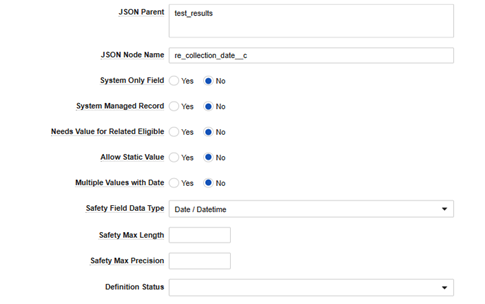
| JSON 父级 | (文本) | 注意:建议在 Veeva 顾问支持下配置此字段。如果插入了无效值,将导致 EDC 向 Safety 的数据传输损坏。系统没有针对错误配置的验证机制。
该值对应于两个系统之间交换的 JSON 文件。根据字段在 Safety 中的位置和 EDC 安全数据类型使用相应的值:
|
||||||||||||||||||||||||
| JSON 节点名称 | (文本) | 此值必须与 Veeva Safety 中的字段名称完全一致。例如,如果字段 MH_CHRONIC_CONDITION 位于 Veeva Safety 的 case_medical_history__v.chronic_condition__c,则使用 chronic_condition__c。 |
||||||||||||||||||||||||
| 仅限系统字段 | 始终设为否 | 仅支持否 | ||||||||||||||||||||||||
| 系统托管记录 | 始终设为否 | 仅支持否 | ||||||||||||||||||||||||
| 相关合格项需要值 | 始终设为否 | 仅支持否 | ||||||||||||||||||||||||
| 允许静态值 | 是或否 | 选择是后,条目配置 UI 中的该行将允许设置静态值并传输至 Safety,而非从 EDC 表单的条目配置数据录入字段中获取值。 | ||||||||||||||||||||||||
| 多个具有日期的值 | 始终设为否 | 仅支持否 | ||||||||||||||||||||||||
| Safety 字段数据类型 | 请参阅备注。 | 字段类型,例如日期、数值、文本等。根据类型不同,需在记录的其他字段中补充配置:
|
||||||||||||||||||||||||
| Safety 最大长度 | 整数值 | 指示在 Safety 中为该字段配置的值。请参阅“安全字段数据类型”。 | ||||||||||||||||||||||||
| Safety 最大精度 | 整数值 | 对于支持精度配置的字段,请在此处填写具体精度值。请参阅“安全字段数据类型”。 | ||||||||||||||||||||||||
| 定义状态 | 始终留空 | 仅当此字段为空时表示“活动”。状态为已归档将使该字段在工作室中不再可见。 | ||||||||||||||||||||||||
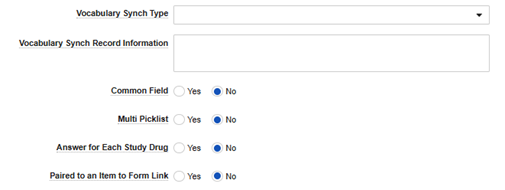
| 词汇同步类型 | 请参阅备注。 | 仅当安全字段数据类型为映射值时,此处的值才适用。根据所选内容,下一个字段“词汇同步记录信息”需要附加信息。 | ||||||||||||||||||||||||
| 词汇同步记录信息 | 请参阅备注。 | 根据所选的词汇同步类型,此字段指示 EDC 在哪里可以找到这些选项。
|
||||||||||||||||||||||||
| 通用字段 | 始终设为否 | 仅支持否 | ||||||||||||||||||||||||
| 多选项列表 | 是或否 |
|
||||||||||||||||||||||||
| 针对每种研究药物的回答 | 始终设为否 | 仅支持否 | ||||||||||||||||||||||||
| 与条目至表单链接配对 | 始终设为否 | 仅支持否 |
根据前面示例部分中的示例 2,正确配置的重新采集日期自定义字段显示如下:
部署自定义字段
- Veeva EDC 中的自定义安全字段仅需在包含开发环境的 EDC Vault(“控制中心”)中配置一次。
- 要将配置从开发环境 Vault 移动到其他 Vault(测试/UAT、生产、培训),无需在下游 Vault 中重复执行配置步骤。
-
应导航至工具 > 系统工具,选择“Vault 部署(Vault Deployment)”选项,并勾选Safety Connector 定义(Safety Connector Definitions):
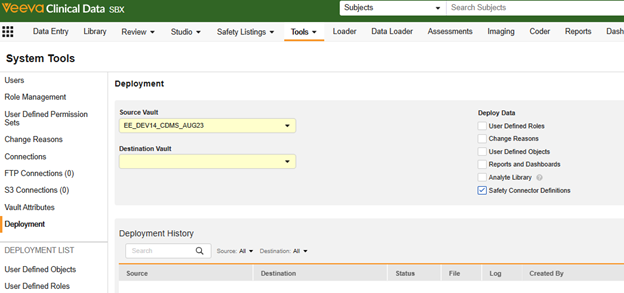
- 有关 Veeva EDC 中 Vault 级别部署的更多信息,请参阅“在系统工具中部署 Vault 级别的配置”。
标准和自定义字段的自定义安全值
在 Veeva Safety 中,Vault 选项列表或受控词汇对象的记录定义特定标准字段和自定义安全字段的可选值(例如,“对药物采取的行动”的可选选项)。可选选项可以通过标准集之外的附加选项进行配置(例如,向“对药物采取的行动”添加“剂量中断”)。
在 Veeva EDC 中,如果一个字段映射到 Veeva Safety 端指定了可选选项的标准或自定义字段,则需在条目配置步骤中配置值转换。
若某个安全数据类型的字段需要配置值转换,可通过其“Safety Connector 字段定义”判断(设为映射值)。为了使新配置或更新的选项在 Veeva EDC 中可用,必须重新执行“连接安全扫描”作业。在 EDC 中,通常将代码列表或布尔值类型的条目定义映射到这些安全字段。
安全字段值更新在 Vault 级别配置,配置后对现有研究和新建研究均生效。必须考虑对现有研究的影响。
示例 1
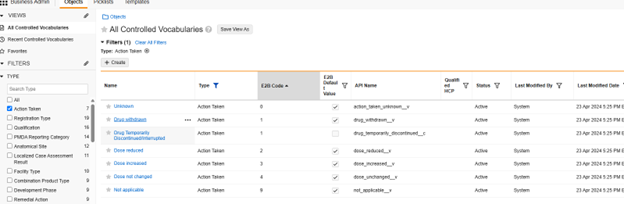
安全病例启动事件中的对研究药物采取的措施安全字段是关于安全事件与研究药物的重要字段。可在 Veeva Safety 中为该字段的选项补充自定义选项药物暂时停药/中断(Drug Temporarily Discontinued / Interrupted):
一旦 EDC Vault 与 Veeva Safety 同步(下一节),该附加选项将作为研究设计的 EDC 条目配置的值转换中的一个选项出现。
示例 2
可用于安全病例启动事件和“患者特征”的安全字段分娩方式有三个标准选项。在该选项列表上配置的第四个自定义选项未知将在 Veeva Safety 中配置为:
与示例 1 相同,一旦 EDC Vault 与 Veeva Safety 同步,该第四个选项将显示在值转换配置中。
将自定义安全值同步到 EDC
配置自定义安全值需注意以下重要事项:
- 与自定义安全字段类似,请咨询 Veeva 代表,了解顺利配置和充分运用此功能所需的规划和步骤。
- 必须考虑对现有研究的影响。
- 安全字段未同步可能导致 Veeva EDC 向 Veeva Safety 的数据传输损坏。
- 更新自定义安全字段值后,若 EDC 中未为该值配置值转换,现有研究可能出现验证错误。在 EDC 中更新值转换后,可能会向现有病例发送后续消息。
- 对于自定义字段,新增或调整安全字段选项需仔细规划,并在 EDC 和 Safety 配置之间协调。还要考虑项目层面的决策,涉及 EDC 设计团队、Safety 用户,甚至可能包括使用其他 Vault 应用程序(如 RIM、CTMS 等)的成员。
- 建议先在 Veeva Safety 中配置自定义安全字段,再在 Veeva EDC 中进行配置。
- 在 Veeva Safety 中配置选项需具备 Vault 所有者访问权限。
- 在 EDC 中,通过系统工具 > 连接 > Safety 路径下的“词汇扫描”作业同步选项
- EDC 连接端的配置仅需在包含开发环境的 EDC Vault(“控制中心”)中执行一次。要将配置从开发环境 Vault 移动到测试/UAT、生产、培训环境,请使用系统工具中的 Vault 级别部署,并勾选安全选项。
要将新创建/更新的选项从 Veeva Safety 同步至 Veeva EDC 工作室屏幕,操作步骤如下:
- 进入系统工具 > 连接 > Safety,导航到相应的连接。
- 将鼠标悬停在连接的名称上以显示扫描(Scan)按钮。
- 在扫描 Vault Safety(Scan Vault Safety)对话框中,单击运行作业(Run Job)。
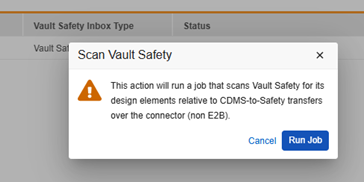
当 Vault 完成作业后,你将收到电子邮件通知,并且 EDC 研究配置中所有安全字段的值转换选项将反映来自配对的 Veeva Safety 的选项。
部署自定义值
- EDC 连接端的自定义值配置仅需在包含开发环境的 EDC Vault(“控制中心”)中执行一次。
- 要将配置从开发环境 Vault 移动到其他 Vault(测试/UAT、生产、培训),无需在下游 Vault 中重复执行配置步骤。
-
应导航至工具 > 系统工具,选择“Vault 部署(Vault Deployment)”选项,并勾选Safety Connector 定义(Safety Connector Definitions):

- 有关 Veeva EDC 中 Vault 级别部署的更多信息,请参阅“在系统工具中部署 Vault 级别的配置”。
安全字段参考(系统生成)
此页面列出了在安全病例中发送到 Veeva Safety 的静态和系统生成元素。
| 安全字段 | 数据类型 | 源 | 说明 |
|---|---|---|---|
| 研究标签 | 文本 | 静态 | Veeva EDC 中的研究标签,可通过安全设置专门覆盖该值。 |
| 研究编号 | 文本 | 静态 | Veeva EDC 中的研究标签,可通过安全设置专门覆盖该值。 |
| 首次从源收到报告的日期 | 日期时间 | 由系统生成 | 此字段捕获为事件捕获所有必填字段(条目)的日期和时间。 |
| 此报告的最新信息的日期 | 日期时间 | 由系统生成 | 指示在发送最后一条安全消息后,数据录入用户在给定日期所做的、涉及安全病例中的数据的第一次更改。例如,如果用户在同一日期上午 8 点先更改病史表单上的数据,然后在上午 10 点更改 SAE 表单上的数据,最后在上午 11 点链接两个伴随用药表单,所做的所有更改都是针对同一安全病例中的数据,则下一次计划传输中的值将在该日期的上午 8 点。 |
| 报告者信息 | 文本 | 来自研究中心或用户输入 | 根据研究的“报告者(Reporter)”选项设置(安全设置),该信息将来自研究中心的主要研究者。在 Safety-EDC 连接中,可将 EDC 表单的特定条目映射至报告者信息的各个组成部分。填写后,将覆盖基础研究中心/PI 信息。 |
| 发生反应/事件的国家/地区的标识 | 文本(2) | 来自研究中心或用户 | 研究中心的研究国家/地区的 2 字符国家/地区编码。或者,可以在数据录入表单上映射,供研究中心覆盖。(例如,受试者在国外时发生的事件) |