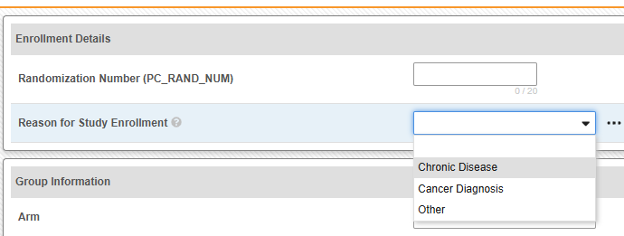
E2B 스터디 구성
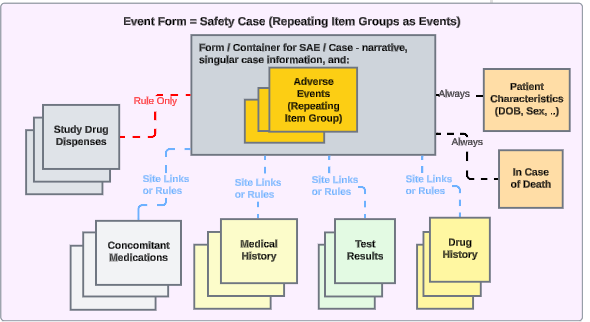
Veeva EDC와 제3자 안전성 시스템 간의 안전성 연동은 AS2 게이트웨이를 통한 E2B XML(R3 버전) 교환을 기반으로 합니다. 적절하게 연동을 구성하면 모든 필수적 및 보완적 안전성 관련 EDC 데이터가 안전성 사례로 안전성 시스템으로 전송됩니다. 전송을 유발할 수 있는 예로는 임상 시험에서 심각한 이상 사례, 특별 관심 이상 사례, 예상하지 못한 임신 등이 있습니다.
스터디 디자인에 대한 연동 설정을 통해 사이트에서 안전성 사례 시작 기준을 충족하는 이벤트를 생성할 때마다, Veeva EDC는 자동으로 첫 번째 전송을 생성하고 데이터를 안전성 시스템으로 전송합니다.
해당 위치를 다음 안전성 데이터 유형 중 하나로 분류하여 안전성 사례에 관련 데이터를 삽입할 수도 있습니다.
- 스터디 약물(제품 또는 임상 시험에서 테스트 중인 제품)
- Concomitant Medications
- Medical History
- 약물력
- 시험 결과
- 환자 특성
- 사망 시
- 시스템별 보고자/발신자 코멘트
안전성 사례 시작 또는 관련 데이터가 업데이트되면 주어진 시간 간격 내에 안전성 시스템으로 전송될 팔로우업 전송이 자동으로 생성됩니다.
스터디 설계자는 EDC 스터디 디자인 아이템을 E2B R3 요소에 매핑하여 이 연동을 구성합니다. 매핑된 사례집 요소를 안전성 사례에 포함시키는 것은 구성된 포함 규칙에 따라 추가로 달라지며, 이때 대상자의 모든 사례집 폼, 사이트에서 안전성 사례 시작 폼에 링크한 항목 또는 시작 이벤트와 관련하여 선택한 날짜 범위에 속하는 항목에 매핑된 아이템을 포함할 수 있는 옵션을 활용할 수 있습니다.
안전성 사례는 단일 이벤트로 인해 생성되거나 여러 이벤트로 구성될 수 있습니다. 이때 사이트 연결 및/또는 날짜 기준 포함 규칙을 사용하여 구성됩니다.
시스템은 데이터가 올바르게 수신되고 구문 분석되었는지 확인하기 위해 안전성 시스템("ACK 파일")의 승인을 수락합니다. 이 반환 정보는 사례 상태, 메시지 상태를 확인하고 오류 세부 사항(있는 경우)을 제공합니다.
안전성 사례(V4)와 안전성 메시지 - E2B (V4) 레포트에서 요약 정보를 통해 연동 상태 및 현황을 확인할 수 있습니다. 안전성 연동은 초기 전송을 시작한 기준이 더 이상 사실이 아닌 경우 발생하는 자동 무효화 전송도 지원합니다. 예를 들면 폼 재설정(잘못된 입력) 또는 이벤트 다운그레이드가 있습니다. 무효화를 참조하십시오.
안전성 관리자는 첫 번째 전송 시기와 팔로우업 빈도, 연동을 위한 기타 운영 설정을 설정합니다. 자세한 내용은 안전성 연동 관리의 안전성 설정을 참조하십시오.
사전 구성 요소
Vault 소유자 보안 프로필이 있는 사용자는 Veeva EDC와 안전성 시스템 간에 연결을 생성해야 합니다.
표준 CDMS Study Designer(CDMS 스터디 설계자) 또는 CDMS Librarian(CDMS 라이브러리 관리자) 스터디 역할이 있는 사용자는 안전성 구성을 보고 편집할 수 있습니다. 조직에서 커스텀 스터디 역할을 사용하는 경우, 역할에서 다음 권한을 부여해야 합니다.
| 유형(Type) | 권한 레이블 | 제어 |
|---|---|---|
| 표준 탭 | Studio 탭 | Studio 탭에 접근할 수 있는 기능 |
| 표준 탭 | 라이브러리 탭 | 라이브러리(Library) 탭에 접근할 수 있는 기능 |
| 기능적 권한 | 스터디 디자인 보기 | 스터디 디자인에 대한 보기 전용 접근권한 |
| 기능적 권한 | 스터디 디자인 | Studio에서 스터디 디자인 정의 및 스터디 일정을 생성할 수 있는 기능 |
| 기능적 권한 | 안전성 구성 관리(Manage Safety Configuration) | 스터디의 안전성 연동에 대해 설계하고 구성할 수 있는 기능. 여기에는 관련된 폼, 해당 폼에서 안전성 시스템으로 전송되는 아이템, 안전성 사례에서 폼 데이터를 포함하거나 제외할 시기를 나타내는 포함 기준을 결정하는 것이 포함됩니다. |
| 기능적 권한 | 라이브러리 보기 | Studio > 라이브러리에서 라이브러리 수집 및 설계를 볼 수 있는 기능 |
| 기능적 권한 | 라이브러리 설계 | Studio > 라이브러리에서 수집 스터디 디자인 정의와 스터디 일정을 생성할 수 있는 기능 |
안전성 연동 유형
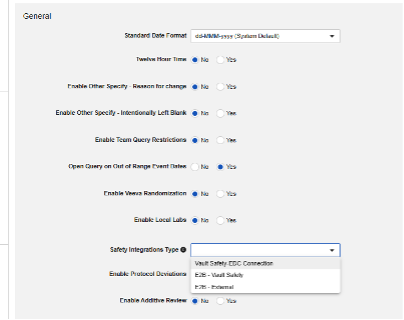
Veeva EDC에 대한 안전성 연동을 구성하는 첫 번째 단계는 스터디 설정의 안전성 연동 유형 값입니다.
안전성 연동 유형(Safety Integrations Type) 설정은 공백 외의 값이 있는 경우 읽기 전용이 됩니다. 이는 Safety-EDC Connection 스터디와 비교했을 때 E2B 스타일 연동이 지닌 특성 때문입니다. 둘 사이를 전환해야 하는 경우 Veeva 담당자에게 지원 및 계획에 대해 문의하십시오.
Safety-EDC Connection을 사용한 안전성 연동에 대한 자세한 내용은 Safety-EDC Connection 스터디 구성을 참조하십시오.
전체 연동 유형을 저장하면 Studio 탐색 메뉴에 안전성 설정(Safety Settings) 및 폼 구성(Form Configurations)이라는 추가 옵션이 나타납니다.
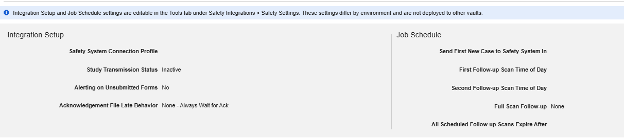
안전성 설정
설정 업데이트
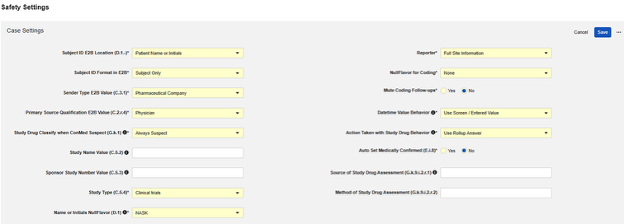
Studio의 기본 스터디 설정에서 적절한 안전성 연동 유형을 입력한 후, 다음 단계는 안전성 사례 설정을 구성하는 것입니다. 이러한 설정은 스터디의 모든 안전성 사례에 영향을 미치며, 스터디마다 다를 수 있습니다.
참고: 안전성 설정 페이지 하단의 추가 설정은 Studio 내에서 관리되지 않습니다. 배포된 스터디에 대한 알림, 즉 프로덕션 또는 기타 다운스트림 환경에서 Studio를 탐색할 때 표시됩니다. 이러한 스터디 운영 설정은 안전성 관리자가 툴(Tools) → 안전성 연동(Safety Integrations)에서 관리합니다. 자세한 내용은 안전성 연동 관리의 안전성 설정을 참조하십시오.
사용 가능한 설정
| 설정 | 기본값 | 선택 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 대상자 ID E2B 위치(D.1.-) | 환자 이름 또는 이니셜 | 현재 스터디에 대해 Veeva EDC 대상자 ID가 전송될 E2B 위치를 선택합니다.
|
||||||||||||||||||||||||
| E2B에서 대상자 ID 형식 | 대상자 전용 | Veeva EDC 대상자 ID를 안전성 시스템으로 전송하기 위해 사용할 형식을 선택합니다.
|
||||||||||||||||||||||||
| 발신자 유형 E2B 값(C.3.1) | 제약 회사 | Veeva EDC에서 안전성 시스템으로 안전성 사례를 보내는 조직의 유형을 선택합니다. C.3.1을 통해 이 값을 전달합니다. 다음 조직 유형에서 선택할 수 있습니다.
|
||||||||||||||||||||||||
| 기본 원본 자격 E2B 값(C.2.r.4) | 의사 | C.2.r.4에서 안전성 사례의 각 이벤트와 관련하여 스터디 약물이나 치료를 평가하는 사용자의 분류를 산출합니다. 다음 분류 유형에서 선택할 수 있습니다.
|
||||||||||||||||||||||||
| ConMed 의심 스터디 약물 분류(G.k.1) | 항상 의심 | 가능한 선택안은 다음과 같습니다.
이 설정은 데이터 입력 사용자가 병용약물(Concomitant Medications)로 분류된 폼을 안전성 사례 시작 이벤트(Safety Case Initiation Event)에 연결하고 기본 분류인 '병용'(E2B 값 '2')을 오버라이드할 수 있도록 스터디가 구성된 경우에만 적용됩니다. 예: 사용자가 약물을 연결할 때 SUSPECT를 선택하는 경우, 항상 상호 작용(Always Interacting)을 사용하면 시스템에서 당초 의심(Suspect)으로 간주했을 상호 작용(Interacting)으로 전송되는 모든 스터디 약물을 오버라이드합니다. |
||||||||||||||||||||||||
| 스터디 이름 값(C.5.2) | 선택 사항: E2B 파일에서 스터디 이름 값을 설정합니다. 공백으로 남겨 두면 항목은 E2B 콘텐츠에서 생략됩니다. | |||||||||||||||||||||||||
| 의뢰자 스터디 번호 값(C.5.3) | 선택 사항: 스터디 번호를 입력하여 E2B 파일의 값을 오버라이드합니다. 공백으로 남겨 두면 기존 스터디 레이블이 사용됩니다. | |||||||||||||||||||||||||
| 스터디 유형(C.5.4) | 임상 시험 | 스터디 유형(C.5.4)을 선택합니다. 다음에서 선택합니다.
|
||||||||||||||||||||||||
| 이름 또는 이니셜 E2B NullFlavor(D.1) | NASK |
스터디 설정 대상자 E2B 위치(D.1.*)에 대해 선택한 위치가 아닌 경우 E2B 위치 D.1(이름 또는 이니셜)의 NullFlavor 값에 이 설정을 사용합니다. 선택 항목은 다음과 같습니다.
|
||||||||||||||||||||||||
| 보고자 | 전체 사이트 정보 | 선택 항목에서 선택합니다.
E2B의 보고자 위치는 Veeva EDC의 사이트에 설정된 정보를 기반으로 채워집니다. |
||||||||||||||||||||||||
| 코딩용 Null Flavor | 없음 |
코딩에 대한 누락 값을 처리하는 방법을 선택합니다(MedDRA 코딩 값이 없는 경우). 이 설정은 코딩을 위해 구성 중이며, 안전성 전송을 위한 E2B 위치를 적용한 Veeva EDC 스터디 디자인의 위치에만 적용됩니다. 다음 옵션에서 선택합니다.
E2B에서 코딩 위치는 다음과 같습니다.
|
||||||||||||||||||||||||
| 음소거 코딩 팔로우업 | No |
이 설정을 예로 설정하면, Veeva EDC에서 코딩된 의료 용어(이벤트, 병력, 사망 원인)에 새 코드 또는 다른 코드를 할당하는 것이 유일한 변경 사항일 때 Veeva EDC에서 팔로우업을 전송하지 않습니다. 안전성 사례의 일부인 데이터에 대한 다른 변경 사항은 여전히 팔로우업 전송을 시작합니다. 아니요로 설정하면, Veeva EDC는 의학 용어 코딩 변경 사항을 포함하여 안전성 사례의 일부인 데이터 변경 사항에 대해 안전성 사례 팔로우업을 전송합니다. 주로 안전성 시스템에서 코딩을 수행하는 경우 이 옵션을 예로 설정하여 안전성 시스템의 코딩 할당 변경 사항에 대한 불필요한 팔로우업을 방지하는 것이 좋습니다. |
||||||||||||||||||||||||
| 날짜 시간 값 동작 | 스크린 / 입력값 사용 | EDC 폼의 날짜 시간 필드에 대해 안전성 데이터를 구성할 때 이 옵션은 보낼 값을 나타냅니다. 스크린/입력 값 사용) 중에서 선택하여 사이트에서 입력한 값을 사용하거나, 정규화(UTC) 값 사용을 선택하여 UTC(스크린 값을 오프셋한 사이트 시간대 사용)로 정규화된 날짜 시간을 사용할 수 있습니다. | ||||||||||||||||||||||||
| 스터디 약물에 대한 조치 행동 | 기본 SAE 답변 사용 | 이 설정은 스터디 디자인이 하나의 안전성 사례에서 여러 이벤트를 허용하는 경우에만 적용됩니다. 안전성 사례를 시작한 기본 이벤트와 함께 추가 이벤트를 전송하는 작업은 각각의 포함 규칙을 사용하여 구성할 수 있습니다(스터디 약물 포함 기준 참조). 이러한 상황에서 안전성 사례는 스터디 약물에 대해 취한 조치에 대한 여러 답변으로 구성됩니다. 따라서 E2B 전송에서 답변을 사용하는 방법이 필요합니다. 선택 항목에서 선택합니다.
롤업 답변을 사용할 때, 안전성 사례에 포함된 이벤트의 모든 답변이 고려됩니다. 취해진 가장 심각한 조치는 G.k.8을 통해 안전성 시스템으로 전송됩니다. 우선 순위는 다음과 같습니다.
예를 들어, 두 가지 이벤트에서 하나는 투여량 감소, 다른 하나는 투여량 변화 없음인 경우, 전반적인 답변은 투여량 감소입니다. |
||||||||||||||||||||||||
| 의학적으로 확인됨으로 자동 설정(E.i.8) | No | 이 설정은 안전성 사례에, 그리고 Veeva EDC가 전송하는 모든 사례에 "의료 전문가의 의학적 확인"(E.i.8)을 포함할지 여부를 결정합니다. 예를 선택하여 포함합니다. 아니요를 선택하면 E.i.8이 E2B XML에서 생략됩니다. 가장 일반적인 사용 형태는 예인데, 안전성 사례가 임상 사이트/연구자에게서 시작되기 때문입니다. | ||||||||||||||||||||||||
| 스터디 약물 평가 소스(G.k.9.i.2.r.1) | 선택 사항: 스터디 약물 평가 소스(G.k.9.i.2.r.1) 및 스터디 약물 평가 방법(G.k.9.i.2.r.2)의 경우 모든 사례에 적용되는 정적 값을 입력합니다. 평가의 결과(G.k.9.i.2.r.3)는 사이트 이용자가 답변하는 필드이며, 스터디 약물 유형에서 구성됩니다. 이 설정에 가장 일반적으로 사용되는 값은 의료 서비스 전문가(Healthcare Professional)입니다. | |||||||||||||||||||||||||
| 스터디 약물 평가 방법(G.k.9.i.2.r.2) | 선택 사항: 스터디 약물 평가 방법(G.k.9.i.2.r.2)의 경우 모든 사례에 적용되는 정적 값을 입력합니다. 이 설정에 가장 일반적으로 사용되는 값은 글로벌 내성(Global Introspection)입니다. | |||||||||||||||||||||||||
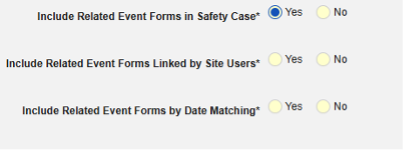
| 사례에 2차 이벤트 사이트 링크 포함 | Yes | 이 설정에서 예를 사용하면 1차 안전성 사례 시작 이벤트뿐만 아니라 사례의 2차 이벤트에 연결된 관련 데이터도 포함됩니다. |
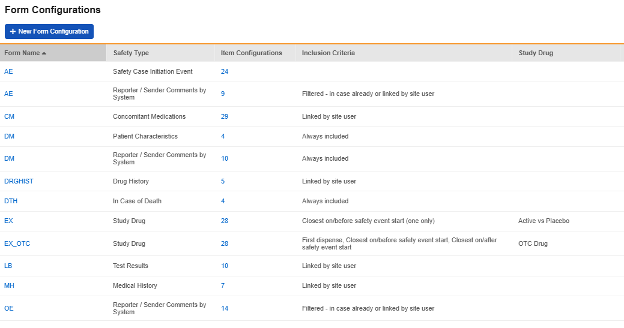
폼 구성
기본 안전성 설정(이전 섹션)을 업데이트한 후 다음 단계는 전체 스터디 디자인에서 어떤 특정 폼이 안전성 연동에 참여할지 구성하는 것입니다. 이는 Studio > 폼 구성에서 설정합니다.
안전성 설정을 구성한 후에만 "+ 새 폼 구성(+ New Form Configuration)" 버튼이 활성화됩니다.
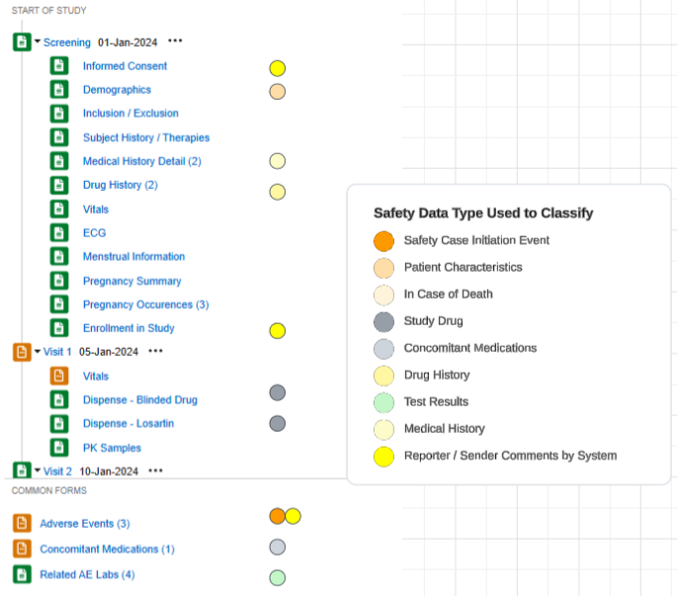
구성된 폼의 스터디 요약 목록의 예:
안전성 데이터 유형
안전성 연동을 위해 구성된 각 폼에는 안전성 데이터 유형(Safety Data Type)이 포함되어 있습니다. 이러한 유형은 안전성 시스템의 표준 데이터 모델/유형을 나타냅니다.
Veeva EDC의 안전성 구성 유형은 다음과 같이 요약됩니다.
| 유형(Type) | E2B(R3) 위치 | 메모 |
|---|---|---|
| 안전성 사례 시작 이벤트 | E.* |
|
| 스터디 약물 | G.* |
|
| Concomitant Medications | G.* |
|
| Medical History | D.7.* |
|
| 약물력 | D.8.* |
|
| 시험 결과 | F.* |
|
| 환자 특성 | D.1~D.6 |
|
| 사망 시 | D.9.* |
|
| 시스템별 보고자/발신자 코멘트 | H.2 또는 H.4 |
|
폼 구성을 생성하는 방법
새 안전성 폼 구성을 생성하는 방법은 다음과 같습니다.
안전성 연동 구성에 대한 업데이트 권한이 있지만 버튼이 표시되지 않는 경우, 먼저 안전성 설정이 저장되었는지 확인합니다.
폼 속성(Form Properties), 아이템 구성(Item Configurations) 및 포함 기준(Inclusion Criteria) 옵션은 이 문서의 뒷부분에서 안전성 유형별로 자세히 설명됩니다.
각 단계에서 저장(Save) 버튼은 다음 단계로 진행하지 않고 해당 정보를 저장하기만 합니다. 저장 및 다음 버튼은 정보를 저장하고 다음 단계로 이동합니다.
폼 구성 삭제
단일 폼 구성을 삭제하거나 모든 폼 구성을 한 번에 삭제하여 재시작할 수 있습니다. 폼 구성과 연결된 안전성 사례가 있는 경우 Vault에서 삭제 옵션을 비활성화합니다.
단일 폼 구성을 제거하려면
- 스터디의 Studio > 형식 구성으로 이동합니다.
- 폼 구성 이름 위로 마우스를 가져가면 작업 메뉴가 표시됩니다.
- 삭제를 선택합니다.
- 확인 대화 상자에서 삭제를 클릭합니다.
안전성 폼 구성을 삭제해도 EDC 폼 디자인 자체에는 어떤 식으로든 영향을 주지 않습니다. 스터디에서 안전성 폼에 매핑하는 데 사용된 EDC 폼을 삭제하면 관련 안전성 폼 구성도 삭제됩니다.
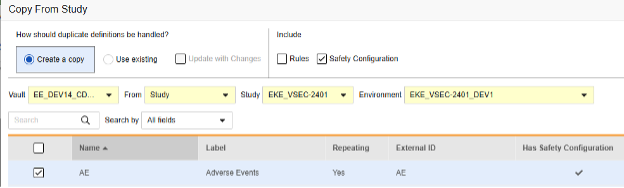
폼 구성 복사
현재 릴리스에서 안전성 폼 구성 정보를 복사하는 유일한 방법은 폼 복사를 사용하는 것입니다. 다른 복사 수준인 이벤트 그룹 복사와 이벤트 복사는 폼 수준 안전성 구성의 복사를 지원하지 않습니다.
이벤트 그룹 또는 이벤트가 소스 라이브러리/스터디에서 복사되고(안에 폼이 있는 상태) 해당 폼에 안전성 폼 구성 정보가 포함되어 있는 경우, 후속 작업으로 기존 항목 사용/변경 사항으로 업데이트(Use Existing / Update with Changes) 옵션과 함께 폼 복사를 사용하면 됩니다.
폼의 핵심 복사를 수행하는 동안 안전성 폼 구성을 복사하는 것은 선택 사항입니다.
포함(Include) 섹션에서 안전성 구성(Safety Configuration)을 선택하여 이전에 구성된 구성을 복사해야 합니다.
복사하는 동안 기존 안전성 구성을 가져오는 시나리오:
-
나중에 복사: 이전에 폼에서 이벤트 그룹 복사(Copy Event Groups) 또는 이벤트 복사(Copy Events)를 통해 복사했거나 처음에 안전성 구성이 포함되지 않은 상태로 폼 복사(Copy Forms)를 사용한 경우에 수행됩니다. 변경 사항으로 업데이트를 선택해야 합니다. 이 시퀀스는 폼 조정 시 "적합한 항목"을 복사합니다. 여기서 AE 폼은 대상 스터디에 이미 존재합니다.
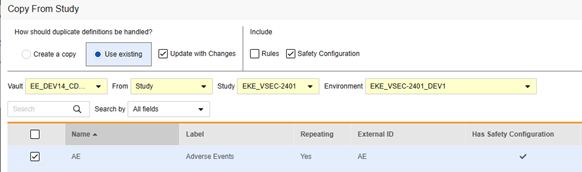
폼에 대한 안전성 구성을 복사하는 방법은 다음과 같습니다.
- Studio > 폼으로 이동합니다.
- 스터디에서 복사를 클릭합니다.
- 복사본 생성(Create a copy) 또는 기존 항목 사용/변경 사항으로 업데이트를 적절하게 선택합니다(위의 예 참조).
- 안전성 구성 확인란을 선택하면 폼과 연결된 안전성 구성도 복사합니다. Vault는 대화 상자의 안전성 구성 있음 열에 폼의 안전성 구성이 있는지를 나타냅니다. 이 작업에는 안전성 구성 관리 권한이 있는 스터디 역할이 필요합니다. 원본 스터디와 대상 스터디가 안전성 구성과 관련하여 일치하지 않는 경우 안전성 구성 확인란이 비활성화됩니다. 둘 다 설정되어 있어야 하며, 동일한 안전성 연동 유형을 사용해야 합니다.
- Vault를 선택합니다.
- 스터디에서 복사의 경우 복사할 위치(다른 스터디에서 또는 라이브러리에서)를 선택합니다.
- 복사할 스터디 환경을 선택합니다.
- 복사할 폼 정의를 검색하거나 스크롤하여 찾습니다.
- 복사할 폼을 선택합니다.
- 폼 복사를 클릭합니다. Vault는 폼 정의를 스터디로 복사하기 시작합니다.
- 선택 사항: 스터디에서 복사 대화 상자에서 다음 작업을 수행합니다.
- 요약 보기를 클릭하여 복사된 폼 목록과 복사본 상태를 확인합니다.
- 복사한 폼이 20개 이하인 경우, 로그 보기를 클릭하여 복사된 각 오브젝트 레코드에 대한 상태 세부 정보를 확인합니다.
- 복사한 폼이 20개를 넘는 경우, 완료되면 Vault에서 로그 파일을 다운로드할 수 있는 링크가 포함된 이메일 알림을 보냅니다.
- 완료되면 닫기(Close)를 클릭합니다. 닫기를 클릭하면 요약 또는 로그 파일에 더 이상 접근할 수 없습니다.
- 복사 후에는 반드시 복사된 폼의 안전성 폼 구성을 방문합니다. 매핑/값 번역에 대한 조정이 필요할 수 있습니다.
폼 복사에 대한 자세한 내용은 디자인 복사를 참조하십시오.
원본 스터디와 대상 스터디가 안전성 구성과 관련하여 일치하지 않는 경우 안전성 구성 확인란이 비활성화됩니다. 둘 다 설정되어 있어야 하며, 동일한 안전성 연동 유형을 사용해야 합니다.
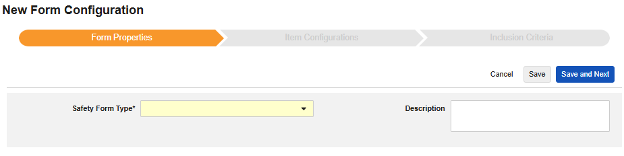
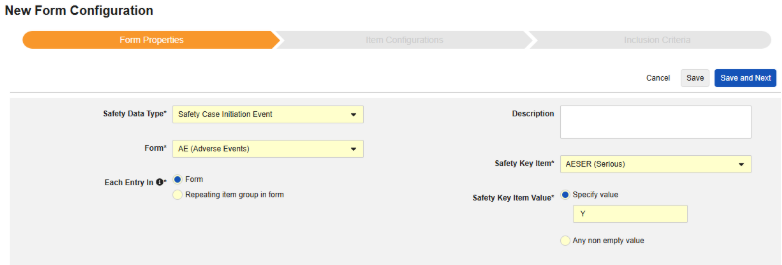
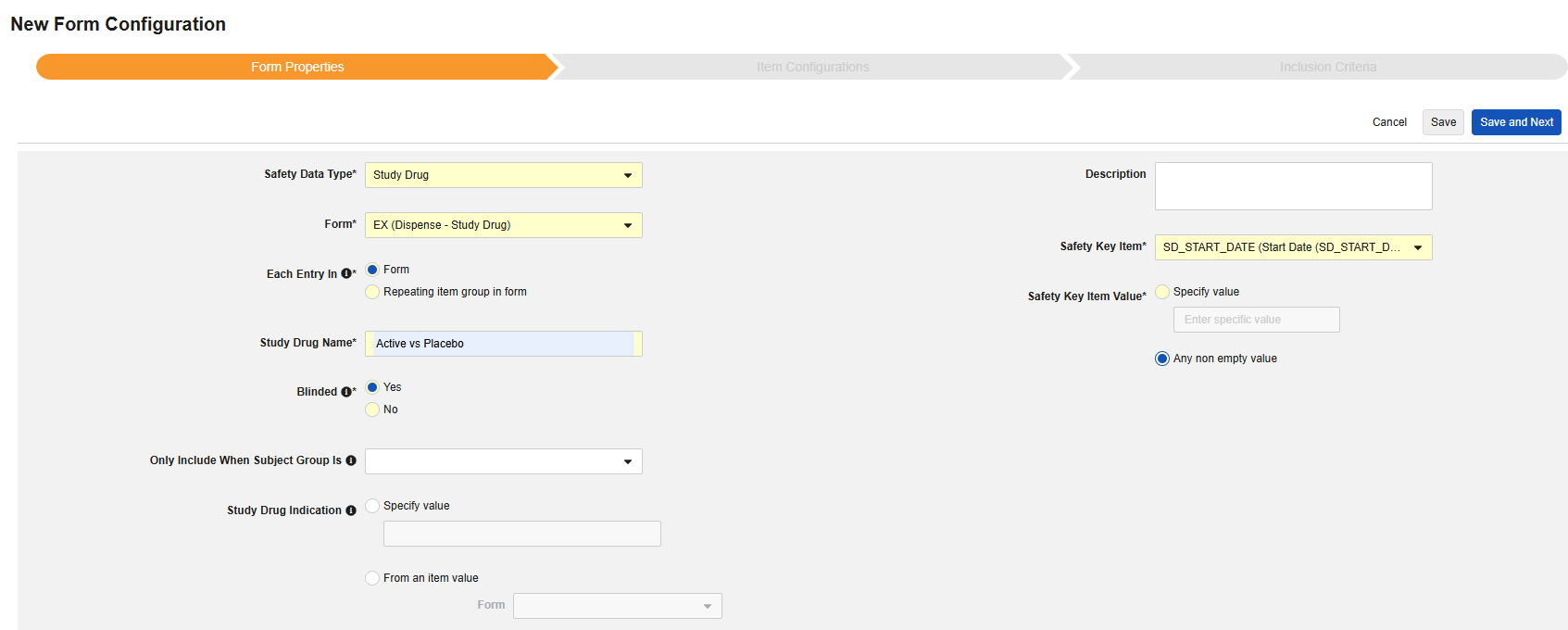
Form Properties
안전성 폼 구성의 첫 번째 단계는 폼 속성입니다. 드롭다운에서 안전성 유형을 선택하면 구성에 대한 일반 속성이 적용되며, 사용 가능한 속성은 안전성 유형에 따라 다릅니다.
| 안전성 데이터 유형 | 속성 | |||||
|---|---|---|---|---|---|---|
| 폼(Form) | 안전성 키 아이템 | 다음에 포함된 모든 입력 | 제품 정보 | 시스템 코멘트 대상 | 선택 | |
| 안전성 사례 시작 이벤트 | * | * | * | |||
| 스터디 약물 | * | * | * | * | ||
| Concomitant Medications | * | * | ||||
| Medical History | * | * | ||||
| 약물력 | * | * | ||||
| 시험 결과 | * | * | ||||
| 환자 특성 | * | |||||
| 사망 시 | * | |||||
| 시스템별 보고자/발신자 코멘트 | * | * | ||||
|
* 이 속성이 존재하며 안전성 데이터 유형에 필요함을 나타냅니다. 이 속성이 존재하며 안전성 데이터 유형에 선택 사항임을 나타냅니다. |
||||||
- 폼은 안전성 관련 항목에 매핑하기 위해 EDC 폼을 선택해야 합니다.
- 안전성 키 아이템은 폼이 다른 기준보다 먼저 사례 시작 또는 포함에 대해 고려되는지 여부를 평가하는 특수 속성입니다. 안전성 사례 시작 이벤트 유형의 경우, 전체 사례의 초기 전송(또는 이후 무효화)을 유도합니다. 스터디 약물 유형의 경우, 다른 날짜 기반 기준이 평가되기 전 포함의 초기 기준에 해당합니다.
- 다음에 포함된 모든 입력은 EDC 폼이 설계되는 방식에 따라 정보를 다양한 안전성 데이터 유형으로 그룹화하는 방법을 나타내는 설정입니다. 예시 및 자세한 내용은 다음 섹션에서 확인할 수 있습니다. 적절한 안전성 구성을 위해 이를 이해하는 것이 중요합니다.
- 제품 정보는 임상 시험의 알려진 스터디 약물, 이름, 눈가림(또는 눈가림 해제), 적응증, 적용되는 스터디 그룹에 대한 정보입니다.
- 시스템 주석 대상(System Comment Destination)은 표준화된 방식으로 시스템별 보고자/발신자 코멘트(Reporter / Sender Comments by the system)를 통한 EDC 데이터 전송에만 적용됩니다.
- 설명은 스터디 설계자에게 유용한 선택적 텍스트입니다.
다음에 포함된 모든 입력 - 설계 고려 사항
정의
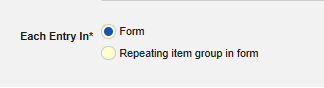
안전성 폼 구성의 폼 속성에 있는 다음에 포함된 모든 입력 개념은 데이터 전송 구성의 핵심입니다. 특히 Veeva EDC에 반복 폼의 데이터 또는 반복 아이템 그룹의 데이터를 고려하도록 지시합니다. 이 옵션에는 두 가지 선택 사항이 있습니다.
- 폼: 반복되지 않는 아이템 그룹에 입력된 데이터는 전송의 대상으로 간주됩니다. 예를 들어 스터디에서 여러 이벤트를 허용하기 위해 폼이 반복될 수 있지만, 폼의 아이템 그룹은 반복되어서는 안 됩니다.
- 폼의 반복 아이템 그룹: 폼의 반복 아이템 그룹에 입력된 데이터는 전송을 위해 고려됩니다. 이 경우 여러 이벤트는 폼 반복이 아닌 아이템 그룹의 각 반복으로 표시됩니다.
폼의 일부 아이템 구성에서는 다음에 포함된 모든 입력 폼 속성에서 사용 가능한 선택 항목이 다를 수 있습니다. 유형의 대부분의 아이템 구성은 '단일 항목'을 의미하지만, 일부 특이값은 반복되지 않거나 제한(반복 아이템 또는 반복되지 않는 아이템)이 없어야 합니다. 이 문서의 뒷부분에 있는 유형별 하위 섹션을 참조하고, 특이값에 대한 자세한 내용은 아이템 구성을 참조하십시오.
다음에 포함된 모든 입력: 폼
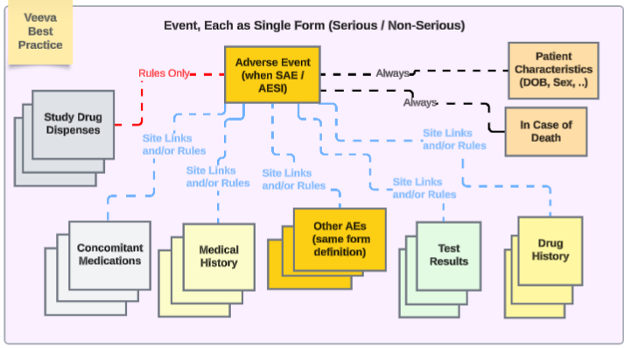
안전성 연동이 포함된 스터디 디자인에 대한 Veeva 모범 사례는 다양한 안전성 유형에서 반복 폼을 사용할 것을 권장합니다.
예에서 다음이 적용됩니다.
- 이상 사례 폼(심각한 경우와 심각하지 않은 경우 모두)은 동일한 폼 디자인을 사용합니다. 이렇게 하면 사이트 사용자의 업그레이드/다운그레이드 이슈가 방지되어, 한 위치(심각하지 않은 AE 폼)에서 다른 위치(심각한 SAE 폼)로 또는 그 반대로 이동할 필요가 없습니다.
- EDC 사용자가 여러 이벤트 안전성 사례를 관리해야 하는 경우, 날짜 규칙 및/또는 특정 사이트 링크를 통해 기본 이벤트에 다른 심각하거나 심각하지 않은 이벤트를 포함시킬 수 있습니다.
-
다른 안전성 데이터 유형은 단일 답변 정보(환자 특성 및 사망 시)를 제외하고 각각 반복 폼입니다. 이때 '반복 폼'은 다음 중 하나를 말합니다.
- 폼이 반복으로 정의되었습니다(예: 로그 폼).
- 스터디 방문 일정 전반에 걸쳐 발생하는 반복되지 않는 폼입니다(예: 방문 1의 스터디 약물, 방문 2의 스터디 약물...).
- 스터디 필요에 따라 사이트 의견(연결) 및/또는 날짜 기반 포함 규칙에는 다양한 유형에 걸쳐 적절한 관련 데이터가 포함될 수 있습니다.
이 구성을 사용하는 스터디 예시 및 스터디 디자인 폼에 적용된 안전성 데이터 유형:
다음에 포함된 모든 입력: 반복 아이템 그룹 대 폼
다음에 포함된 모든 입력의 두 가지 옵션을 모두 사용하는 예로 다음 스터디를 고려할 수 있습니다.
-
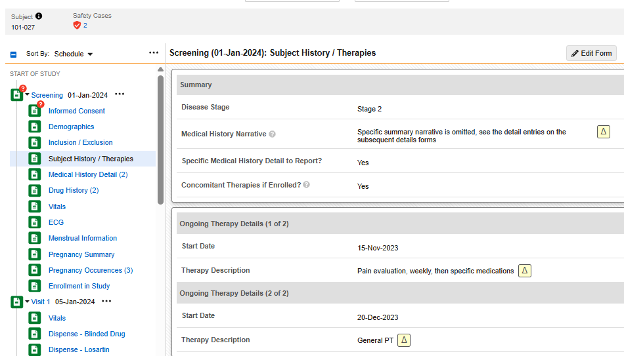
대상자 기록/치료 폼에서는 첫 번째 아이템 그룹에서 몇 가지 반복되지 않는 질문을 합니다.
- 보고할 특정 병력 세부 사항(Specific Medical History Detail to Report)?에 예라고 답하면 동적 규칙(폼 제출 시)이 일정의 다음 폼인 병력 세부 사항(Medical History Details)을 엽니다. 여기에 입력된 폼은 폼당 병력 항목으로 구성됩니다.
- 등록 시 병행 치료(Concomitant Therapies if Enrolled)?에 예라고 답하면 Progressive Display를 사용하여 동일한 폼에 반복 아이템 그룹을 표시합니다. 병력 항목은 필요에 따라 동일한 폼의 반복 아이템 그룹으로 입력됩니다.
-
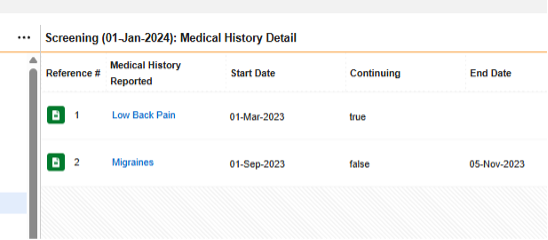
병력 세부 사항 폼은 반복되지만, 반복되지 않는 모든 아이템 그룹/질문이 디자인에 포함되어 있으므로 다음에 포함된 모든 입력(Each Entry In) = 폼(Form)입니다.
-
위의 그림 예시에서 안전성 사례에 대한 4개의 병력이 있는 것으로 간주하는 안전성 구성은 다음과 같습니다.
- 폼 CTHERAPY(대상자 기록/치료):
- 유형 = 병력
- 다음에 포함된 모든 입력 = 폼의 반복 아이템 그룹
-
폼 MH(병력 세부 사항):
- 유형 = 병력
- 다음에 포함된 모든 입력 = 폼
- 폼 CTHERAPY(대상자 기록/치료):
다음에 포함된 모든 입력: 이벤트 폼에 포함된 관련 안전성 데이터
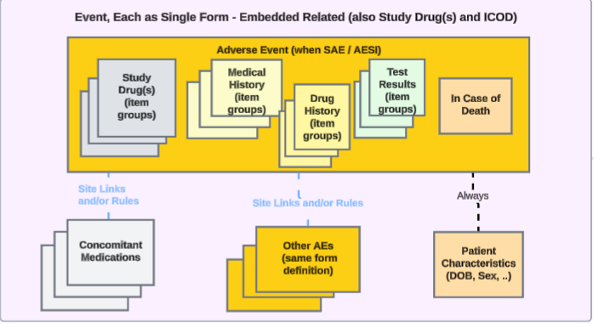
안전성 사례 시작 이벤트 폼에 이벤트 관련 안전성 데이터가 포함된 스터디의 경우 접근 방식은 다음과 같습니다.
이벤트 폼에 포함된 아이템 그룹은 반복 아이템 그룹, 스터디 약물 조제, 약물력, 병력 또는 시험 결과, 사망 시(반복되지 않는 아이템 그룹)로 다룰 수 있습니다. 이 경우, 이 포함된 데이터에 대한 스터디 디자인에 독립형 폼이 설정되지 않습니다.
이벤트가 안전성 사례를 시작할 때 사이트 사용자가 관련 정보를 입력할 수 있는 이러한 스터디 디자인에 대한 안전성 관련 데이터를 전송하기 위해, 안전성 사례 시작 이벤트 데이터 유형에 이미 매핑된 EDC 폼은 병용약물(Concomitant Medications), 병력(Medical History), 약물력(Drug History), 스터디 약물(Study Drug), 시험 결과(Test Results) 또는 사망 시(In Case of Death)의 경우와 같은 다른 안전성 데이터 유형에 매핑될 수 있습니다.
- 안전성 사례 시작 이벤트 또는 환자 특성 안전성 데이터 유형에 대해 임베드된 데이터를 구성할 수 없습니다. 시스템에 의한 보고자 / 발신자 코멘트(Reporter / Sender Comments by System) 데이터 유형은 이미 안전성 사례 시작 이벤트 데이터 유형에 대한 이중 사용을 지원합니다.
- 안전성 사례 시작 이벤트 데이터 유형에 이미 매핑된 EDC 폼을 다른 안전성 데이터 유형에 매핑하는 경우, 다음에 포함된 모든 입력(Each Entry In) 필드가 폼 내 반복 아이템 그룹을 자동으로 선택합니다.
- 사망 관련 기록, 환자 특성 및 시스템에 의한 보고자 / 발신자 코멘트 안전성 데이터 유형에 대한 Each Entry In 필드는 이 필드에 대해 폼 옵션만 허용합니다.
다음에 포함된 모든 입력: 이벤트의 반복 아이템 그룹
하나의 EDC 폼 디자인에서 안전성 사례의 여러 이벤트를 추적하는 스터디의 경우 접근 방식은 다음과 같습니다.
- 안전성 사례는 이벤트가 포함된 폼의 존재만으로 시작됩니다.
- 이 스터디 디자인에서는 다음에 포함된 모든 입력이 폼의 반복 아이템 그룹(Repeating item group in form)으로 설정되어야 합니다.
안전성 키 아이템/값
폼 속성 설정 안전성 키 아이템(Safety Key Item) 및 안전성 키 아이템 값(Safety Key Item Value)은 사례의 시작 또는 사례에 대한 폼 포함을 평가합니다. 이는 다음 안전성 유형에 적용됩니다.
- 안전성 사례 시작 이벤트 - 시스템 평가가 true이면 안전성 시스템으로의 첫 번째 전송이 시작됩니다. 반대로, 시스템에서 평가를 false라고 판단하고 이전 안전성 사례가 전송된 경우, 안전성 시스템으로 무효화가 전송됩니다.
- 스터디 약물 - 시스템 평가가 true경우 폼의 조제 정보는 사례에 포함될 수 있는 것으로 간주됩니다. 스터디 약물 포함 기준에 대한 추가 평가는 최종적으로 안전성 사례와의 데이터 전송을 결정합니다.
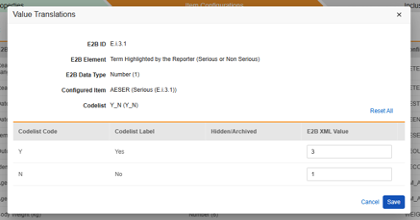
안전성 키 아이템 값을 코드 목록에 참조하려면 코드 목록 레이블이 아닌 코드 목록 코드를 지정해야 합니다.
다음은 안전성 사례 시작 이벤트 유형에 대한 몇 가지 일반적인 예입니다.
예시 1:
-
안전성 키 아이템은 코드 목록 아이템 "AESER"를 참조하며, 안전성 사례를 시작하는 데 코드 목록 코드 "Y"가 필요합니다.
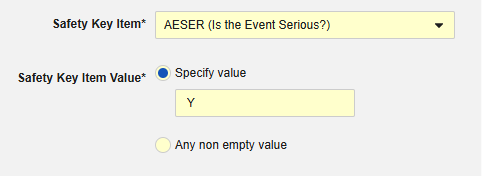
안전성 키 아이템은 AE 폼의 다음 아이템을 참조합니다. 안전성 키 아이템 값에는 코드 목록 코드가 필요하며, 사이트 사용자는 코드 목록 레이블에서 선택합니다.
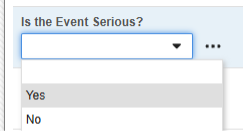
- 이 규정된 답변과 함께 이러한 폼을 처음 제출하면, 폼이 안전성 전송 및 관련 데이터를 전송할 수 있는 자격을 갖추게 됩니다.
- 전송은 운영 스터디 설정에 구성된 타이밍에 발생합니다. 자세한 내용은 여기를 참조하십시오.
- 또한 전송을 진행하려면 E2B 필드 E.i.1.1a(현지 언어로 된 기본 소스로 보고된 반응/이벤트(현지 언어로 된 기본 소스로 보고된 반응/이벤트))에도 폼에 값이 비어 있지 않아야 합니다.
- 이 예에서는 이상 사례 폼에 대한 심각한 질문을 사용하여 안전성 사례를 전송할지 여부를 결정합니다. 이 필드는 모든 스터디/폼 디자인에서 일반적으로 E2B 위치 E.i.3.1(보고자가 강조 표시한 용어(Term Highlighted by the Reporter))에도 매핑됩니다.
첫 번째 안전성 시스템으로 전송한 후, 이러한 조건 중 어느 것도 더 이상 충족될 수 없습니다. (예: 심각함 = 아니요 또는 이벤트 보고자/이벤트 용어 값 부재). 이 경우 시스템은 더 이상 안전성 사례로 자격이 없음을 나타내는 무효화(Nullification) 팔로우업을 안전성 시스템으로 자동 전송합니다. 사이트 사용자가 폼 데이터를 수정한 후에는 안전성 연동과 관련하여 특정 사이트 작업이 필요하지 않습니다.
예시 2:
- 첫 번째 예시에서는 E2B 위치(E.i.3.1)를 안전성 키 아이템으로 사용했습니다. 그러나 E2B 필드에 매핑하는 데 사용되지 않는 필드를 포함하여 모든 필드를 해당 목적으로 사용할 수 있습니다.
- 이 예시에서는 대신 AE 폼에서 더 일반적인 질문을 사용합니다.
이것이 폼의 주요 심각한 질문은 아니지만, 심각한 이상 사례와 심각하지 않을 수도 있지만 여전히 데이터를 안전성 시스템으로 전송해야 하는 '특별 관심 이상 사례'(AESI) 모두에 대한 안전성 사례를 시작할 수 있도록 합니다.
예시 3:
- 다음 예시에서는 안전성 사례 시작 및 무효화가 사이트 사용자에게 더 투명하게 표시되는 한편, 하나의 안전성 키 아이템 값을 계속 사용합니다.
-
이 코드 목록의 선택 항목:
- "새 안전성 사례"(사례의 코드 목록 코드)는 안전성 키 아이템 값에 사용됩니다. 따라서 이 선택만 안전성 사례를 시작합니다.
- "기존 사례에 연결" 코드는 답변이 있으면 안전성 키 아이템 값을 false로 평가합니다. 따라서 폼이 독립형/추가 사례를 시작하지 않습니다. 대신 Studio 규칙을 사용하여 사이트 사용자가 현재 폼을 안전성 사례를 시작한 다른 이벤트에 연결하도록 합니다.
- "더 이상.."은 이전에 안전성 사례에 대한 자격을 갖추었으며 전송된 이벤트에 사용됩니다. 사이트 사용자는 다운그레이드 또는 무효화를 표시하는 한편, EDC 시스템은 이 선택의 코드 목록 코드를 false로 평가합니다. 이로 인해 이전에 시작된 안전성 사례에 대한 무효화 팔로우업이 발생합니다.
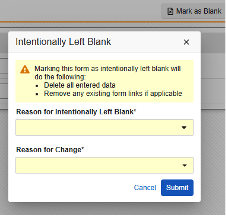
무효화
안전성 사례에 포함된 데이터 변경이 발생할 때마다 Veeva EDC에서 팔로우업을 전송합니다. 무효화는 다음과 같은 속성이 있는 특별한 종류의 팔로우업입니다.
-
다음 중 하나에 해당하는 경우 발생합니다.
- 안전성 키 아이템 및 안전성 키 아이템 값 평가가 false가 됩니다.
- 또는 EDC 폼의 E.i.1.1a에 대한 아이템 값이 비게 됩니다.
- 무효화 유형 E2B 메시지로 표시됩니다.
- 안전성 사례를 안전성 시스템에 보내는 마지막 전송입니다.
- 참고: 사례의 첫 번째 전송은 이전에 발생했습니다. Veeva EDC는 첫 번째 전송(즉, 초기 전송 타이머 이후)에 위의 두 가지 조건을 재평가하고, 안전성 시스템으로 전송하지 않고 즉시 안전성 사례를 무효화합니다. 이는 첫 번째 전송 타이머가 끝나기 전에 사이트 사용자가 실수를 하거나 폼을 재설정하는 등의 작업을 수행할 때 가장 일반적으로 발생합니다.
- E2B는 이러한 전송에 대해 무효화 사유를 요구합니다. 사이트 사용자에게 질문하도록 스터디를 구성할 수 있습니다. 사이트 답변에 대해 구성되지 않았거나 사이트가 답변하지 않는 경우, 시스템은 기본 이유인 "사례가 더 이상 처음 전송된 시점의 조건을 충족하지 않습니다. 여기에는 현재 심각하지 않은 것으로 다운그레이드된 이벤트 또는 모든 이벤트를 제거하는 사용자 작업이 포함될 수 있습니다"를 사용합니다.
무효화의 일반적인 예:
-
'다운그레이드'(예: 안전성 키 아이템/값을 통해 안전성 사례를 충족하는 데 사용) 상황이 아니지만 이벤트가 여전히 지속됨
Veeva EDC의 안전성 사례에 대해 무효화가 발생하면 활성 안전성 사례로 되돌아가지 않습니다. 동일한 폼을 변경하여 안전성 키 아이템/값이 true이고 E.i.1.1a의 값이 다시 한 번 비어 있지 않으면 새 안전성 사례가 생성되고 전송됩니다. 원래의 안전성 사례가 다시 시작되지 않습니다.
안전성 데이터 유형별
안전성 사례 시작 이벤트
이 안전성 데이터 유형의 폼 구성은 안전성 사례 전송 프로세스를 시작하는 데 중요합니다. 이후 다른 모든 안전성 데이터 유형은 구성된 규칙에 따라 사례로 가져옵니다.
이 유형의 새 안전성 폼 구성을 생성하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
- 새 폼 구성 버튼을 클릭합니다.
- 안전성 데이터 유형(Safety Data Type)에 대해 안전성 사례 시작 이벤트(Safety Case Initiation Event)를 선택합니다.
- 이 구성 유형에 적용할 폼을 선택합니다.
- 다음에 포함된 모든 입력에 대해 적절한 선택을 선택합니다. 이 선택은 폼의 디자인에 따라 다릅니다. 자세한 내용과 예시는 다음에 포함된 모든 입력 디자인 고려 사항을 참조하십시오.
- 선택적으로 설명을 나타냅니다.
- 적절한 안전성 키 아이템/안전성 키 아이템 값을 나타냅니다. 참고: 코드 목록 아이템 정의의 경우에는 코드 목록 코드를 지정해야 합니다.
- 저장(Save) 또는 저장 및 다음(Save and Next)을 클릭합니다.
안전성 데이터 유형, 폼 및 다음에 포함된 모든 입력 설정은 저장한 후에는 편집할 수 없습니다. 아이템 구성 및 포함 기준 탭의 추가 구성은 이러한 설정에 따라 달라집니다. 이러한 설정을 변경하려면 폼 구성을 삭제하고 다시 생성해야 합니다.
스터디 약물
이 안전성 데이터 유형은 스터디 약물의 투약/조제 정보, 즉 임상 스터디에서 대상자에 대해 테스트하고 있는 정보를 추적하는 데 사용됩니다. 정보는 안전성 사례의 제품/약물 섹션(E2B의 G.* 섹션)으로 전달됩니다. 이 유형과 함께 여러 폼을 사용할 수 있습니다.
이 유형의 새 안전성 폼 구성을 생성하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
- 새 폼 구성 버튼을 클릭합니다.
- 안전성 데이터 유형에 맞는 스터디 약물을 선택합니다.
- 이 구성 유형에 적용할 폼을 선택합니다.
- 다음에 포함된 모든 입력에 대해 적절한 선택을 선택합니다. 이 선택은 폼의 디자인에 따라 다릅니다. 자세한 내용과 예시는 다음에 포함된 모든 입력 디자인 고려 사항을 참조하십시오.
- 참고: 안전성 사례 시작 이벤트에 이미 매핑된 EDC 폼이 선택된 경우, 다음에 포함된 모든 입력은 기본적으로 폼의 반복 아이템 그룹으로 설정됩니다.
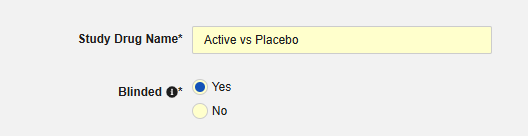
- 스터디 약물 이름을 나타냅니다. 중요: 이 값은 일반적으로 대상 안전성 시스템에서 약물이 명명되는 방식과 직접 일치해야 합니다. 시스템에서 E2B의 G.* 위치에 대한 스터디 약물의 전송을 처리하는 방법에 대해서는 대상 안전성 시스템의 문서를 참조하십시오.
-
스터디 약물이 시험에서 눈가림으로 간주되는지 여부를 나타냅니다. 이 속성은 표시일 뿐이며, 보고 목적으로만 사용됩니다. 모든 데이터는 EDC의 데이터에 제한이 적용되더라도 눈가림되지 않은 상태로 안전성 시스템으로 전송됩니다.
-
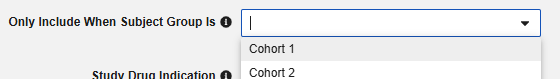
선택적으로 스터디 디자인에서 이 스터디 약물만 적용되는 대상자 그룹을 선택합니다. 이 세트를 사용하면 그룹에 속하지 않은 대상자는 안전성 전송에서 스터디 약물이 생략됩니다.
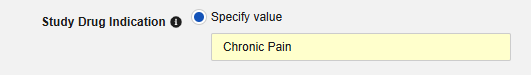
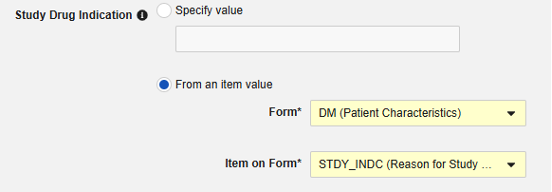
- 선택적으로 대상자의 모든 사례에 적용할 스터디 약물 적응증을 나타냅니다. 다음과 같이 두 가지 옵션이 있습니다.
- 선택적으로 설명을 나타냅니다.
- 적절한 안전성 키 아이템/안전성 키 아이템 값을 나타냅니다. 스터디 약물 유형의 경우, 평가를 통해 전송에 포함될 수 있는 폼/조제를 고려합니다. 또한 안전성 사례에 스터디 약물의 적절한 조제를 가져오는 데 추가 포함 기준(스터디 약물 포함 기준 참조)을 평가합니다.
- 저장(Save) 또는 저장 및 다음(Save and Next)을 클릭합니다.
안전성 데이터 유형, 폼 및 다음에 포함된 모든 입력 설정은 처음 저장될 때만 읽습니다. 아이템 구성 및 포함 기준 탭의 추가 구성은 이러한 설정에 따라 달라집니다. 이러한 설정을 변경하려면 폼 구성을 삭제하고 다시 생성해야 합니다.
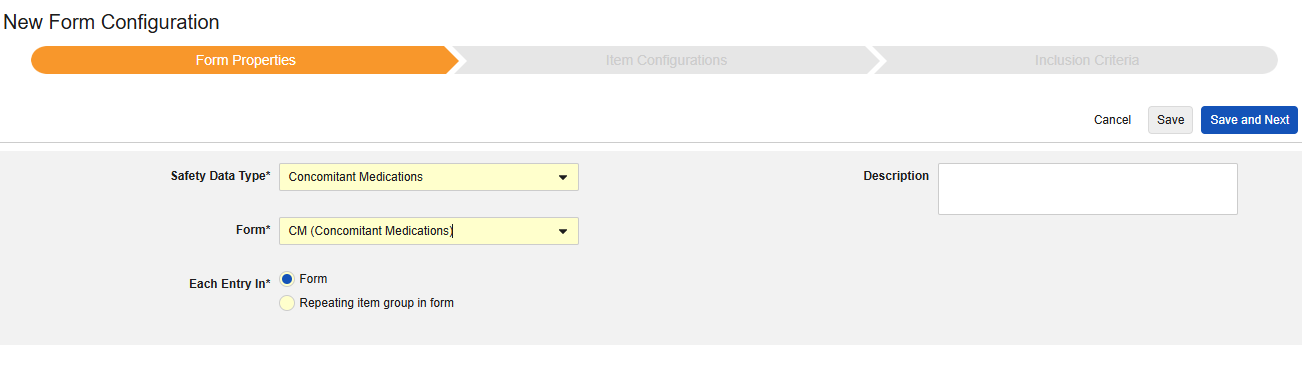
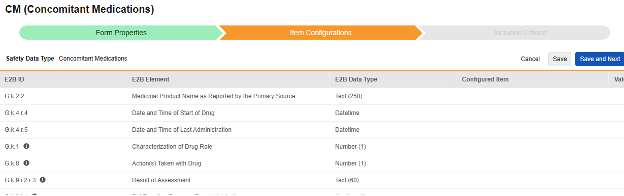
Concomitant Medications
이 유형의 안전성 구성은 스터디의 병용약물 폼에 적용됩니다. 정보는 안전성 사례의 제품/약물 섹션(E2B의 G.* 섹션)으로 (E2B의 G.* 섹션) 이 유형과 함께 여러 폼을 사용할 수 있습니다.
이 유형의 새 안전성 폼 구성을 생성하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
- 새 폼 구성 버튼을 클릭합니다.
- 안전성 데이터 유형에 맞는 병용약물을 선택합니다.
- 이 구성 유형에 적용할 폼을 선택합니다.
- 다음에 포함된 모든 입력에 대해 적절한 선택을 선택합니다. 이 선택은 폼의 디자인에 따라 다릅니다. 자세한 내용과 예시는 다음에 포함된 모든 입력 디자인 고려 사항을 참조하십시오.
- 참고: 안전성 사례 시작 이벤트에 이미 매핑된 EDC 폼이 선택된 경우, 다음에 포함된 모든 입력은 기본적으로 폼의 반복 아이템 그룹으로 설정됩니다.
- 선택적으로 설명을 나타냅니다.
- 저장(Save) 또는 저장 및 다음(Save and Next)을 클릭합니다.
안전성 데이터 유형, 폼 및 다음에 포함된 모든 입력 설정은 처음 저장될 때만 읽습니다. 아이템 구성 및 포함 기준 탭의 추가 구성은 이러한 설정에 따라 달라집니다. 이러한 설정을 변경하려면 폼 구성을 삭제하고 다시 생성해야 합니다.
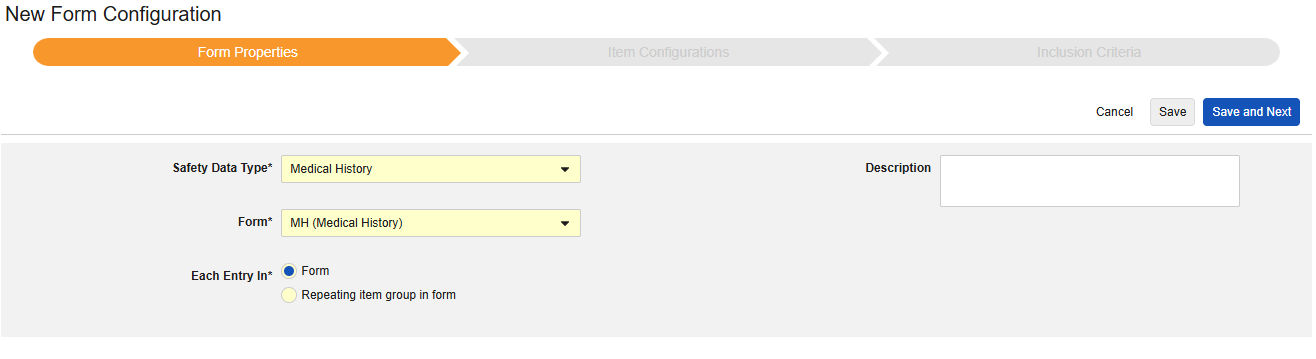
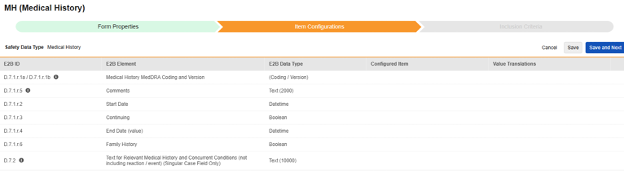
Medical History
이 유형의 안전성 구성은 스터디의 병력 폼에 적용됩니다. 정보는 안전성 사례의 E2B D.7 섹션으로 전달됩니다. 이 유형과 함께 여러 폼을 사용할 수 있습니다.
이 유형의 새 안전성 폼 구성을 생성하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
- 새 폼 구성 버튼을 클릭합니다.
- 안전성 데이터 유형에 맞는 병력을 선택합니다.
- 이 구성 유형에 적용할 폼을 선택합니다.
- 다음에 포함된 모든 입력에 대해 적절한 선택을 선택합니다. 이 선택은 폼의 디자인에 따라 다릅니다. 자세한 내용과 예시는 다음에 포함된 모든 입력 디자인 고려 사항을 참조하십시오.
- 참고: 안전성 사례 시작 이벤트에 이미 매핑된 EDC 폼이 선택된 경우, 다음에 포함된 모든 입력은 기본적으로 폼의 반복 아이템 그룹으로 설정됩니다.
- 선택적으로 설명을 나타냅니다.
- 저장(Save) 또는 저장 및 다음(Save and Next)을 클릭합니다.
안전성 데이터 유형, 폼 및 다음에 포함된 모든 입력 설정은 처음 저장될 때만 읽습니다. 아이템 구성 및 포함 기준 탭의 추가 구성은 이러한 설정에 따라 달라집니다. 이러한 설정을 변경하려면 폼 구성을 삭제하고 다시 생성해야 합니다.
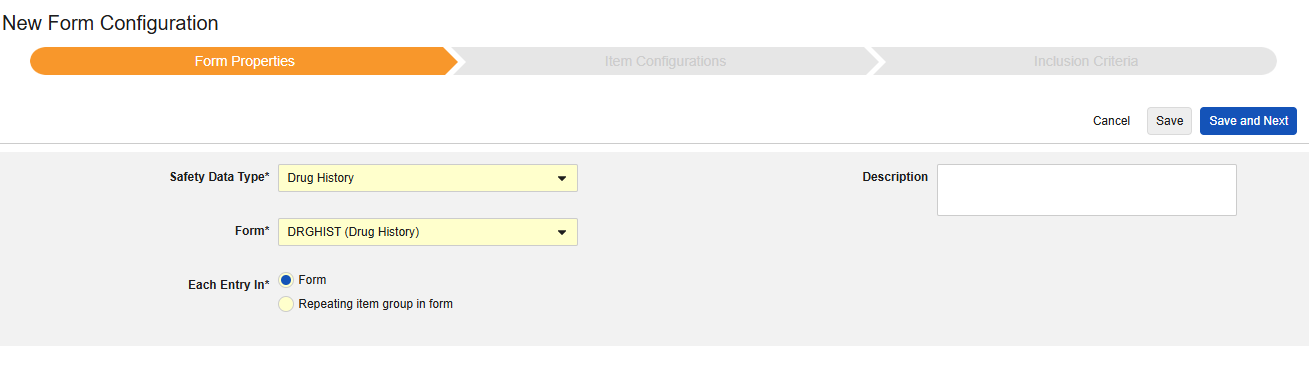
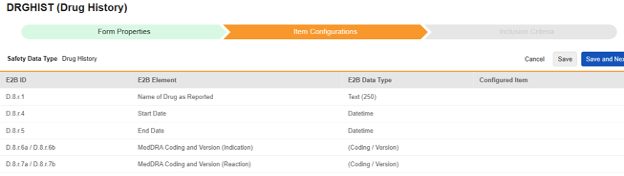
약물력
이 유형의 안전성 구성은 스터디의 약물력 폼에 적용됩니다. 정보는 안전성 사례의 E2B D.8 섹션으로 전달됩니다.
이 유형의 새 안전성 폼 구성을 생성하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
- 새 폼 구성 버튼을 클릭합니다.
- 안전성 데이터 유형에 맞는 약물력을 선택합니다.
- 이 구성 유형에 적용할 폼을 선택합니다.
- 다음에 포함된 모든 입력에 대해 적절한 선택을 선택합니다. 이 선택은 폼의 디자인에 따라 다릅니다. 자세한 내용과 예시는 다음에 포함된 모든 입력 디자인 고려 사항을 참조하십시오.
- 참고: 안전성 사례 시작 이벤트에 이미 매핑된 EDC 폼이 선택된 경우, 다음에 포함된 모든 입력은 기본적으로 폼의 반복 아이템 그룹으로 설정됩니다.
- 선택적으로 설명을 나타냅니다.
- 저장(Save) 또는 저장 및 다음(Save and Next)을 클릭합니다.
안전성 데이터 유형, 폼 및 다음에 포함된 모든 입력 설정은 처음 저장될 때만 읽습니다. 아이템 구성 및 포함 기준 탭의 추가 구성은 이러한 설정에 따라 달라집니다. 이러한 설정을 변경하려면 폼 구성을 삭제하고 다시 생성해야 합니다.
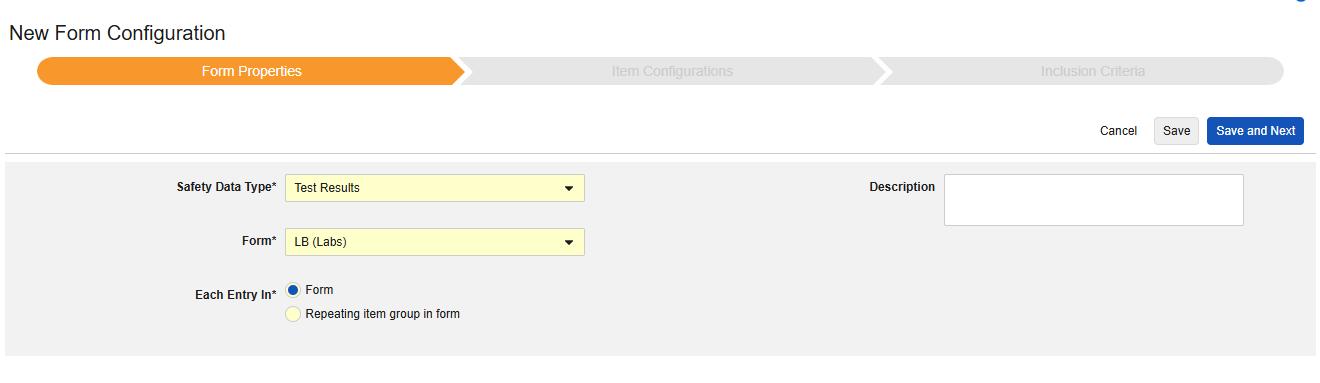
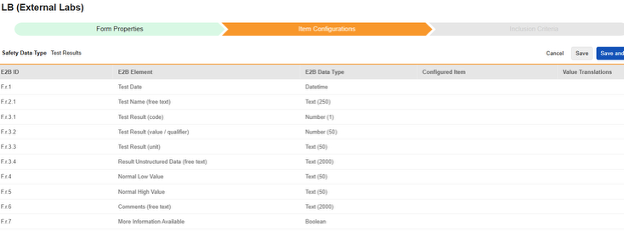
시험 결과
이 유형의 안전성 구성은 스터디의 실험실/시험 결과 폼에 적용됩니다. 정보는 안전성 사례의 E2B F.* 섹션으로 전달됩니다. 이 유형과 함께 여러 폼을 사용할 수 있습니다.
현재 시스템은 E2B 스터디를 위한 로컬 실험실 모듈 폼(실험실 패널)에 대한 매핑을 지원하지 않습니다.
이 유형의 새 안전성 폼 구성을 생성하는 방법은 다음과 같습니다.
1. Studio > 폼 구성에서 스터디로 이동합니다.
- 새 폼 구성 버튼을 클릭합니다.
- 안전성 데이터 유형에 대해 시험 결과를 선택합니다.
- 이 구성 유형에 적용할 폼을 선택합니다.
- 다음에 포함된 모든 입력에 대해 적절한 선택을 선택합니다. 이 선택은 폼의 디자인에 따라 다릅니다. 자세한 내용과 예시는 다음에 포함된 모든 입력 디자인 고려 사항을 참조하십시오.
- 참고: 안전성 사례 시작 이벤트에 이미 매핑된 EDC 폼이 선택된 경우, 다음에 포함된 모든 입력은 기본적으로 폼의 반복 아이템 그룹으로 설정됩니다.
- 선택적으로 설명을 나타냅니다.
- 저장(Save) 또는 저장 및 다음(Save and Next)을 클릭합니다.
안전성 데이터 유형, 폼 및 다음에 포함된 모든 입력 설정은 처음 저장될 때만 읽습니다. 아이템 구성 및 포함 기준 탭의 추가 구성은 이러한 설정에 따라 달라집니다. 이러한 설정을 변경하려면 폼 구성을 삭제하고 다시 생성해야 합니다.
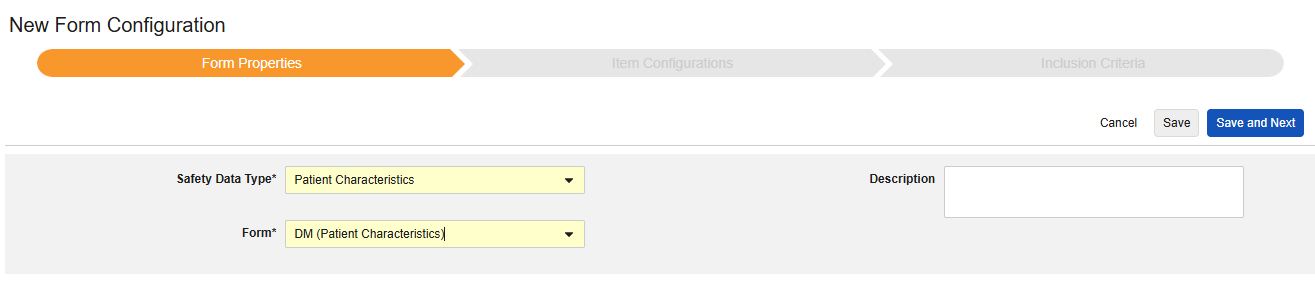
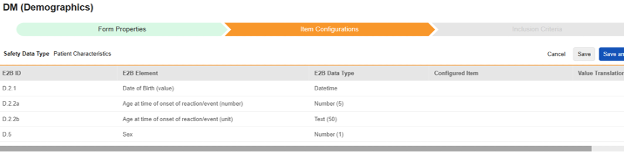
환자 특성
이 유형의 안전성 구성은 대상자에 대한 일반 정보에 적용됩니다. 반복되지 않는 아이템 그룹의 아이템만 이 유형에 매핑할 수 있습니다. 또한 이러한 값은 안전성 사례당 한 번이므로, 대상자의 사례집에서 두 번 이상 발생해서는 안 됩니다. 유형에는 여러 폼을 사용할 수 있습니다(예: 한 폼에서는 성별(Sex), 다른 폼에서는 생년월일(Date of Birth)).
이 유형의 새 안전성 폼 구성을 생성하는 방법은 다음과 같습니다.
1. Studio > 폼 구성에서 스터디로 이동합니다.
- 새 폼 구성 버튼을 클릭합니다.
- 안전성 데이터 유형에 맞는 환자 특성을 선택합니다.
- 이 구성 유형에 적용할 폼을 선택합니다.
- 선택적으로 설명을 나타냅니다.
- 저장(Save) 또는 저장 및 다음(Save and Next)을 클릭합니다.
안전성 데이터 유형 및 폼은 처음 저장된 후에만 읽힙니다. 아이템 구성 및 포함 기준 탭의 추가 구성은 이러한 설정에 따라 달라집니다. 이러한 설정을 변경하려면 폼 구성을 삭제하고 다시 생성해야 합니다. 다음에 포함된 모든 입력은 이 유형에 대한 옵션이 아닙니다.
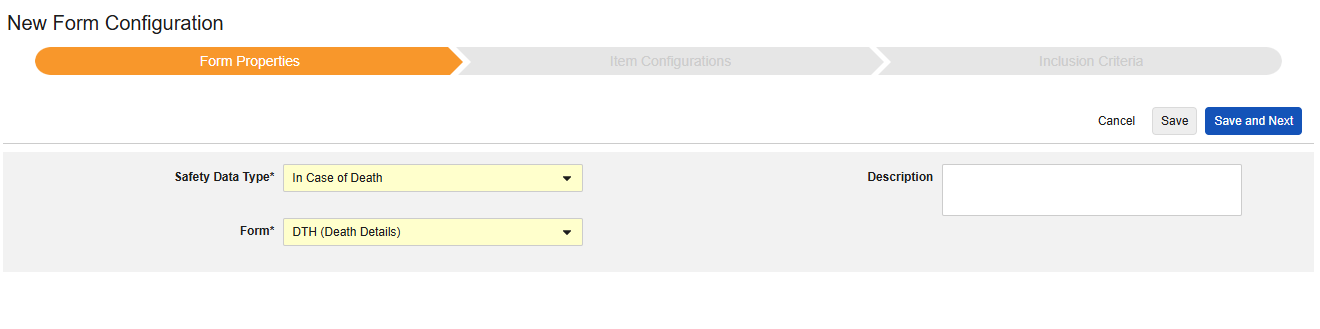
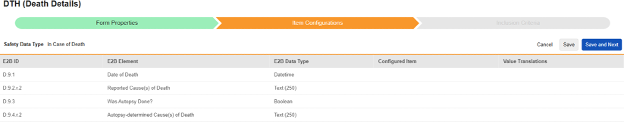
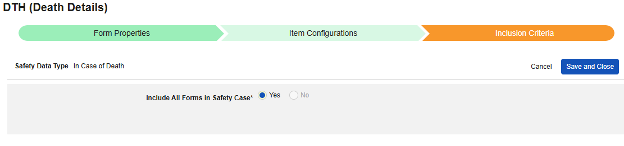
사망 시
이 유형의 안전성 구성은 대상자에 대한 사망 세부 사항과 관련된 폼에 적용됩니다. 이 유형의 일부 필드는 반복되지 않아야 하며(예: 사망 날짜), 다른 필드는 반복되거나 반복되지 않을 수 있습니다(사망 원인). 유형에는 여러 폼을 사용할 수 있습니다(예: 한 폼에서는 사망 날짜, 다른 폼에서는 사망 원인).
이 유형의 새 안전성 폼 구성을 생성하는 방법은 다음과 같습니다.
1. Studio > 폼 구성에서 스터디로 이동합니다.
- 새 폼 구성 버튼을 클릭합니다.
- 안전성 데이터 유형에 맞는 사망 시 항목을 선택합니다.
- 이 구성 유형에 적용할 폼을 선택합니다.
- 참고: 안전성 사례 시작 이벤트에 이미 매핑된 EDC 폼이 선택된 경우, 다음에 포함된 모든 입력은 기본적으로 폼으로 설정됩니다.
- 선택적으로 설명을 나타냅니다.
- 저장(Save) 또는 저장 및 다음(Save and Next)을 클릭합니다.
안전성 데이터 유형 및 폼은 처음 저장된 후에만 읽힙니다. 아이템 구성 및 포함 기준 탭의 추가 구성은 이러한 설정에 따라 달라집니다. 이러한 설정을 변경하려면 폼 구성을 삭제하고 다시 생성해야 합니다. 다음에 포함된 모든 입력은 이 유형에 대한 옵션이 아닙니다.
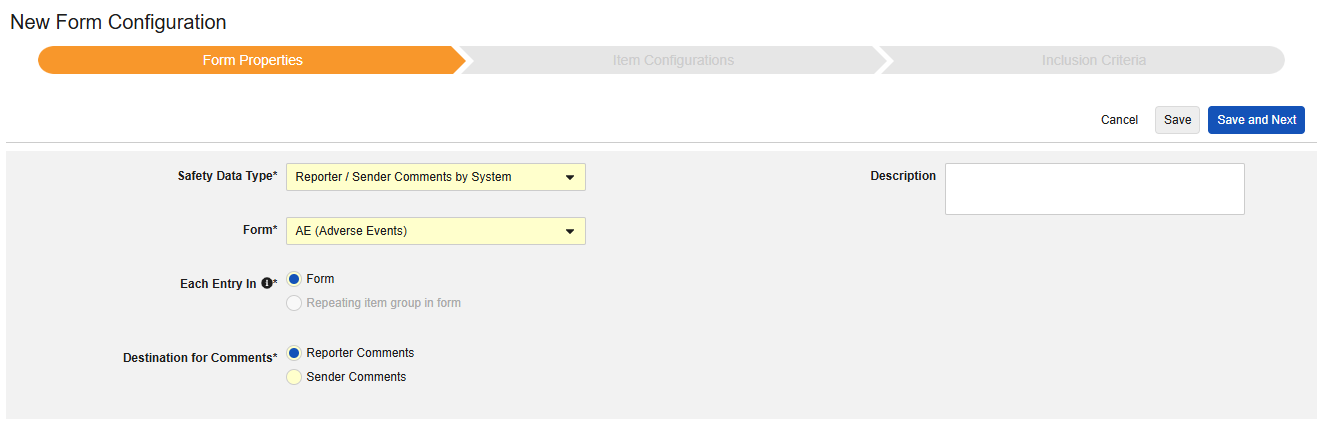
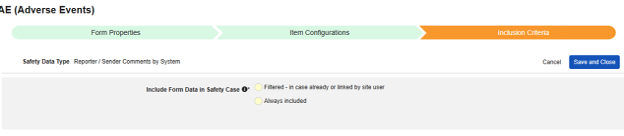
시스템별 보고자/발신자 코멘트
이러한 유형의 안전성 구성은 사례집의 모든 폼에 적용할 수 있습니다. 시스템별 보고자/발신자 코멘트 기능은 E2B 형식의 어느 곳에도 맞지 않는 데이터 전송을 위해 특별히 설계되었습니다.
이 유형의 새 안전성 폼 구성을 생성하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
- 새 폼 구성 버튼을 클릭합니다.
- 안전성 데이터 유형에 맞는 시스템별 보고자/발신자 코멘트를 선택합니다.
- 이 구성 유형에 적용할 폼을 선택합니다.
- 선택적으로 설명을 나타냅니다.
- 코멘트 대상을 선택합니다. 보고자 코멘트(Reporter Comments) 선택 항목은 정보를 E2B H.2 위치로 전송합니다. 발신자 코멘트(Sender Comments)는 정보를 E2B H.4 위치로 전송합니다. H.2 및 H.4는 안전성 사례 시작 이벤트 폼의 아이템으로 구성할 수도 있으며, 이 경우 사이트에서 입력한 정보가 시스템 생성 정보보다 선행하며 명확히 구분됩니다.
. - 저장(Save) 또는 저장 및 다음(Save and Next)을 클릭합니다.
안전성 데이터 유형 및 폼은 처음 저장된 후에만 읽힙니다. 아이템 구성 및 포함 기준 탭의 추가 구성은 이러한 설정에 따라 달라집니다. 이러한 설정을 변경하려면 폼 구성을 삭제하고 다시 생성해야 합니다. 다음에 포함된 모든 입력은 이 유형에 대한 옵션이 아닙니다.
아이템 구성
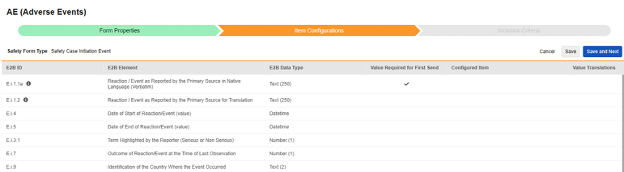
안전성 폼 구성의 두 번째 단계는 아이템 구성 탭입니다. 예를 들어 다음 AE(이상 사례) 폼 디자인은 안전성 사례 시작 이벤트 유형으로 분류되었습니다.
이 그리드의 목적은 폼 디자인(아이템 정의)의 답변을 E2B 형식의 적절한 위치에 할당하는 것입니다.
그리드의 열 요약:
| 열 | 메모 |
|---|---|
| E2B ID | E2B(R3) 형식의 위치 |
| E2B 요소 | E2B 위치 레이블 |
| E2B 아이템 유형 | 해당 E2B 위치의 데이터 유형입니다.
|
| 첫 번째 전송에 필요한 값 |
|
| 구성된 아이템 |
폼의 반복 아이템 그룹을 사용하는 경우, 항목을 구성하는 모든 아이템 정의(예: 병력, 실험실 등)가 동일한 반복 아이템 그룹에 있는지 확인합니다. 일부 E2B 위치는 동일한 반복 아이템 그룹 외부에 있을 수 있지만, 드문 예외입니다. 이러한 특이값에 대해서는 이 섹션 뒤에 있는 유형별 세부 사항을 참조하십시오. |
| 값 번역 |
|
값 번역
E2B 위치에 매핑되는 아이템 정의가 코드 목록 또는 불린(Boolean)(확인란) 데이터 유형이고 E2B 위치에 매우 구체적인 E2B 값이 필요한 경우, 값 번역(Value Translations)을 설정해야 전송이 올바르게 작동합니다.
- 구성된 아이템(Configured Item) 열에서 아이템 정의(Item Definition)를 지정합니다.
-
구성된 아이템 열 옆에 있는 값 번역 열의 셀을 클릭합니다. 값 번역을 구성할 수 있는 경우, 마우스를 가져가면 셀이 주황색으로 표시됩니다.
- 각 코드 목록 또는 불린(Boolean) 유형 아이템의 경우 자유 텍스트 필드에 유효한 E2B XML 값을 입력합니다.
- 코드 목록 코드가 E2B 위치에 이미 유효한 경우 E2B XML 값을 입력할 필요가 없습니다.
- 스터디 디자인에 사용 가능한 E2B 옵션보다 더 많은 코드 목록 항목이 있는 경우, 여러 코드 목록 항목을 동일한 E2B XML 값에 매핑할 수 있습니다.
- 잘못된 코드 목록 코드가 E2B XML 값으로 번역되지 않으면 Studio 검증 시 오류가 표시됩니다.
- 완료되면 저장을 클릭합니다.
- 값 번역이 지정되면 구성된 번역 수가 셀에 표시됩니다.
번역 값은 이 작업 후에 일시적으로만 저장됩니다. 이후에 탭 수준에서 저장 또는 저장 및 다음을 사용하면 번역이 저장됩니다.
자체 표준에 따라 특정 값이 필요한 모든 E2B 위치에 대해 이 단계를 반복합니다. Studio 검증(Studio Validations) 작업은 이러한 항목 중 하나라도 누락되거나 대상 E2B 위치에 유효하지 않은 경우 오류를 나타냅니다(배포 방지). 이는 정확한 E2B 값이 알려져 있거나 필요한 경우에 해당되며, 한 가지 예외는 약물 또는 시험 결과 단위입니다. 산업 표준 단위인 경우에도 값을 가져오려면 대상 안전성 시스템에서 대부분 특수 구성이 필요합니다. 따라서 Studio 검증 작업은 단위인 위치에 대해서만 각 실행 시 경고를 보고합니다.
안전성 데이터 유형별
안전성 사례 시작 이벤트
이 안전성 유형에 대한 아이템 구성을 저장하는 방법은 다음과 같습니다.
아이템 선택 시 선택 항목은 일반적으로 이전에 저장된 폼 속성 > 다음에 포함된 모든 입력의 설정에 따라 달라집니다. 일부 E2B 위치에는 반복 아이템 그룹 또는 반복되지 않는 아이템 그룹에서만 수행할 수 있거나 때로는 둘 중 하나에서 수행할 수 있음을 나타내는 특별 규칙이 있습니다. 이러한 특이값은 이 단계의 끝에 있는 표와 이 유형의 모든 E2B 위치에 대한 중요한 참고 사항을 참조하십시오.
- Studio > 폼 구성에서 스터디로 이동합니다.
-
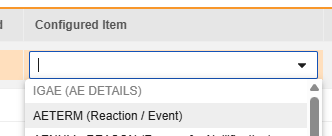
매핑을 의도한 각 행에 대해 구성된 아이템 열의 셀을 사용하여 폼 정의에서 적절한 아이템 정의를 선택합니다. 예를 들어 E2B 위치 E.i.1.1a에 대한 폼에서 AETERM 아이템을 선택합니다.
-
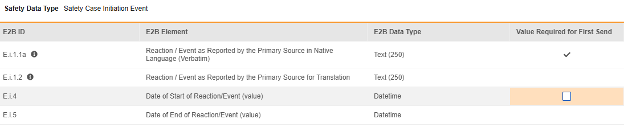
구성된 각 아이템에 대해 첫 번째 전송에 필요한 값(Value Required for First Send) 여부를 나타냅니다. 모든 안전성 시스템에는 비어 있지 않은 용어/값이 있는 하나 이상의 이벤트가 필요하므로, E.i.1.1a는 편집할 수 없습니다(선택된 상태). 다른 행/E2B 위치는 일반적으로 이 속성으로 설정되지 않으며, 기본값은 선택하지 않은 상태입니다.
- 선택한 아이템의 아이템 정의 유형과 행의 E2B ID에 따라 값 번역이 필요할 수 있습니다. 값 번역 설정에 대한 일반 개요는 여기를 참조하십시오.
- 저장을 클릭하여 페이지에 남아 있거나, 저장 및 다음을 클릭하여 다음 탭인 포함 기준으로 이동합니다.
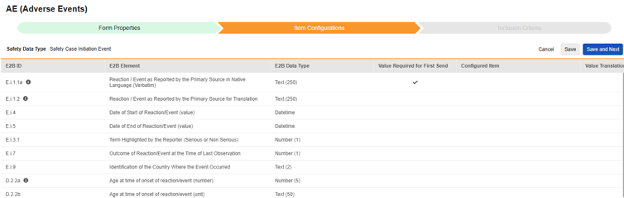
| E2B ID | E2B 레이블 | E2B 유형 | 메모 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| E.i.1.1a | 현지 언어로 된 기본 소스로 보고된 반응/이벤트(임상용어) | 텍스트(250) |
|
||||||||||||||
| (E.i.2.1a) | 반응/이벤트에 대한 MedDRA 버전 |
|
|||||||||||||||
| (E.i.2.1b) | 반응/이벤트(MedDRA 코드) |
|
|||||||||||||||
| E.i.1.2 | 기본 출처에서 번역용으로 보고된 반응/이벤트 | 텍스트(250) |
|
||||||||||||||
| E.i.4 | 반응/이벤트 시작 일자(값) | Datetime |
|
||||||||||||||
| E.i.5 | 반응/이벤트 종료 일자(값) | Datetime |
|
||||||||||||||
| E.i.3.1 | 보고자가 강조한 용어(심각하거나 심각하지 않음) | 숫자(1) |
|
||||||||||||||
| E.i.7 | 마지막 관찰 시 반응/이벤트 결과 | 숫자(1) |
|
||||||||||||||
| E.i.9 | 이벤트가 발생한 국가 식별 | 텍스트(2) |
|
||||||||||||||
| D.2.2a | 반응/이벤트 시작 시 연령(번호) | 숫자(5) |
|
||||||||||||||
| D.2.2b | 반응/이벤트 시작 시 연령(단위) | 텍스트(50) |
|
||||||||||||||
| D.3 | 체중(kg) | 숫자(6) |
|
||||||||||||||
| D.4 | 키(cm) | 숫자(3) |
|
||||||||||||||
| D.6 | 마지막 생리 날짜 | Datetime |
|
||||||||||||||
| E.i.3.2a | 치사(심각도 기준) | 불린(Boolean) |
|
||||||||||||||
| E.i.3.2b | 생명 위협(심각도 기준) | 불린(Boolean) |
|
||||||||||||||
| E.i.3.2c | 입원 유발/연장(심각도 기준) | 불린(Boolean) |
|
||||||||||||||
| E.i.3.2d | 장애화/무능화(심각도 기준) | 불린(Boolean) |
|
||||||||||||||
| E.i.3.2e | 선천성 이상/선천적 장애(심각도 기준) | 불린(Boolean) |
|
||||||||||||||
| E.i.3.2f | 기타 의학적으로 중요한 조건(심각도 기준) | 불린(Boolean) |
|
||||||||||||||
| H.1 | 임상 경과, 치료 조치, 결과 및 추가 관련 정보가 포함된 사례 내러티브 | 텍스트(100000) |
|
||||||||||||||
| H.2 | 보고자 코멘트 | 텍스트(20000) |
|
||||||||||||||
| H.4 | 발신자 코멘트 | 텍스트(20000) |
|
||||||||||||||
| C.1.11.2 | 무효화/개정 이유 | 텍스트(2000) |
|
||||||||||||||
| E.i.6a | 반응/이벤트 기간(값) | 숫자(5) |
|
||||||||||||||
| E.i.6b | 반응/이벤트 기간(단위) | 텍스트(50) |
|
스터디 약물
현재 스터디 약물의 이름(G.k.2.2)은 Studio의 폼 속성 탭에 구성되어 있습니다. 약물 이름에 대한 아이템 구성은 향후 릴리스에서 사용할 수 있습니다. 중요한 G.k.1(약물 분류)은 이 유형의 EDC 폼에 매핑되는 항목이 아닙니다. 대신 이벤트 시작 날짜 또는 그 이전에 하나 이상의 조제 폼이 있을 때 시스템에서 의심(E2B 값 1)을 설정합니다. 조제가 없으면 시스템에서 투여되지 않음(E2B 값 4)을 사용합니다.
이 안전성 유형에 대한 아이템 구성을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
-
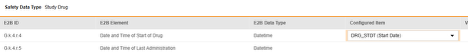
매핑을 의도한 각 행에 대해 구성된 아이템 열의 셀을 사용하여 폼 정의에서 적절한 아이템 정의를 선택합니다. 예를 들어 E2B 위치 G.k.4.r.4에 대한 폼에서 DRG_STDT 아이템을 선택합니다.
- 선택한 아이템의 아이템 정의 유형과 행의 E2B ID에 따라 값 번역이 필요할 수 있습니다. 값 번역 설정에 대한 일반 개요는 여기를 참조하십시오.
- 저장을 클릭하여 페이지에 남아 있거나, 저장 및 다음을 클릭하여 다음 탭인 포함 기준으로 이동합니다.
아이템 선택 시 선택 항목은 일반적으로 이전에 저장된 폼 속성 > 다음에 포함된 모든 입력의 설정에 따라 달라집니다. 일부 E2B 위치에는 반복 아이템 그룹 또는 반복되지 않는 아이템 그룹에서만 수행할 수 있거나 때로는 둘 중 하나에서 수행할 수 있음을 나타내는 특별 규칙이 있습니다. 이러한 특수 사례와 특이값은 이 단계의 끝에 있는 표와 이 유형의 모든 E2B 위치에 대한 중요한 참고 사항을 참조하십시오.
이 유형에는 스터디 약물, 그리고 이 약물이 해당되는 안전성 사례 및 이벤트과 어떻게 관련되는지에 대한 세 가지 중요한 인과 관계 질문(G.k.8/G.k.9.i.2.r.3/G.k.9.i.4)이 있습니다. 이러한 아이템 정의를 매핑하기 위한 선택 항목은 안전성 사례 시작 이벤트에 매핑된 EDC 폼에서 제공됩니다. 그 이유는 이러한 질문에 대한 답변은 사례마다, 이벤트마다 다르며 이벤트 폼에서 답변해야 하기 때문입니다.
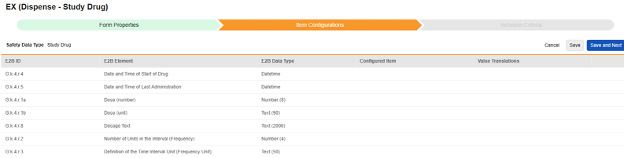
| E2B ID | E2B 레이블 | E2B 유형 | 메모 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| G.k.4.r.4 | 약물 시작 일자 및 시간 | Datetime |
|
||||||||||||||||||||||||
| G.k.4.r.5 | 마지막 투여 날짜 및 시간 | Datetime |
|
||||||||||||||||||||||||
| G.k.4.r.1a | 투여량(번호) | 숫자(8) |
|
||||||||||||||||||||||||
| G.k.4.r.1b | 투여량(단위) | 텍스트(50) |
|
||||||||||||||||||||||||
| G.k.4.r.8 | 투여 텍스트 | 텍스트(2000) |
|
||||||||||||||||||||||||
| G.k.4.r.2 | 간격 내 단위 수(빈도) | 숫자(4) |
|
||||||||||||||||||||||||
| G.k.4.r.3 | 시간 간격 단위의 정의(빈도 단위) | 텍스트(50) |
|
||||||||||||||||||||||||
| G.k.2.4 | 약물을 취득한 국가 식별 | 텍스트(2) |
|
||||||||||||||||||||||||
| G.k.4.r.10.1 | 관리 경로 (자유 텍스트) | 텍스트(60) |
|
||||||||||||||||||||||||
| G.k.4.r.10.2a | 관리 경로 TermID 버전 날짜/번호 | ISO IDMP 기준 | |||||||||||||||||||||||||
| G.k.4.r.10.2b | 관리 경로 TermID | 숫자(3) |
|
||||||||||||||||||||||||
| G.k.8 | 약물을 대상으로 실시한 작업 | 숫자(1) |
|
||||||||||||||||||||||||
| G.k.9.i.2.r.3 | 평가 결과 | 텍스트(60) |
|
||||||||||||||||||||||||
| G.k.9.i.4 | 재투여 시 반응이 반복되었습니까? | 숫자(1) |
|
||||||||||||||||||||||||
| G.K.10.r | 약물에 대한 추가 정보(코드화됨)(필요한 경우 반복) | 숫자(2) |
|
||||||||||||||||||||||||
| G.k.11 | 약물에 대한 추가 정보(무료 텍스트) | 텍스트(2000) |
|
||||||||||||||||||||||||
| G.k.7.r.1 | 기본 출처에서 보고된 적응증 | 텍스트(250) |
|
||||||||||||||||||||||||
| G.k.2.3.r.3a | 강도(번호) | 숫자(10) |
|
||||||||||||||||||||||||
| G.k.2.3.r.3b | 강도(단위) | 텍스트(50) |
|
||||||||||||||||||||||||
| G.k.4.r.6a | 약물 투여 기간(번호) | 숫자(5) |
|
||||||||||||||||||||||||
| G.k.4.r.6b | 약물 투여 기간(단위) | 텍스트(50) |
|
||||||||||||||||||||||||
| G.k.4.r.7 | 배치/로트 번호 | 텍스트(35) | |||||||||||||||||||||||||
| G.k.4.r.9.2a | 의약품 투여 폼 TermID 버전 날짜/번호 | ISO IDMP 기준 | |||||||||||||||||||||||||
| G.k.4.r.9.2b | 의약품 투여 폼 TermID | ISO IDMP 기준 | |||||||||||||||||||||||||
| G.k.5a | 첫 번째 반응에 대한 누적 투여량(번호) | 숫자(10) |
|
||||||||||||||||||||||||
| G.k.5b | 첫 번째 반응에 대한 누적 투여량(단위) | 텍스트(50) |
|
||||||||||||||||||||||||
| G.k.6a | 노출 시점의 임신 기간(번호) | 숫자(3) | |||||||||||||||||||||||||
| G.k.6b | 노출 시점의 임신 기간(단위) | 텍스트(50) |
|
Concomitant Medications
이 안전성 유형에 대한 아이템 구성을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
-
매핑을 의도한 각 행에 대해 구성된 아이템 열의 셀을 사용하여 폼 정의에서 적절한 아이템 정의를 선택합니다. 예를 들어 E2B 위치 G.k.2.2에 대한 폼에서 CMTRT 아이템을 선택합니다.
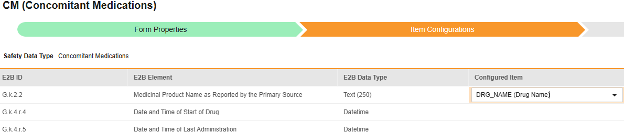
- 선택한 아이템의 아이템 정의 유형과 행의 E2B ID에 따라 값 번역이 필요할 수 있습니다. 값 번역 설정에 대한 일반 개요는 여기를 참조하십시오.
- 저장을 클릭하여 페이지에 남아 있거나, 저장 및 다음을 클릭하여 다음 탭인 포함 기준으로 이동합니다.
아이템 선택 시 선택 항목은 일반적으로 이전에 저장된 폼 속성 > 다음에 포함된 모든 입력의 설정에 따라 달라집니다. 일부 E2B 위치에는 반복 아이템 그룹 또는 반복되지 않는 아이템 그룹에서만 수행할 수 있거나 때로는 둘 중 하나에서 수행할 수 있음을 나타내는 특별 규칙이 있습니다.
또한 병용약물, 그리고 이 약물이 안전성 사례 및 사례에 포함된 이벤트와 어떤 관련이 있는지에 대한 세 가지 중요한 인과 관계 질문(G.k.1/G.k.8/G.k.9.i.2.r.3/G.k.9.i.4)이 있습니다. 매핑을 위한 아이템 정의에 대한 선택 항목은 안전성 사례 시작 이벤트에 매핑된 EDC 폼에서 제공되며, '아이템-폼 링크(Item to Form Link)' 유형의 아이템 정의가 포함된 반복 아이템 그룹에 있는 항목만 제공됩니다. 그 이유는 사이트가 관련 약물에 연결되어 이러한 질문에 대한 답변이 사례마다, 이벤트마다 다를 수 있기 때문입니다. 이러한 특수 사례와 특이값은 이 단계의 끝에 있는 표와 이 유형의 모든 E2B 위치에 대한 중요한 참고 사항을 참조하십시오.
| E2B ID | E2B 레이블 | E2B 유형 | 메모 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| G.k.2.2 | 기본 출처에서 보고된 의약품 이름 | 텍스트(250) |
|
||||||||||||||||||||||||
| G.k.4.r.4 | 약물 시작 일자 및 시간 | Datetime |
|
||||||||||||||||||||||||
| G.k.4.r.5 | 마지막 투여 날짜 및 시간 | Datetime |
|
||||||||||||||||||||||||
| G.k.1 | 약물 특성 역할 | 숫자(1) |
|
||||||||||||||||||||||||
| G.k.8 | 약물을 대상으로 실시한 작업 | 숫자(1) |
|
||||||||||||||||||||||||
| G.k.9.i.2.r.3 | 평가 결과 | 텍스트(60) |
|
||||||||||||||||||||||||
| G.k.9.i.4 | 재투여 시 반응이 반복되었습니까? | 숫자(1) |
|
||||||||||||||||||||||||
| G.k.4.r.1a | 투여량(번호) | 숫자(8) |
|
||||||||||||||||||||||||
| G.k.4.r.1b | 투여량(단위) | 텍스트(50) |
|
||||||||||||||||||||||||
| G.k.4.r.8 | 투여 텍스트 | 텍스트(2000) |
|
||||||||||||||||||||||||
| G.k.4.r.2 | 간격 내 단위 수(빈도) | 숫자(4) |
|
||||||||||||||||||||||||
| G.k.4.r.3 | 시간 간격 단위의 정의(빈도 단위) | 텍스트(50) |
|
||||||||||||||||||||||||
| G.k.2.4 | 약물을 취득한 국가 식별 | 텍스트(2) |
|
||||||||||||||||||||||||
| G.k.4.r.10.1 | 관리 경로 (자유 텍스트) | 텍스트(60) |
|
||||||||||||||||||||||||
| G.k.4.r.10.2a | 관리 경로 TermID 버전 날짜/번호 | ISO IDMP 기준 | |||||||||||||||||||||||||
| G.k.4.r.10.2b | 관리 경로 TermID | 숫자(3) |
|
||||||||||||||||||||||||
| G.K.10.r | 약물에 대한 추가 정보(코드화됨)(필요한 경우 반복) | 숫자(2) |
|
||||||||||||||||||||||||
| G.k.11 | 약물에 대한 추가 정보(무료 텍스트) | 텍스트(2000) |
|
||||||||||||||||||||||||
| G.k.7.r.1 | 기본 출처에서 보고된 적응증 | 텍스트(250) | |||||||||||||||||||||||||
| G.k.2.3.r.3a | 강도(번호) | 숫자(10) |
|
||||||||||||||||||||||||
| G.k.2.3.r.3b | 강도(단위) | 텍스트(50) |
|
||||||||||||||||||||||||
| G.k.4.r.6a | 약물 투여 기간(번호) | 숫자(5) |
|
||||||||||||||||||||||||
| G.k.4.r.6b | 약물 투여 기간(단위) | 텍스트(50) |
|
||||||||||||||||||||||||
| G.k.4.r.7 | 배치/로트 번호 | 텍스트(35) | |||||||||||||||||||||||||
| G.k.4.r.9.1 | 의약품 투여 폼(자유 텍스트) | 텍스트(60) | |||||||||||||||||||||||||
| G.k.5a | 첫 번째 반응에 대한 누적 투여량(번호) | 숫자(10) |
|
||||||||||||||||||||||||
| G.k.5b | 첫 번째 반응에 대한 누적 투여량(단위) | 텍스트(50) |
|
||||||||||||||||||||||||
| G.k.6a | 노출 시점의 임신 기간(번호) | 숫자(3) | |||||||||||||||||||||||||
| G.k.6b | 노출 시점의 임신 기간(단위) | 텍스트(50) |
|
Medical History
이 안전성 유형에 대한 아이템 구성을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
-
매핑을 의도한 각 행에 대해 구성된 아이템 열의 셀을 사용하여 폼 정의에서 적절한 아이템 정의를 선택합니다. 예를 들어 E2B 위치 D.7.r.1.5에 대한 폼에서 MHTERM 아이템을 선택합니다.

- 선택한 아이템의 아이템 정의 유형과 행의 E2B ID에 따라 값 번역이 필요할 수 있습니다. 값 번역 설정에 대한 일반 개요는 이 값 번역을 참조하십시오.
- 저장을 클릭하여 페이지에 남아 있거나, 저장 및 다음을 클릭하여 다음 탭인 포함 기준으로 이동합니다.
아이템 선택 시 선택 항목은 일반적으로 이전에 저장된 폼 속성 > 다음에 포함된 모든 입력의 설정에 따라 달라집니다. 일부 E2B 위치에는 반복 아이템 그룹 또는 반복되지 않는 아이템 그룹에서만 수행할 수 있거나 때로는 둘 중 하나에서 수행할 수 있음을 나타내는 특별 규칙이 있습니다. 이러한 특이값은 이 단계의 끝에 있는 표와 이 유형의 모든 E2B 위치에 대한 중요한 참고 사항을 참조하십시오.
| E2B ID | E2B 레이블 | E2B 유형 | 메모 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| D.7.1.r.1a / D.7.1.r.1b | 병력 MedDRA 코딩 및 버전 | (코딩/버전) |
|
||||||||||||
| D.7.1.r.5 | 코멘트 | 텍스트(2000) |
|
||||||||||||
| D.7.1.r.2 | 시작 일자 | Datetime |
|
||||||||||||
| D.7.1.r.3 | 계속 진행 | 불린(Boolean)(또는 NullFlavor) |
|
||||||||||||
| D.7.1.r.4 | 종료 일자(값) | Datetime |
|
||||||||||||
| D.7.1.r.6 | 가족력 | 불린(Boolean) | |||||||||||||
| D.7.2 | 관련 의료 기록 및 동반 조건에 대한 텍스트(반응/이벤트 불포함)(단일 사례 필드만) | 텍스트(10000) |
|
약물력
이 안전성 유형에 대한 아이템 구성을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
-
매핑을 의도한 각 행에 대해 구성된 아이템 열의 셀을 사용하여 폼 정의에서 적절한 아이템 정의를 선택합니다. 예를 들어 E2B 위치 D.8.r.1에 대한 폼에서 HIST_DRG_NAME 아이템을 선택합니다.
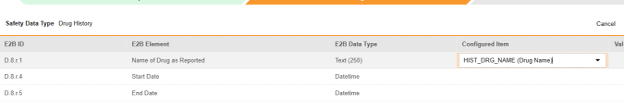
- 선택한 아이템의 아이템 정의 유형과 행의 E2B ID에 따라 값 번역이 필요할 수 있습니다. 값 번역 설정에 대한 일반 개요는 이 값 번역을 참조하십시오.
- 저장을 클릭하여 페이지에 남아 있거나, 저장 및 다음을 클릭하여 다음 탭인 포함 기준으로 이동합니다.
아이템 선택 시 선택 항목은 일반적으로 이전에 저장된 폼 속성 > 다음에 포함된 모든 입력의 설정에 따라 달라집니다. 일부 E2B 위치에는 반복 아이템 그룹 또는 반복되지 않는 아이템 그룹에서만 수행할 수 있거나 때로는 둘 중 하나에서 수행할 수 있음을 나타내는 특별 규칙이 있습니다. 이러한 특이값은 이 단계의 끝에 있는 표와 이 유형의 모든 E2B 위치에 대한 중요한 참고 사항을 참조하십시오.
| E2B ID | E2B 레이블 | E2B 유형 | 메모 |
|---|---|---|---|
| D.8.r.1 | 보고된 약물 이름 | 텍스트(250) |
|
| D.8.r.4 | 시작 일자 | Datetime |
|
| D.8.r.5 | 종료 일자 | Datetime |
|
| D.8.r.6a/D.8.r.6b | MedDRA 코딩 및 버전(적응증) | (코딩/버전) |
|
| D.8.r.7a/D.8.r.7b | MedDRA 코딩 및 버전(반응) | (코딩/버전) |
|
시험 결과
이 안전성 유형에 대한 아이템 구성을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
-
매핑을 의도한 각 행에 대해 구성된 아이템 열의 셀을 사용하여 폼 정의에서 적절한 아이템 정의를 선택합니다. 예를 들어 E2B 위치 F.r.1에 대한 폼에서 LBDT 아이템을 선택합니다.
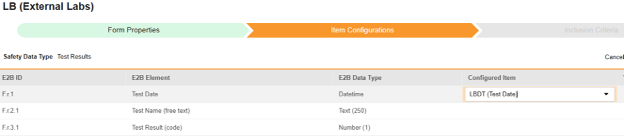
- 선택한 아이템의 아이템 정의 유형과 행의 E2B ID에 따라 값 번역이 필요할 수 있습니다. 값 번역 설정에 대한 일반 개요는 이 값 번역을 참조하십시오.
- 저장을 클릭하여 페이지에 남아 있거나, 저장 및 다음을 클릭하여 다음 탭인 포함 기준으로 이동합니다.
아이템 선택 시 선택 항목은 일반적으로 이전에 저장된 폼 속성 > 다음에 포함된 모든 입력의 설정에 따라 달라집니다. 일부 E2B 위치에는 반복 아이템 그룹 또는 반복되지 않는 아이템 그룹에서만 수행할 수 있거나 때로는 둘 중 하나에서 수행할 수 있음을 나타내는 특별 규칙이 있습니다. 이러한 특이값은 이 단계의 끝에 있는 표와 이 유형의 모든 E2B 위치에 대한 중요한 참고 사항을 참조하십시오.
| E2B ID | E2B 레이블 | E2B 유형 | 메모 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| F.r.1 | 검사 날짜 | Datetime |
|
||||||||||
| F.r.2.1 | 테스트 이름(자유 텍스트) | 텍스트(250) |
|
||||||||||
| (F.r.2.2a) | 테스트 이름에 대한 MedDRA 버전 |
|
|||||||||||
| (F.r.2.2b) | 테스트 이름(MedDRA 코드) |
|
|||||||||||
| F.r.3.1 | 검사 결과(코드) | 숫자(1) |
|
||||||||||
| F.r.3.2 | 검사 결과(값/한정자) | 숫자(50) |
|
||||||||||
| F.r.3.3 | 검사 결과(단위) | 텍스트(50) |
|
||||||||||
| F.r.3.4 | 결과가 구조화되지 않은 데이터(자유 텍스트) | 텍스트(2000) |
|
||||||||||
| F.r.4 | 낮은 정상 값 | 텍스트(50) | |||||||||||
| F.r.5 | 높은 정상 값 | 텍스트(50) | |||||||||||
| F.r.6 | 코멘트(자유 텍스트) | 텍스트(2000) | |||||||||||
| F.r.7 | 사용 가능한 추가 정보 | 불린(Boolean) |
|
환자 특성
이 유형을 사용할 때는 반복되지 않는 아이템 그룹의 아이템만 선택할 수 있습니다.
이 안전성 유형에 대한 아이템 구성을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
-
매핑을 의도한 각 행에 대해 구성된 아이템 열의 셀을 사용하여 폼 정의에서 적절한 아이템 정의를 선택합니다. 예를 들어 E2B 위치 D.2.1에 대한 폼에서 DOB 아이템을 선택합니다.
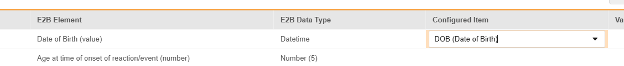
- 선택한 아이템의 아이템 정의 유형과 행의 E2B ID에 따라 값 번역이 필요할 수 있습니다. 값 번역 설정에 대한 일반 개요는 이 값 번역을 참조하십시오.
- 저장을 클릭하여 페이지에 남아 있거나, 저장 및 다음을 클릭하여 다음 탭인 포함 기준으로 이동합니다.
| E2B ID | E2B 레이블 | E2B 유형 | 메모 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| D.2.1 | 생년월일(값) | Datetime |
|
||||||||||||||
| D.2.2a | 반응/이벤트 시작 시 연령(번호) | 숫자(5) |
|
||||||||||||||
| D.2.2b | 반응/이벤트 시작 시 연령(단위) | 텍스트(50) |
|
||||||||||||||
| D.5 | Sex | 숫자(1)(또는 NullFlavor) |
|
사망 시
이 유형에 대한 아이템 선택은 각 E2B ID에 따라 다릅니다. 값이 사례에서 한 번만 사용될 수 있는 경우, 반복되지 않는 아이템 그룹의 아이템만 표시됩니다. 이외에 여러 값이 허용되는 경우에는 반복 위치 또는 반복되지 않는 위치의 선택 항목을 표시합니다.
이 안전성 유형에 대한 아이템 구성을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
-
매핑을 의도한 각 행에 대해 구성된 아이템 열의 셀을 사용하여 폼 정의에서 적절한 아이템 정의를 선택합니다. 예를 들어 E2B 위치 D.9.1에 대한 폼에서 DTHDT 아이템을 선택합니다.
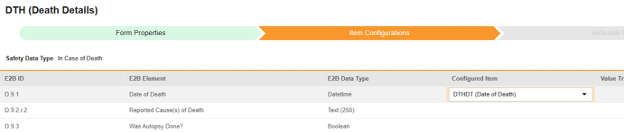
- 선택한 아이템의 아이템 정의 유형과 행의 E2B ID에 따라 값 번역이 필요할 수 있습니다. 값 번역 설정에 대한 일반 개요는 이 값 번역을 참조하십시오.
- 저장을 클릭하여 페이지에 남아 있거나, 저장 및 다음을 클릭하여 다음 탭인 포함 기준으로 이동합니다.
| E2B ID | E2B 레이블 | E2B 유형 | 메모 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| D.9.1 | 사망일 | Datetime |
|
||||||||||||
| D.9.2.r.2 | 보고된 사망 원인 | 텍스트(250) |
|
||||||||||||
| (D.9.2.r.1a) | 보고된 사망 원인에 대한 MedDRA 버전 |
|
|||||||||||||
| (D.9.2.r.1b) | 보고된 사망 원인(MedDRA 코드) |
|
|||||||||||||
| D.9.3 | 부검이 완료되었습니까? | 불린(Boolean)(또는 NullFlavor) |
|
||||||||||||
| D.9.4.r.2 | 부검 - 확인된 사망 원인 | 텍스트(250) |
|
||||||||||||
| (D.9.4.r.1a) | 부검에 의해 확인된 사망 원인에 대한 MedDRA 버전 |
|
|||||||||||||
| (D.9.4.r.1b) | 부검 - 확인된 사망 원인(MedDRA 코드) |
|
시스템별 보고자/발신자 코멘트
시스템별 보고자/발신자 코멘트는 E2B XML을 통한 전송 시 비 E2B 링크 EDC 아이템 값을 보고자 코멘트(H.2) 또는 발신자 코멘트(H.4)에 표시되도록 지원합니다. 매핑된 아이템 값은 코멘트 필드에 표준화된 메모로 나열되며, 값은 실제 보고자 또는 발신자 코멘트 텍스트에 추가됩니다.
표준화된 메모를 구성하려면 폼에서 하나 이상의 아이템을 선택하여 나열하고, 보고자 코멘트(H.2) 또는 발신자 코멘트(H.4)에 추가합니다.
또한 반복 아이템 그룹, 폼 또는 이벤트를 포함하도록 선택할 수 있습니다. 보고자 또는 발신자 코멘트를 통해 전송할 반복 정보가 준비되면, 각 목록 아이템은 전송된 데이터의 고유한 추적을 허용하는 시퀀스 번호를 표시합니다.
다른 안전성 데이터 유형에 매핑된 폼 및 아이템은 보고자 또는 발신자 코멘트에 추가로 매핑할 수 있습니다.
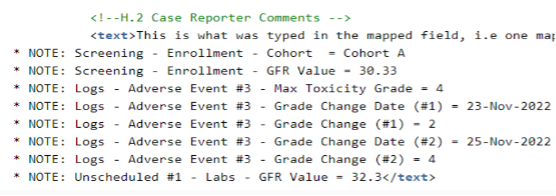
다음 예에서는 전송에 주요 실험실 값, 코호트, 독성 등급, 독성 등급의 변경 사항을 선택했습니다.
추가 글머리 기호 정보는 실제 보고자 코멘트에 추가되며, 이는 H.2에 매핑되었습니다.
참고:
- 코드 목록 레이블이 나열됩니다.
- 날짜/날짜 시간은 사이트에서 입력한 대로 표시됩니다.
- 항목이 입력되지 않은 경우 "값 없음"이 나열됩니다.
추가로 선택한 아이템이 H.2 또는 H.4 필드의 문자 제한을 초과하는 경우, 추가된 정보는 최대 19,975자에서 절단됩니다.
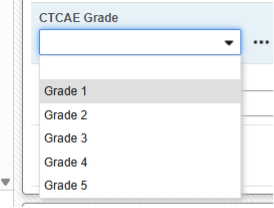
예시 1:
이상 사례 폼은 흔히 E2B 형식에 부합하지 않으며 전송할 수 없는 데이터를 추적합니다. 이 CTCAE 등급(CTCAE 등급) 필드는 이상 사례 폼에 표시됩니다.
간단한 선택을 통해 이 유형을 사용하여 보고자 또는 발신자 코멘트 필드에 포함할 수 있습니다.
각 포함은 E2B 파일의 보고자(또는 발신자) 코멘트에 형식이 지정된 글머리 기호를 생성합니다.
예시 2:
이러한 필드를 포함하는 폼은 다른 유형에서 사용되지 않는 폼일 수도 있습니다. 주요 등록 세부 사항은 안전성 시스템에서 유용할 수 있습니다. 등록(Enrollment) 폼을 선택하여 무작위 배정 번호, 등록 이유, 코호트 등을 보고자 또는 발신자 코멘트 필드에 포함할 수 있습니다.
포함 기준
포함 기준은 안전성 사례 데이터 전송을 시작하는 기본 이벤트 이외에 안전성 사례에 매핑된 아이템 값을 포함할지 결정하는 데 평가됩니다.
메모/개념:
- 포함 기준은 다음 조건이 모두 충족되는 경우에만 평가됩니다.
- 폼 속성 탭에서 모든 포함 기준, 특히 키 안전성 아이템이 true로 평가됩니다.
- 아이템 구성 탭에서 필수 아이템의 EDC 폼에 비어 있지 않은 값이 있습니다.
- 추가 기준에는 유형의 모든 폼이 포함될 수 있으며, 사이트 사용자 작업(연결) 및/또는 날짜 비교를 기반으로 할 수 있습니다. 이러한 구성은 유형, 특정 폼 및/또는 스터디에 따라 다를 수 있습니다.
- 포함 기준 탭의 조건은 평가 시 'OR'로 간주됩니다. 즉, 일련의 적용 가능한 기준 중 하나라도 true이면 다른 기준이 false로 평가된 것과 관계없이 평가는 'In'입니다.
- 사례에 포함하기 위한 안전성 사례 시작 이벤트 종료 날짜와의 비교가 구성되었지만 데이터 입력 화면에서 날짜가 설정되지 않은 경우, 이벤트 종료 날짜는 열린 상태로 평가에 사용됩니다. 기본 이벤트(또는 관련 폼)에 종료 날짜가 입력되면 시스템은 포함 기준을 재평가하고, 적절한 경우 수정 팔로우업을 전송합니다.
- 포함 기준은 모든 관련 안전성 유형에 적용됩니다.
- 안전성 사례 시작 이벤트
- 스터디 약물
- Concomitant Medications
- Medical History
- 약물력
- 시험 결과
- 시스템별 보고자/발신자 코멘트
안전성 유형별 옵션 요약
| 포함 기준 | 안전성 데이터 유형 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| SCIE | 스터디 약물 | Con Meds | Med Hist | Drug Hist | Test Res | Pat Chars | 사망 | Rep/Sen Comm | |
| 모두 | |||||||||
| 사이트 사용자가 연결 | |||||||||
| 시작에서 종료가 안전성 이벤트 시작에서 종료와 겹침 | |||||||||
| 안전성 이벤트 시작 X일 전에 시작과 종료가 겹침 | |||||||||
| 안전성 이벤트 시작 X일 전에 시작과 종료가 겹침 | |||||||||
| 안전성 이벤트 종료 X일 전에 시작과 종료가 겹침 | |||||||||
| 안전성 이벤트 종료 X일 후에 시작과 종료가 겹침 | |||||||||
| 첫 번째 조제 | |||||||||
| 안전성 이벤트 시작 시/시작 전 가장 가까운 시간 | |||||||||
| 안전성 이벤트 시작 시/시작 후 가장 가까운 시간 | |||||||||
| 안전성 이벤트 시/전 가장 가까운 시간(하나만 해당) | |||||||||
| 안전성 이벤트 시작 전 약물 조제 시작 | |||||||||
| 안전성 이벤트 시작 전에 종료됨 | |||||||||
| 자동으로, 안전성 사례 시작 이벤트 폼의 일부이기 때문에 | |||||||||
| 필터링됨 - 이미 사례에 존재하거나 사이트 사용자가 링크함 | |||||||||
| 항상 | * | * | |||||||
|
이 포함 기준을 안전성 데이터 유형에 사용할 수 있음을 나타냅니다. * 이 포함 기준을 안전성 데이터 유형에 대해 수정할 수 없음을 나타냅니다. |
|||||||||
표 헤더는 안전성 데이터 유형을 축약한 형태입니다.
- SCIE: 안전성 사례 시작 이벤트
- ConMeds: 병용약물
- Med Hist: 병력
- Drug Hist: 약물력
- Test Res: 시험 결과
- Pat Chars: 환자 특성
- 사망: 사망 시
- Rep/Sen Comm: 시스템별 보고자/발신자 코멘트
옵션 의미/예
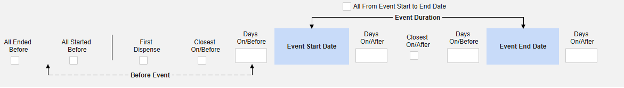
아래에 모든 기준 옵션이 요약되어 있습니다. 각 날짜 기반 옵션에는 사용법을 설명하기 위해 일련의 예시가 포함되어 있습니다.
안전성 데이터 유형별
안전성 사례 시작 이벤트
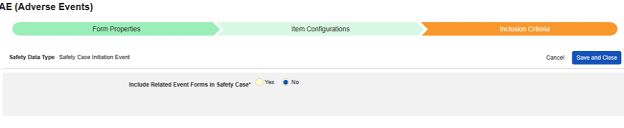
안전성 사례 시작 이벤트는 안전성 사례 전송 프로세스를 시작하는 기본 이벤트입니다. 이후 다른 모든 관련 이벤트는 구성된 기준에 따라 사례로 가져옵니다. 선호도 및 스터디 디자인에 따라 시작 이벤트는 시작 폼의 다른 데이터를 포함하거나 동일한 유형의 다른 이벤트/폼과 관련될 수 있지만, 그 자체로는 자체 안전성 사례를 구성하지 않습니다(예: 시작 심각한 이벤트에 연결된 기타 심각하지 않은 사건).
일반적인 실제 예:
- 월요일에 대상자는 심각하지 않은 이상 사례 "두통"(AE 폼 #1)을 경험합니다.
- 수요일에 대상자는 심각한 이상 사례 "어지러움"(AE 폼 #2)을 경험합니다.
- 시스템은 수요일 이벤트("어지러움")에 대한 안전성 사례를 새 안전성 사례의 기본 시작 이벤트로 전송합니다. 또한 시스템은 구성된 포함 기준에 따라 월요일 이벤트의 데이터를 동일한 안전성 사례의 두 번째 이벤트로 추가합니다. 이는 당일/이전 = 2(또는 그 이상)를 사용하기 때문에 발생합니다.
각 포함 기준 옵션에 대한 자세한 내용과 예시는 위의 옵션 의미/예시를 참조하십시오.
이 안전성 유형에 대한 포함 기준을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
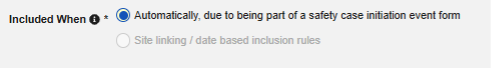
- 안전성 사례에 관련 이벤트 폼 포함:
- 사이트 사용자가 링크한 관련 이벤트 폼 포함: 사이트에서 기본 시작 이벤트에 연결한 이벤트를 사례에 포함하려면 예를 선택합니다. 경고: 예로 설정하는 경우, 폼에 폼-폼 또는 아이템-폼 연결 또한 구성되어야 합니다.
-
날짜 매칭을 통한 관련 이벤트 폼 포함: 하나 이상의 날짜 기반 기준에 따라 포함을 위해 관련 이벤트의 데이터를 평가하려면 예를 선택합니다. 각 포함 기준 옵션에 대한 자세한 내용과 예시는 위의 옵션 의미/예시를 참조하십시오.
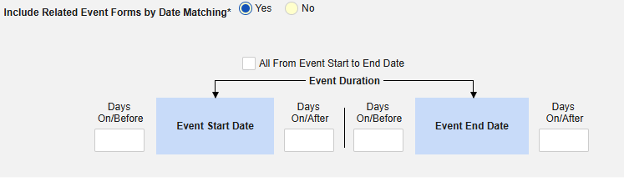
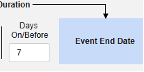
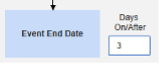
- 옵션을 선택하거나 특정 일수(Days) 값을 설정합니다. 다음 옵션 중 하나 이상을 선택/설정해야 합니다.
- 저장하고 닫기를 클릭하여 완료합니다.
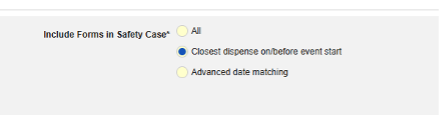
스터디 약물
이러한 유형의 안전성 구성은 시작 이벤트(즉, 임상 스터디가 대상자에 대해 테스트할 때의 기준)와 관련하여 스터디 약물의 투약/조제 정보를 추적하는 데 사용됩니다. 정보는 안전성 사례의 제품/약물 섹션(E2B의 G.* 섹션)으로 전달됩니다.
실제 예:
- 3월 1일에 대상자는 스터디 약물 활성 대 위약(Active vs Placebo)(눈가림한 스터디 약물)의 첫 번째 조제를 받습니다.
- 3월 3일에 대상자는 또 다른 조제를 받습니다.
- 3월 5일에 대상자는 또 다른 조제를 받습니다.
- 3월 6일에 대상자는 심각한 이상 사례("어지러움")를 경험하고, 사이트에서 AE 폼에 입력합니다.
- 시스템은 "어지러움"을 기본 이벤트로 사용하여 안전성 사례를 생성하고 전송합니다.
- 스터디는 안전성 사례에 조제의 하위 세트를 포함하도록 구성됩니다. 한 가지 구성 예로 3월 1일(전체 첫 번째) 및 3월 5일(가장 가까운 날짜/이전)이 있습니다. 구성된 기준에 따라 다른 조제는 포함되지 않습니다.
각 포함 기준 옵션에 대한 자세한 내용과 예시는 위의 옵션 의미/예시를 참조하십시오.
이 안전성 유형에 대한 포함 기준을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
- 안전성 사례의 폼 포함(각 포함 기준 옵션에 대한 자세한 내용과 예시는 위의 옵션 의미/예시 참조):
- 저장하고 닫기를 클릭하여 완료합니다.
Concomitant Medications
이 유형의 안전성 구성은 스터디의 병용약물 폼에 적용됩니다. 정보는 안전성 사례의 제품/약물 섹션(E2B의 G.* 섹션)으로 (E2B의 G.* 섹션) 이 유형과 함께 여러 폼을 사용할 수 있습니다.
실제 예:
- 3월 1일에 대상자는 하루에 한 번 복용하는 Veeofen을 시작하지만 3월 3일에 중단합니다.
- 3월 3일에 대상자는 하루에 한 번 복용하는 Natevba를 시작하며, 종료 날짜는 없습니다(여전히 복용 중임).
- 3월 5일에 대상자는 Deetoza를 1회 복용합니다(종료 날짜도 3월 5일).
- 3월 7일에 대상자는 심각한 이상 사례("어지러움")를 경험하고, 사이트에서 AE 폼에 입력합니다.
- 시스템은 "어지러움"을 기본 이벤트로 사용하여 안전성 사례를 생성하고 전송합니다.
-
스터디 디자인은 다음 두 가지 규칙을 사용하여 병용약물을 가져오도록 규정합니다.
- "SAE 시작 시 진행 중인 모든 항목"
- "중지되었지만 SAE 시작 후 3일 이내에 중지된 항목"
- 결과: 3월 3일 Natevba(진행 중)와 3월 5일 Deetoza(2일 전 종료됨)가 모두 사례에 포함됩니다. 다른 하나인 3월 1일 Aspirin은 사례에 포함되지 않습니다(종료된 지 3일이 넘었기 때문).
각 포함 기준 옵션에 대한 자세한 내용과 예시는 위의 옵션 의미/예시를 참조하십시오.
이 안전성 유형에 대한 포함 기준을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
- 다음 옵션 중에서 선택합니다.
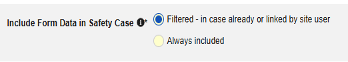
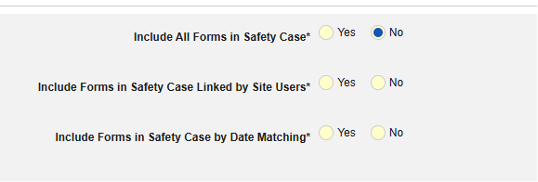
- 안전성 사례에 모든 폼 포함(기본값: 아니요): 예를 선택하면 현재 병용약물을 모두 사례에 포함하고 다른 모든 옵션을 비활성화합니다.
- 사이트 사용자가 링크한 관련 이벤트 폼 포함. 예를 선택하면 사이트에서 기본 시작 이벤트에 연결된 병용약물이 사례에 포함됩니다. 경고: 예로 설정하는 경우, 폼에 폼-폼 또는 아이템-폼 연결 또한 구성되어야 합니다.
- 사이트 사용자가 링크한 안전성 사례에 폼 포함하기: 경고에 대해 예 또는 아니요 선택: 예로 설정하는 경우, 폼에 폼-폼 또는 아이템-폼 연결 또한 구성되어야 합니다.
-
날짜 일치를 통해 안전성 사례에 폼 포함하기에 대해 예 또는 아니요를 선택합니다. 예로 설정하면 시스템은 하나 이상의 기준을 사용하여 안전성 사례 이벤트(기본)와 관련 데이터(현재 구성 중인 폼, 시작 및 종료 범위)의 시작-종료 범위를 비교합니다.
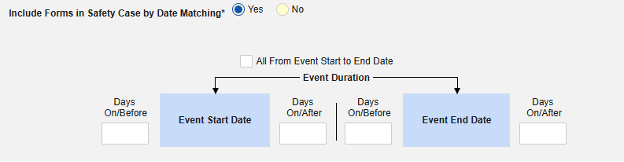
- 옵션을 선택하거나 특정 일수(Days) 값을 설정합니다. 다음 옵션 중 하나 이상을 선택/설정해야 합니다.
- 저장하고 닫기를 클릭하여 완료합니다.
각 포함 기준 옵션에 대한 자세한 내용과 예시는 위의 옵션 의미/예시를 참조하십시오.
Medical History
이 유형의 안전성 구성은 스터디의 병력 폼에 적용됩니다. 정보는 안전성 사례의 E2B D.7 섹션으로 전달됩니다. 이 유형과 함께 여러 폼을 사용할 수 있습니다.
실제 예:
- 2024년 1월에 대상자는 처음으로 "경미한 어지러움"을 경험하기 시작했습니다. 병력은 진행 중인 것으로 간주됩니다(종료 날짜 없음).
- 두 번째 병력은 2024년 4월부터 2024년 5월까지 "등허리 통증"을 나타냅니다.
- 세 번째 병력은 2024년 6월과 2024년 11월 말의 "편두통"을 나타냅니다.
- 2025년 3월 7일에 대상자는 심각한 이상 사례("어지러움")를 경험하고, 사이트에서 AE 폼에 입력합니다.
- 시스템은 "어지러움"을 기본 이벤트로 사용하여 안전성 사례를 생성하고 전송합니다.
-
스터디 디자인은 다음 두 가지 규칙을 사용하여 병력을 가져오도록 규정합니다.
- "SAE 시작 시 진행 중인 모든 항목"
- "중지되었지만 SAE 시작 후 182일 이내에 중지된 항목"
- 결과: "경미한 어지러움"(진행 중)과 "편두통"(종료되었지만 1년 이내)이 모두 사례에 포함됩니다. 다른 하나인 "등허리 통증"은 사례에 포함되지 않습니다(종료된 지 180일이 넘었기 때문).
각 포함 기준 옵션에 대한 자세한 내용과 예시는 위의 옵션 의미/예시를 참조하십시오.
이 안전성 유형에 대한 포함 기준을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
- 다음 옵션 중에서 선택합니다.
- 안전성 사례에 모든 폼 포함(기본값: 아니요): 예를 선택하면 현재 병용약물을 모두 사례에 포함하고 다른 모든 옵션을 비활성화합니다.
- 사이트 사용자가 링크한 관련 이벤트 폼 포함. 예를 선택하면 사이트에서 기본 시작 이벤트에 연결된 병용약물이 사례에 포함됩니다. 경고: 예로 설정하는 경우, 폼에 폼-폼 또는 아이템-폼 연결 또한 구성되어야 합니다.
- 사이트 사용자가 링크한 안전성 사례에 폼 포함하기: 경고에 대해 예 또는 아니요 선택: 예로 설정하는 경우, 폼에 폼-폼 또는 아이템-폼 연결 또한 구성되어야 합니다.
-
날짜 일치를 통해 안전성 사례에 폼 포함하기에 대해 예 또는 아니요를 선택합니다. 예로 설정하면 시스템은 하나 이상의 기준을 사용하여 안전성 사례 이벤트(기본)와 관련 데이터(현재 구성 중인 폼, 시작 및 종료 범위)의 시작-종료 범위를 비교합니다.
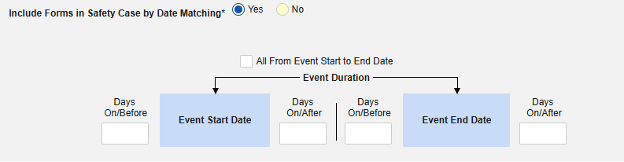
- 옵션을 선택하거나 특정 일수(Days) 값을 설정합니다. 다음 옵션 중 하나 이상을 선택/설정해야 합니다.
- 저장하고 닫기를 클릭하여 완료합니다.
각 포함 기준 옵션에 대한 자세한 내용과 예시는 위의 옵션 의미/예시를 참조하십시오.
약물력
이 유형의 안전성 구성은 스터디의 약물력 폼에 적용됩니다. 정보는 안전성 사례의 E2B D.8 섹션으로 전달됩니다.
실제 예:
- 스터디 디자인은 스크리닝 방문 시 연구자가 적절하다고 간주하는 약물력 정보 및/또는 임상시험계획서에 따른 약물력 정보를 수집합니다. 이 정보는 특히 대상자가 임상 시험에 참여하기 전에 복용(및 종료)된 약물/제품입니다.
- 2025년 3월 7일에 대상자는 심각한 이상 사례("어지러움")를 경험하고, 사이트에서 AE 폼에 입력합니다.
- 시스템은 "어지러움"을 기본 이벤트로 사용하여 안전성 사례를 생성하고 전송합니다.
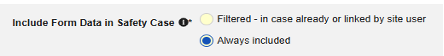
- 이러한 유형의 안전성 데이터에 대한 스터디 구성에 따라, 대상자가 경험하는 모든 안전성 사례에 모두 포함되어야 합니다.
- 혹은 날짜 기반 및/또는 사이트 연결 옵션을 사용할 수 있습니다.
각 포함 기준 옵션에 대한 자세한 내용과 예시는 위의 옵션 의미/예시를 참조하십시오.
이 안전성 유형에 대한 포함 기준을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
- 다음 옵션 중에서 선택합니다.
- 안전성 사례에 모든 폼 포함(기본값: 아니요): 예를 선택하면 현재 병용약물을 모두 사례에 포함하고 다른 모든 옵션을 비활성화합니다.
- 사이트 사용자가 링크한 관련 이벤트 폼 포함. 예를 선택하면 사이트에서 기본 시작 이벤트에 연결된 병용약물이 사례에 포함됩니다. 경고: 예로 설정하는 경우, 폼에 폼-폼 또는 아이템-폼 연결 또한 구성되어야 합니다.
- 사이트 사용자가 링크한 안전성 사례에 폼 포함하기: 경고에 대해 예 또는 아니요 선택: 예로 설정하는 경우, 폼에 폼-폼 또는 아이템-폼 연결 또한 구성되어야 합니다.
-
날짜 일치를 통해 안전성 사례에 폼 포함하기에 대해 예 또는 아니요를 선택합니다. 예로 설정하면 시스템은 하나 이상의 기준을 사용하여 안전성 사례 이벤트(기본)와 관련 데이터(현재 구성 중인 폼, 시작 및 종료 범위)의 시작-종료 범위를 비교합니다.
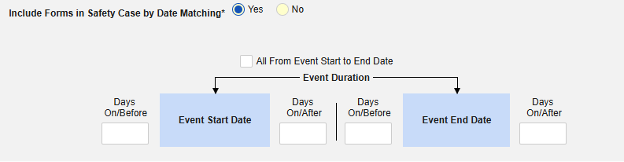
- 옵션을 선택하거나 특정 일수(Days) 값을 설정합니다. 다음 옵션 중 하나 이상을 선택/설정해야 합니다.
- 저장하고 닫기를 클릭하여 완료합니다.
각 포함 기준 옵션에 대한 자세한 내용과 예시는 위의 옵션 의미/예시를 참조하십시오.
시험 결과
이 유형의 안전성 구성은 스터디의 실험실/시험 결과 폼에 적용됩니다. 정보는 안전성 사례의 E2B F.* 섹션으로 전달됩니다. 이 유형과 함께 여러 폼을 사용할 수 있습니다.
실제 예:
- 스터디 디자인은 연구자/사이트에 필요한 경우 로그 폼에 추가 실험실/시험 결과를 수집합니다. 이는 심각한 이상 사례와 관련이 있다고 판단되는 테스트입니다.
- 2025년 3월 7일에 대상자는 심각한 이상 사례("어지러움")를 경험하고, 사이트에서 AE 폼에 입력합니다.
- 또한 사이트는 범위를 벗어난 두 개의 실험실 테스트를 추가하고 각각에 대해 AE 폼에 대한 링크를 수행합니다.
- 시스템은 "어지러움"을 기본 이벤트로 사용하여 안전성 사례를 생성하고 전송합니다.
- 스터디에는 사이트가 이벤트에 연결된 모든 것을 포함하도록 나타내는 안전성 설정이 있으므로, 두 시험 결과가 사례에 포함됩니다.
- 추가로(또는 대신) 날짜 기반 옵션을 사용할 수 있습니다.
각 포함 기준 옵션에 대한 자세한 내용과 예시는 위의 옵션 의미/예시를 참조하십시오.
이 안전성 유형에 대한 포함 기준을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
- 다음 옵션 중에서 선택합니다.
- 안전성 사례에 모든 폼 포함(기본값: 아니요): 예를 선택하면 현재 병용약물을 모두 사례에 포함하고 다른 모든 옵션을 비활성화합니다.
- 사이트 사용자가 링크한 관련 이벤트 폼 포함. 예를 선택하면 사이트에서 기본 시작 이벤트에 연결된 병용약물이 사례에 포함됩니다. 경고: 예로 설정하는 경우, 폼에 폼-폼 또는 아이템-폼 연결 또한 구성되어야 합니다.
- 사이트 사용자가 링크한 안전성 사례에 폼 포함하기: 경고에 대해 예 또는 아니요 선택: 예로 설정하는 경우, 폼에 폼-폼 또는 아이템-폼 연결 또한 구성되어야 합니다.
-
날짜 일치를 통해 안전성 사례에 폼 포함하기에 대해 예 또는 아니요를 선택합니다. 예로 설정하면 시스템은 하나 이상의 기준을 사용하여 안전성 사례 이벤트(기본)와 관련 데이터(현재 구성 중인 폼, 시작 및 종료 범위)의 시작-종료 범위를 비교합니다.
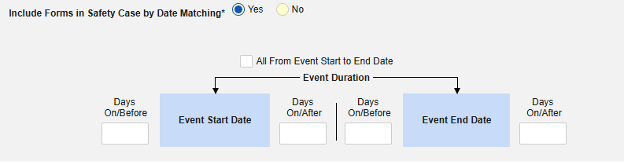
- 옵션을 선택하거나 특정 일수(Days) 값을 설정합니다. 다음 옵션 중 하나 이상을 선택/설정해야 합니다.
- 저장하고 닫기를 클릭하여 완료합니다.
각 포함 기준 옵션에 대한 자세한 내용과 예시는 위의 옵션 의미/예시를 참조하십시오.
환자 특성
이 유형의 안전성 구성은 환자에 대한 일반 정보에 적용됩니다. 이 유형에 대한 기준은 없습니다. 대신 이 유형으로 분류된 정보는 대상자의 모든 안전성 사례에 포함됩니다.
아이템 구성 탭에서 포함 기준 탭에 도달한 후 저장 및 다음을 클릭하면 폼 구성 목록으로 돌아갑니다.
사망 시
이 유형의 안전성 구성은 대상자에 대한 사망 세부 사항과 관련된 폼에 적용됩니다. 이 유형에 대한 기준은 없습니다. 대신 이 유형으로 분류된 정보는 대상자의 모든 안전성 사례에 포함됩니다.
아이템 구성 탭에서 포함 기준 탭에 도달한 후 저장 및 다음을 클릭하면 폼 구성 목록으로 돌아갑니다.
현재 모든 사례는 이 정보를 받게 되며, 이벤트에 치명적인 결과가 없는 경우도 포함됩니다.
시스템별 보고자/발신자 코멘트
이러한 유형의 안전성 구성은 사례집에서 모든 위치의 폼에 적용됩니다. E2B 구조의 어느 곳에도 맞지 않는 데이터의 경우 이 형식이 사용됩니다.
이 안전성 유형에 대한 포함 기준을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
- 아래 표에 나열된 두 가지 옵션 중 적절한 것을 선택합니다.
- 저장 후 닫기를 클릭합니다.
| 옵션 | 의미/메모 |
|---|---|
| 필터링됨 - 이미 사례에 존재하거나 사이트 사용자가 링크함 | 이 옵션에 가능한 의미는 두 가지입니다.
|
| 항상 포함됨 | 폼의 값이 해당 폼 디자인을 사용하는 데이터 입력의 모든 폼에 대한 보고자(또는 발신자) 코멘트에 시스템 생성 글머리 기호로 포함됩니다. 이 옵션은 대상자별로 한 번 수집되는 데이터에 가장 흔히 사용됩니다. 예는 다음과 같습니다.
|
모든 안전성 구성 삭제
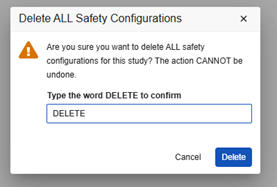
스터디 디자인의 모든 안전성 구성을 제거할 때는 각별히 주의하십시오. 이 작업을 수행하면 스터디가 구성이 없는 상태로 돌아가므로 다시 시작해야 합니다.
이 작업을 수행하려면 개발 스터디에 안전성 사례가 없어야 합니다. 개발 환경에서 안전성 사례를 이미 생성한 경우, 비프로덕션 테스트 데이터를 삭제하면 됩니다.
Post Go Live 삭제: 다운스트림 환경(테스트, 트레이닝, 프로덕션)에 안전성 구성 및 안전성 사례가 있는 경우 이 작업을 수행해서는 안 됩니다. 개발 스터디에서 안전성 사례를 삭제한 다음 안전성 구성을 삭제할 수 있지만, 나중에 테스트/트레이닝/프로덕션에 배포할 때 실패가 발생할 수 있습니다.
스터디의 모든 안전성 구성을 제거하는 방법은 다음과 같습니다.
사양 다운로드
스터디 디자인 사양 또는 모든 CRF PDF 내보내기를 통해 안전성 구성을 다운로드할 수 있습니다. 안전성 연동을 구성하면 안전성 설정 및 안전성 폼 구성이라는 두 개의 추가 탭이 생성됩니다.
안전성 구성 배포
스터디의 DEV 환경에서 구성이 완료되면 테스트를 위해 TST에 배포한 다음 교육 및 프로덕션 환경으로 넘어갈 수 있습니다.
안전성 연동 구성은 스터디 배포 패키지에 자동으로 포함됩니다. 스터디를 배포할 때 Vault는 패키지에 현재 구성을 포함합니다.
이 구성은 스터디 배포의 일부로 관리되므로 DEV 유형 환경에서만 변경할 수 있습니다. 구성을 변경하려면 DEV 환경에서 변경한 다음 해당 변경 사항을 다른 환경에 배포합니다. 이 구성은 사례집 버전 게시의 일부로 검증됩니다. 검증이 진행되는 동안에는 편집이 비활성화됩니다. 여기에서 가능한 오류 및 경고 목록을 확인할 수 있습니다.
스터디를 배포하는 방법에 대해 알아보십시오.
E2B 요소 참조(시스템 생성)
다음 표에는 구성된 아이템 구성과 함께 안전성 사례에서 안전성 시스템으로 추가로 전송되는 시스템 생성 E2B 요소가 요약되어 있습니다.
| E2B ID | E2B 요소 | Data Type | 원본(Source) | 설명 |
|---|---|---|---|---|
| N.1.1 | 배치 메시지 유형 | 숫자(2) | 정적 | ICH ICSR의 경우 항상 "1"로 설정됩니다. |
| N.1.2 | 배치 번호 | 숫자(100) | 시스템 생성됨 | 이 값은 대상자의 사이트(ISO 2글자 코드), EDC 시스템의 고유 식별자(해당 Vault의 모든 스터디에 고유함), Vault ID, 오브젝트 레코드 ID, 대시("-") 및 사례의 N번째 숫자 값(예: "US-VAULTCDMS-110377V6800000000L003-1")이 연속된 값입니다. EDC 시스템 식별자에는 비프로덕션 환경에 있을 때 "TEST"가 추가됩니다. 메시지 번호의 경우, "0"은 첫 번째 전송이고 "1"은 첫 번째 팔로우업입니다. |
| N.1.3 | 배치 전송자 식별자 | 텍스트(60) | 시스템 생성됨 | 스터디의 전송 프로필에 지정된 배치 전송자 식별자입니다. 이는 안전성 시스템에 구성된 전송자 프로필과 일치합니다. |
| N.1.4 | 배치 수신자 식별자 | 텍스트(60) | 시스템 생성됨 | 스터디의 전송 프로필에 지정된 배치 수신자 식별자입니다. 이는 안전성 시스템에 구성된 수신자 프로필과 일치합니다. |
| N.1.5 | 배치 전송 날짜 | Datetime | 시스템 생성됨 | Vault에서 안전성 메시지 및 해당 XML 파일을 생성한 전체 날짜 및 시간(UTC)입니다. |
| N.2.r.1 | 메시지 식별자 | 텍스트(100) | 시스템 생성됨 | "N.1.2"와 동일합니다. |
| N.2.r.2 | 메시지 전송자 식별자 | 텍스트(60) | 시스템 생성됨 | "N.1.3"과 동일합니다. |
| N.2.r.3 | 메시지 수신자 식별자 | 텍스트(60) | 시스템 생성됨 | "N.1.4"와 동일합니다. |
| N.2.r.4 | 메시지 생성 날짜 | Datetime | 시스템 생성됨 | "N.1.5"와 동일합니다. |
| C.1.1 | 전송자(사례) 안전성 레포트 고유 식별자 | 텍스트(100) | 시스템 생성됨 | 이 값은 대상자의 사이트(ISO 2글자 코드), EDC 시스템의 고유 식별자(해당 Vault의 모든 스터디에 고유함), Vault ID 및 오브젝트 레코드 ID(예: "US-VAULTCDMS-110377V6800000000L003")가 연속된 값입니다. EDC 시스템 식별자에는 비프로덕션 환경에 있을 때 "TEST"가 추가됩니다. |
| C.1.2 | 생성 날짜 | Datetime | 시스템 생성됨 | Vault에서는 전송하기 직전에 안전성 메시지를 만듭니다. 이 필드는 생성 날짜를 초 단위로 캡처합니다. 메시지 식별자 역할을 합니다. |
| C.1.3 | 레포트 유형 | 숫자(1) | 정적 | "스터디 레포트"의 경우 "2"로 설정되어 있습니다. |
| C.1.4 | 원본에서 레포트를 처음 받은 날짜 | Datetime | 시스템 생성됨 | 이 필드는 SAE에 대해 모든 필수 필드(아이템)가 캡처된 날짜 및 시간을 캡처합니다. |
| C.1.5 | 이 레포트에 대한 가장 최근 정보의 날짜 | Datetime | 시스템 생성됨 | 마지막 안전성 메시지가 전송된 후 안전성 사례의 데이터와 관련하여 데이터 입력 사용자가 지정된 날짜에 수행한 첫 번째 변경 사항을 나타냅니다. 예를 들어, 같은 날짜에 사용자가 병력 폼의 데이터를 오전 8시에 처음 변경한 다음, 오전 10시에 SAE 폼의 데이터를 변경하고, 마지막으로 오전 11시에 두 개의 병용약물 치료 폼을 연결하고, 동일한 안전성 사례의 데이터에 대한 모든 변경 사항을 포함하는 경우 C.1.5 값은 예약된 다음 전송에서 해당 날짜의 오전 8시가 됩니다. |
| C.1.6.1 | 추가 문서를 사용할 수 있습니까? | 불린(Boolean) | 정적 | 이 값은 항상 false입니다. |
| C.1.7 | 이 사례가 신속 레포트에 대한 지역 기준을 충족합니까? | 불린(Boolean) | 정적 | 이 값은 항상 'NI'("정보 없음")입니다. |
| C.1.8.1 | 전 세계 고유 사례 식별 번호 | 텍스트(100) | 시스템 생성됨 | "C.1.1"과 동일합니다. |
| C.1.8.2 | 이 사례의 첫 번째 전송자 | 숫자(1) | 정적 | "기타"의 경우 항상 "2"로 설정됩니다. |
| C.1.11.1 | 레포트 무효화 / 개정 | 숫자(1) | 시스템 생성됨 | 메시지 유형이 "개정"인 경우, Vault는 이 필드를 "2"로 설정합니다. 메시지 유형이 "무효화"인 경우, Vault는 이 필드를 "1"로 설정합니다. |
| C.2.r.1.2 | 보고자 이름 | 텍스트(60) | 발송 사이트 | 보고자(안전성 설정)에 대한 스터디의 옵션에 따라 사이트의 책임 연구자가 제공합니다. |
| C.2.r.1.4 | 보고자 성 | 텍스트(60) | 발송 사이트 | 보고자(안전성 설정)에 대한 스터디의 옵션에 따라 사이트의 책임 연구자가 제공합니다. |
| C.2.r.3 | 보고자 국가 코드 | 텍스트(2) | 발송 사이트 | |
| C.2.r.5 | 규제 목적의 기본 출처 | 숫자(1) | 정적 | 이 값은 항상 '1'입니다. |
| C.3.2 | 전송자 조직 | 텍스트(100) | 발송 사이트 | 스터디 조직(EDC의 경우 전송자)의 이름입니다. |
| C.5.3 | 의뢰자 스터디 번호 | 텍스트(50) | 조회됨 | 스터디 안전성 설정 섹션에서 특정 값으로 설정되지 않은 경우 스터디의 이름/레이블입니다. |
| E.i.9 | 반응/이벤트가 발생한 국가 식별 | 텍스트(2) | 사이트 또는 사용자가 제공 | 사이트의 스터디 국가에 대한 2자리 국가 코드. 또는 사이트에서 오버라이드하도록 데이터 입력 폼에 매핑할 수 있습니다(예: 대상자가 해외에 있을 때 이벤트가 발생함). |
| D.7.1.r.1a | 병력을 위한 MedDRA 버전 | 텍스트(4) | 조회됨 | 문자열에서 "MedDRA"가 제거됩니다. 이 필드는 E2B에 병력 용어가 없고 코딩된 값만 있기 때문에 코딩됨 또는 자동 코딩됨 상태인 후에만 전송됩니다. |
| D.7.1.r.1b | 병력(질병/외과/시술/기타)(MedDRA 코드) | 숫자(8) | 조회됨 |