25R2 新增功能
预发布日期:2025 年 7 月 7 日 | 发布日期:2025 年 7 月 25 日和 8 月 1 日我们很高兴为你带来 Veeva Clinical Data 25R2。请阅读下文了解新功能。有关新功能启用的信息,请参阅 25R2 功能启用详细信息。有关开发人员功能(REST API)的信息,请参阅开发者门户。
临床数据
本部分中的功能是对 Veeva EDC 和 CDB 所有应用领域都适用的更改。
在 PDF 中包含已删除的数据
用例
为进一步明确 PDF 中直接显示的审计跟踪数据修订记录,附录现包含数据删除的情况。
说明
生成收尾 PDF 或运行“详细 PDF”作业时,如果首席数据管理员选择包含审计跟踪,研究中心删除或通过追溯性修订移除的数据将包含在 PDF 新增的“已删除数据审计跟踪”附录部分中。PDF 书签与病例手册计划的顺序一致,便于轻松导航至新增章节。
已删除数据包含以下情况。
- 具有破坏性设计变更的追溯性修订
- 研究中心重置了标记为删除的事件或表单
- 研究中心重置了重复事件
- 研究中心删除了重复条目组中的行
- 研究中心通过删除关联表单移除了表单关联
- 质疑删除、快速质疑中的撤销操作*
- 非计划事件被删除
* 快速质疑中的“撤消”操作被捕获为删除操作。它包含在质疑的条目或事件的审计跟踪中。仅当质疑的条目或事件也被删除时,它才会包含在“已删除数据审计跟踪”部分中。
限制数据
只有可访问受限表单的用户(其研究角色授予受限数据访问 权限的用户)才能查看“已删除数据审计跟踪”。如果生成文件的用户无受限数据访问权限,且存在受限数据删除记录,Vault 将在 PDF 末尾添加注释:
注释:此文件未包含已删除数据审计跟踪,因生成用户无受限数据访问权限。如需包含此数据,请以具有受限数据访问权限的用户身份重新生成文件。
启用和配置
版本发布时,此功能将自动启用。
PDF 导出中的临床数据命名更新
用例
为了简洁明了,我们已将系统名称更新为 Veeva Clinical Data。
说明
此版本更新了 Clinical Data 系统中的 PDF 导出内容,以反映名称更改为 Veeva EDC。
启用和配置
版本发布时,此功能将自动启用。
将 PDF 文件和文件夹名称中的非允许字符替换为连字符
用例
详细 PDF 和收尾 PDF 的文件和文件夹名称格式已更新,以进一步符合行业规范。
说明
此前使用下划线的文件和文件夹名称现在将使用连字符(短横线,U+002D)替换研究名称、研究中心名称 和受试者 ID 中的特殊字符。生成详细 PDF、收尾 PDF 及单个表单或病例手册 PDF 时,以下任何非允许字符都将替换为连字符:
- 句点(.)
- 空格
- 感叹号(!)
- @符号(@)
- 井号(#)
- 美元符号($)
- 脱字符(^)
- 百分号(%)
- 星号(*)
- 逗号(,)
-
竖线( ) - 加号(+)
- 引号(“)
- 波浪号(~)
- 小于或大于,尖括号(< 或 >)
- 花括号({ 或 })
- 正斜杠或反斜杠(/ 或 \)
- 等号(=)
- 方括号([ 或 ])
- 下划线(_)
在文件夹及文件名中,大写字符将被替换为小写字符。
特别例外:部署研究时,如果用户选择在部署文件中包含详细 PDF,文件名将不包含替换连字符。这些文件用于内部记录保存,而非监管审查。
启用和配置
请联系 Veeva 支持,以启用此功能。
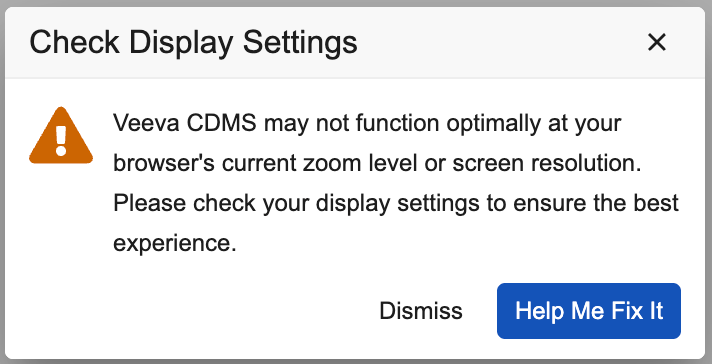
屏幕尺寸警告调整
用例
此更新减少了向最终用户显示屏幕尺寸警告对话框的频率,以提供更好的 UI/UX 体验。
说明
触发屏幕尺寸和分辨率警告对话框显示的阈值已降低,现在当屏幕宽度 < 1270 或高度 < 550 时才会向用户显示。现在,警告仅在应用程序无法使用时显示,而非低于推荐屏幕尺寸时显示。
启用和配置
此更新将自动应用。
了解详情
数据录入
本部分中的功能是对数据录入选项卡的变更,该选项卡是研究者和临床研究协调员输入研究执行数据的工作区域。
ILB 上保留的默认数据及重置
用例
这些更改使识别已收集和未收集的默认数据更加容易。
说明
此版本对设置为有意留空(ILB)或表单重置时的默认数据处理方式进行了以下更改:
- 重置表单 或部分时,默认条目会重置为表单 首次创建时所显示的原始默认值。这减轻了研究中心的负担,使其无需添加新行即可利用新增默认值。
- 行/部分重置将保留值
- 表单 重置将使用该病例手册版本的正确行数和正确默认值重建默认项。
- 当行或表单 标记为 ILB 时,只读默认值将被保留。
- 包含一个或多个默认数据条目的行不可删除。
启用和配置
此更新对新研究自动可用。
显示 RTSM 受试者链接
用例
借助此功能,研究中心用户、数据管理员和 CRA 可以轻松地从 EDC 中的病例手册导航到 RTSM 中的受试者,从而节省时间和精力,并能够在 EDC 和 RTSM 中查看受试者。
说明
用户可以从“数据录入”中病例手册的受试者标题和“审查”中病例手册的受试者操作菜单中显示的新链接直接导航到 Veeva RTSM 中的受试者。选择“RTSM”链接将为用户打开一个新的浏览器选项卡,其中受试者列表会自动筛选为正确的国家/地区、研究中心和受试者。
启用和配置
对于在 RTSM 中拥有 Veeva ID 帐户的 Veeva ID 用户,该用户将自动使用该 Veeva ID 登录并直接进入“受试者”页面。对于 RTSM 中的非 Veeva ID 用户,用户将被转至 RTSM 登录页面,并需要在此进行登录。如果用户没有 RTSM 帐户,则用户将被转至 RTSM 登录页面,且无法进行登录。研究必须在 EDC 和 RTSM 之间进行连接才能看到链接。请联系 RTSM 服务以了解更多信息。
已回答的查询的“编辑值(Edit Value)”按钮已隐藏
用例
此更新更改了查询对话框,以帮助研究中心用户轻松识别已回答的查询。
说明
现在,当查询处于已回答状态时,编辑值(Edit Value)按钮将隐藏。请注意,用户仍可以通过单击“编辑表单(Edit Form)”按钮在显示查询的位置编辑值。同样,根据现有行为,当查询处于打开状态时, 编辑值按钮将启用。
启用和配置
此更新自动可用。
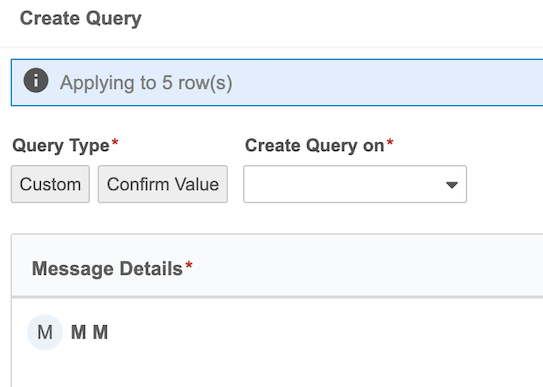
快速查询
用例
研究中心和 CRA 在使用快速查询时无需手动输入查询消息和回复。研究中心用户和监查员在打开和回复查询时经常使用类似消息,如“请确认”、“请验证”等。研究中心通常会回复“数据正确”、“数据已更新”和“标记为空白”等类似内容。快速查询为研究中心和 CRA 提供了一种简洁、简单的自动化方式来提供标准查询消息和回复,大幅减少了用户在创建查询、更新数据和回答查询时所需的击键次数。
说明
标准查询消息和回复为研究中心和 CRA 提供了更快、更好的体验。在工作室中配置的手动查询打开、手动查询回复或条目属性查询(编辑检查)回复时,系统会根据输入或缺失数据的状态提供标准化选项。快速查询可应用于数据条目和事件。
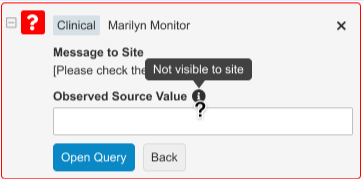
CRA 能够在查询中观察和记录源值,便于在研究中心更新数据后参考比较并关闭查询。研究中心用户不会看到 CRA 在查询中包含的源值,只有当用户拥有观察源值权限时,才能在“审查(Review)”选项卡和审计跟踪中查看。
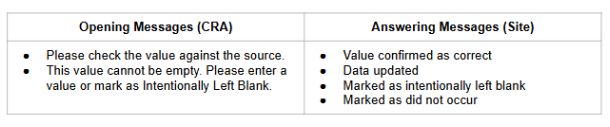
可用的查询消息和研究中心回复将根据条目是否有值自动生成。打开手动查询时,CRA 有三个标准一键选项:
- 根据源检查值(Check Value Against Source)(数据存在时可用)
- 输入缺少值(Enter Missing Value)(数据缺失时可用)
- 创建自定义查询(Create Custom Query)
研究中心用户对条目查询有以下一键选项:
- 编辑值(Edit Value)
- 标记故意留空(Mark Intentionally Blank)(数据缺失时)
- 确认值为正确(Confirm Value is Correct)(数据存在时可用)
- 回复评论(Reply with Comment)
研究中心用户对事件查询也有类似选项:
- 输入事件详细信息(Enter Event Details)
- 编辑事件详细信息
- 标记为未发生(Mark as Did Not Occur)(数据缺失时)
- 确认值为正确(Confirm Value is Correct)(数据存在时可用)
- 回复评论
创建自定义查询(Create Custom Query)和回复评论(Reply with Comment)选项允许 CRA 和研究中心在需要时手动输入查询消息和答案。
当研究中心选择编辑值时,必须提供更改原因。此时系统会立即将表单设为编辑中(In Edit)状态。如果研究中心用户在被查询的项目或事件中编辑了值,查询将自动通过回复 [数据已更新] 来回答。
25R2 的标准查询消息
使用快速查询回答的系统查询将在条件不再满足时自动关闭,显示 [已关闭]。系统关闭的查询不会显示在表单上,但会显示在审计跟踪中。快速查询消息在 UI 和提取中均以方括号 [ ] 标识文本内容。
权限
快速查询向以下标准角色添加了两个新权限(Edit Observed Source Value(编辑观察源值)、View Observed Source Value(查看观察源值))。这些权限仅在研究使用快速查询时有效。
- 编辑观察源值
- CDMS 临床试验监查员(CDMS Clinical Research Associate)
- CDMS Super User(CDMS 超级用户)
- 查看观察源值
- CDMS 临床试验监查员(CDMS Clinical Research Associate)
- CDMS Super User(CDMS 超级用户)
- CDMS 数据管理员(CDMS Data Manager)
- CDMS 首席数据管理员(CDMS Lead Data Manager)
提取 & 列表更新
查询详细信息列表(Query Details Listing)新增以下列:值已确认(Value Confirmed)(是/否)和观察源值(Observed Source Value)。使用快速查询时,查询消息文本将显示在原始查询文本(Original Query Text)、最新查询评论(Latest Query Comment)和最新查询答案文本(Latest Query Answer Text)列中。
在 SDE 中,我们向 SYS_Q 数据集添加了观察源值(OBSSOURCEVAL)列,向 SYS_QT 数据集添加了快速操作类型(Quick Action Type)列(Y/N 形式的 QUICKACT,及 QUICKACTTYPE)。自动回复将显示在系统提取中,如下所示。
- SYS_Q 和 SYS_QT:
- QTEXT
- QTEXTBASE
- QTEXTENG
启用和配置
此功能在启用了查询团队功能的研究 中可用。要使用快速查询,研究还需要查询团队。研究中心必须属于研究中心团队,CRA 必须属于临床团队。对于现有研究,可以修改并部署研究设置。
了解详情
“受试者已存在(Subject already exists)”错误的翻译
用例
使用研究语言设置有助于向研究中心用户传达无法录入受试者的原因。
说明
有了此功能,启用研究的研究语言(Study Language)研究设置后,数据录入中显示的系统错误消息“受试者已存在”将翻译为所选的研究语言。如果未启用“研究语言”设置,消息将默认使用用户的语言。此功能仅适用于通过手动生成受试者 ID 添加受试者的情况。英文消息为“受试者名称‘{受试者 ID}’已存在于该研究中心(The subject name “{subject ID}” already exists in the site)”。
启用和配置
此更新自动启用。
数据审查
本部分中的功能包括对审查(Review)选项卡(临床研究监查员和数据管理员的工作区域)或数据录入选项卡中审查功能的更改。
表单摘要字段的更新
用例
此更新确保所有周期时间计算的一致性,并支持在工作台和临床报告中报告周期时间指标。
说明
如果周期时间计算结果为负值,以下表单摘要周期时间指标现在将返回空值:
- 更新访视到表单提交周期时间
- 更新提交到签名周期时间
- 提交更新到 SDV 周期时间
- 提交更新到 DMR 周期时间
- 提交更新到冻结周期时间
- 提交更新到锁定周期时间
此外,“提交到签名周期时间”指标的计算已更新为保留两位小数。
启用和配置
此更新自动可用。
临床编码
以下是 Veeva 编码器的新功能(Veeva 编码器的临床编码区域)。
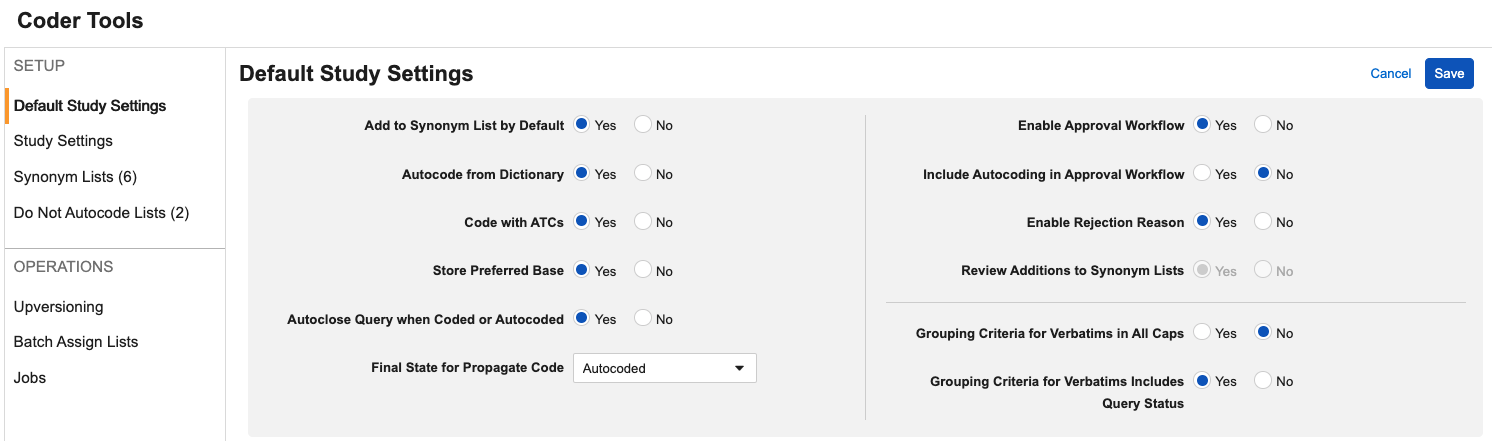
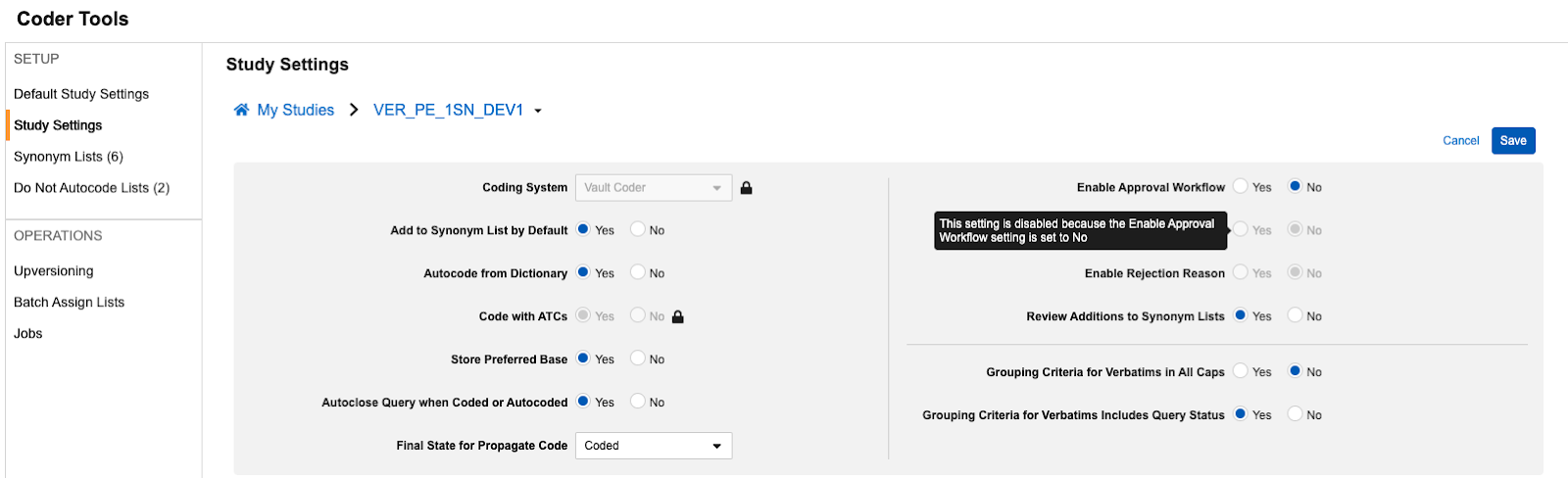
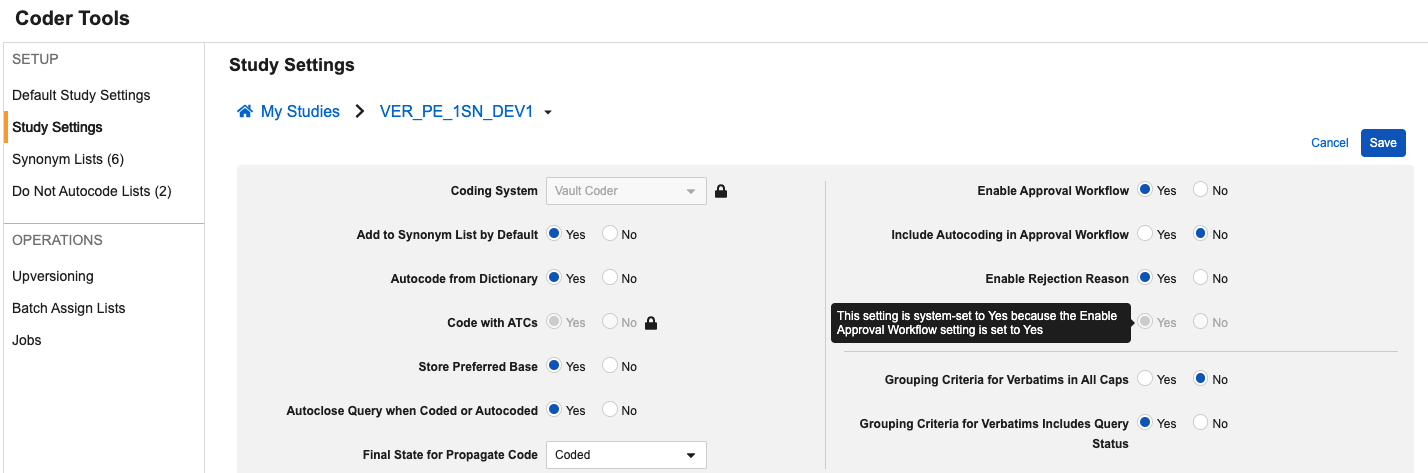
包含自动编码以供审批的选项
用例
为支持 Veeva 编码器中的编码一致性和审核准确性,当为研究启用审批工作流时,编码器管理员现在可配置自动编码术语,使其也进入审批工作流。此更新无需依赖报告或提取来进行外部审查。
说明
此功能新增一个编码工具研究/默认研究设置:将自动编码纳入审批工作流(Include Autocoding in Approval Workflow),该设置仅在现有启用审批工作流(Enable Approval Workflow)设置为是(Yes)时可启用。
此设置可配置为默认研究设置或单独的研究设置。当设为是时,任何因同义词列表 或精确词典匹配而自动编码的术语将进入等待批准 状态,审批通过后将进入最终的自动编码 状态。此设置的默认值为否(No)。
为支持将此字段添加到 UI 中并向用户管理员提供更清晰的信息,我们还重新组织了设置布局并添加了额外的提示框。在编辑(Edit)模式下悬停于选项上时可查看提示框。
启用和配置
这些更新在版本发布后自动可用。现有研究和新研究的“将自动编码纳入审批工作流”设置默认值为“否”。
了解详情
同步编码器列表增强功能
用例
此更新为通过 EDC 同步编码列表 Vault 连接跨多个生产 Vault 管理研究的客户提供了更完善的同义词列表维护支持。
说明
在此版本发布前,使用 EDC 同步编码列表 Vault 连接的多生产 Vault 客户仅能在主生产 Vault 中使用审批或拒绝代码时的应用于同义词列表(Apply to Synonym List)选项以及传播代码(Propagate Code)功能。此版本将这些功能扩展至次要生产 Vault,支持同义词列表的双向更新。
此外,连接名称已从 CDMS 同步同义词列表(CDMS Sync Synonym List)更新为 EDC 同步编码列表(EDC Sync Coding Lists),因该连接包含不自动编码(Do Not Autocode)列表。
启用和配置
此功能在通过 EDC 同步编码列表连接跨多个生产 Vault 的 Vault 中自动可用。
成像
以下是 Veeva EDC 的成像检查模块“Veeva EDC 成像”的新功能。
成像:支持 1GB DICOM 文件
用例
DICOM 检查支持的文件大小阈值已从 50 MG 扩展至 1 GB,这使成像功能可以在检查中容纳更大的文件,提升了上传可靠性和处理能力。
说明
研究中心用户现在可以上传更大的 DICOM 文件,单次检查中单个文件最大可达 1 GB。用户界面中的更新说明会在研究中心用户上传文件时提醒他们:“未压缩的 DICOM(单个文件最大 1GB,总计 4GB)”。
启用和配置
此更新自动适用于使用 Veeva EDC 成像的研究。
了解详情
成像:去标识化期间患者姓名被指定为受试者 ID
用例
为在下游查看应用程序中提供可追溯性,上传的 DICOM 文件中包含的患者姓名元数据在去标识化过程中现已被指定为受试者 ID 值。
说明
上传 DICOM 文件时,系统会自动对包括患者姓名在内的特定 PI/PII 元数据进行去标识化处理。此前,系统在去标识化过程中会为患者姓名指定一个匿名值。此版本发布后,该字段将被指定为受试者 ID。当文件在 EDC 外部被下载或查看时,可看到该受试者 ID。注意:在 EDC 内部,数据录入或成像最终用户的 UI 不会有可见变化。在 EDC 中,患者姓名将显示去标识化标签: 
此更新仅适用于在下游系统中查看文件时可见的元数据值。
启用和配置
此更新自动适用于使用 Veeva EDC 成像的研究。
了解详情
UX:更新了数据网格中的键盘操作
用例
成像数据网格的键盘操作使导航更便捷。
说明
使用箭头键在成像数据网格中导航时,焦点会根据按下的键在单元格之间移动,且焦点会落在单元格内的交互式元素上。可操作元素(如链接、操作菜单、可排序列)会显示蓝色框,不可操作单元格会被灰色框包围。
启用和配置
此更新自动适用于使用 Veeva EDC 成像的研究。
报告和信息板
以下是 Veeva Clinical Data 中的报告和信息板的新功能。
提取 - 新标准报表
用例
这些新的标准报告提升了编码器用户、实验室数据管理员和 Vault 管理员获得的信息可见性,并将开发自定义报告的需求降至最低。
说明
此版本推出了以下新增和更新的标准报告:
- 标准模板:MedDRA 编码报告(V4)——V4 版本更新了报告类型,以包含编码器备注。
- 标准模板:WHODrug 编码报告(V4)——V4 版本更新了报告类型,以包含编码器备注。
- 标准模板:JDrug 编码报告(V4)——V4 版本更新了报告类型,以包含编码器备注。
- 标准模板:实验室位置和研究中心——这份新增标准报告包含实验室位置及使用这些位置的研究中心。
- 标准模板:实验室参考范围——这份新增标准报告列出了实验室位置及其使用的正常范围。
- 标准模板:实验室条目和分析物定义——这份新增标准报告详细说明了研究中使用的实验室条目定义和分析物定义。
- 标准模板:EDC 工具中的研究主程序和许可证密钥——供 Vault 所有者查看 Vault 中每个研究录入的许可证密钥的新增标准报告。(注:此报告中的数据仅对 Vault 所有者可见)
启用和配置
这些报告对 Vault 所有者即时可见。Vault 所有者必须共享新增的编码报告和实验室报告,其他用户才能查看。
了解详情
评估
以下是 Veeva EDC 评估区域的新功能。
受试者筛选器已添加到评估网格
用例
我们新增了一个“受试者”筛选器,以便在“评估(Assessments)”选项卡中更轻松地查找和搜索受试者。
说明
评估网格现在包含“受试者”筛选器,位于现有“研究中心编号”和“重新评估”筛选器之间。新的文本搜索不区分大小写,支持字母数字输入,并将从左到右搜索受试者 ID。
启用和配置
此更新自动可用。
研究设计和配置
此区域中的功能适用于工作室,即 Veeva EDC 的研究设计和配置区域。
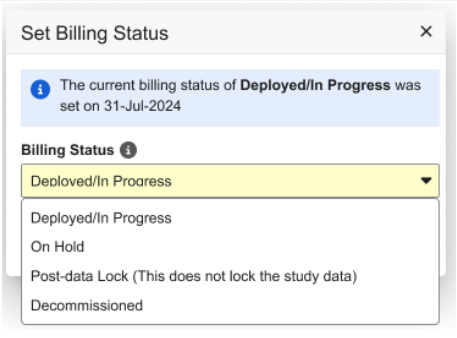
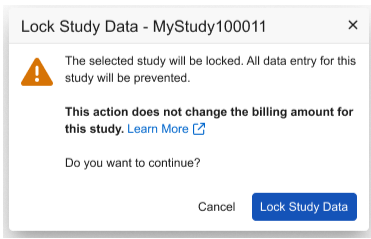
研究锁定和计费增强功能
用例
这些更新提高了非 ELA 客户的计费状态清晰度。
说明
我们更新了非 ELA(企业许可协议)研究的计费状态(Billing Status)选项标签,以提供更清晰的说明。
- 已锁定(Locked)选项已重命名为数据后锁定(Post-data Lock)(此操作不会锁定研究数据)。此项更改后,如果研究数据尚未锁定,用户将无法再将计费状态设置为已锁定。
- 已归档(Archived)选项已替换为已停用(Decommissioned)。与之前的已存档 状态一样,处于已停用 计费状态的研究不允许创建病例手册和研究部署。
相关对话框中也体现了这些更新。
我们还更新了研究数据锁定时显示的对话框,以明确说明研究数据锁定不会影响研究的计费状态。
启用和配置
这些更新立即适用于非 ELA(企业许可协议)研究。
了解详情
当地实验室:正常范围的禁食状态及女性周期支持
用例
实验室正常范围现在可基于禁食状态和女性周期进行管理,无需为这些场景维护重复的分析物。
说明
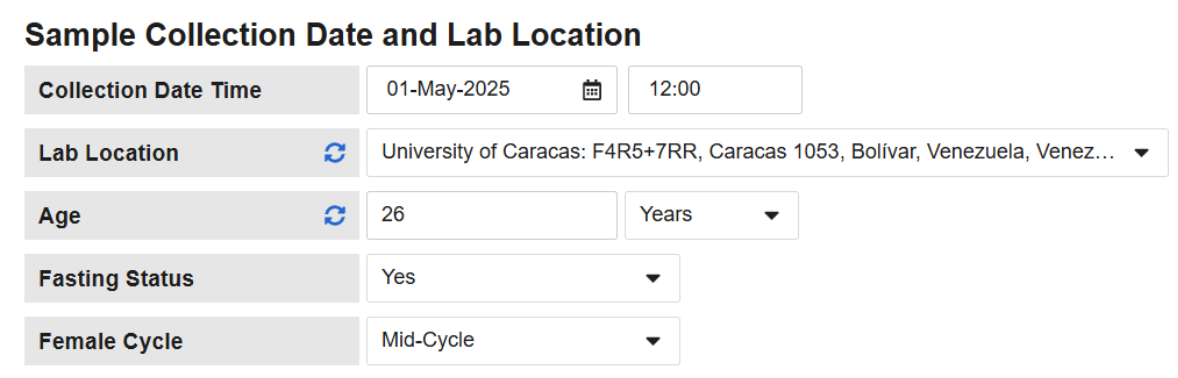
实验室正常范围现在可以像使用性别(Sex)、年龄范围(Age Range)和生效日期(Effective Date)一样,将禁食状态(Fasting Status)和女性周期(Female Cycle)作为参数。实验室表单可配置为在数据收集时(如适用)收集禁食状态 和/或女性周期。然后,这些信息可用于确定相应的正常范围值。
工作室
研究构建者可通过修改条目组属性面板中的实验室标题设置(Lab Header Settings),指示实验室表单是否应在实验室标题中包含禁食状态或女性周期:
选择是将触发向表单的实验室标题添加系统生成的 LBFAST 和 LBFEMALECYCLE 条目。这些条目(如适用)也将包含在提取、临床报告和 CDB 中。
为了支持此项变更,我们还更新了“实验室标题”条目组的命名约定。以前,所有“实验室标题”条目组都命名为 LBHEADER,并在所有实验室表单中重复使用,因为条目组中的条目始终相同。通过新的选项有选择地将“禁食状态和女性周期”添加到某些实验室表单,“实验室标题”条目组现在对于每个实验室表单都是唯一的。因此,新的唯一条目组名称将为 LBHEADER__FormName_。
实验室设置
我们在系统常规设置(System General Settings)中新增了一个用于禁食状态 的“实验室”代码列表,包含选项是、否 和未知(Unknown)。女性周期 代码列表在之前的版本中已添加。25R1 之后创建的 Vault 在该代码列表中包含妊娠(Pregnancy)选项。旧版 Vault 用户可根据需要添加此选项。
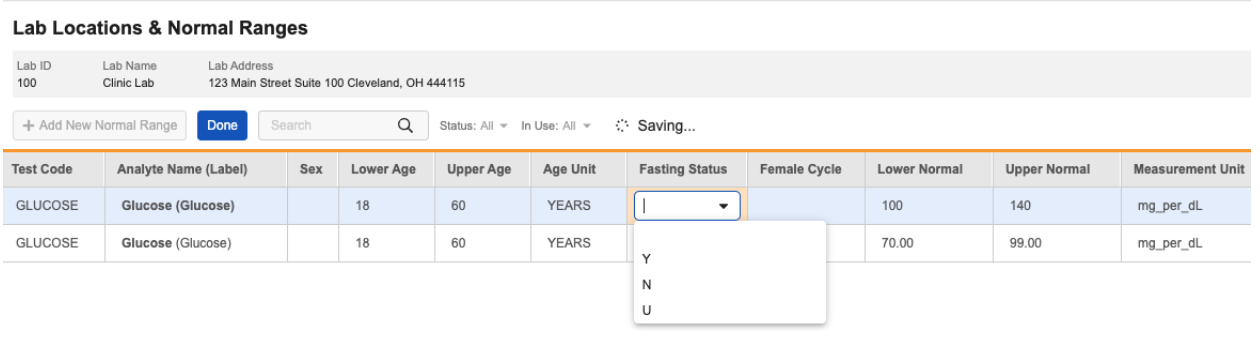
正常范围
Normal Ranges(正常范围)网格已更新,默认包括禁食状态 和女性周期 列。可通过编辑列(Edit Columns)选项移动或移除这些列。
实验室数据管理员可根据需要为受禁食状态 或女性周期 影响的分析物配置正常范围。
正常范围导入文件也已更新,现包括禁食状态 可选列。女性周期 列在之前的版本中已添加。
评估正常范围时,系统将首先尝试精确匹配女性周期 和/或禁食状态(如适用)。如果没有精确匹配,系统将使用禁食状态 或女性周期 为空但其他条件匹配的范围。因此,如果分析物不受禁食状态或女性周期影响,这些值可在正常范围中留空。
数据录入
当实验室表单启用禁食状态 和/或女性周期 时,表单标题将向研究中心显示相关问题。数据输入用户必须提供回复或将条目标记为故意留空(Intentionally Left Blank),才能启用实验室面板并加载正常范围。
启用和配置
此功能在新研究中可用,可通过创建新的实验室表单添加到现有研究中。
了解详情
本地实验室:研究设置错误消息 UI 更新
用例
此更新确保了可访问性,并提升了用户体验的一致性和清晰度。
说明
实验室研究设置(Labs Study Setting)页面上因配置无效而显示的所有错误均已更新,新增错误图标。
启用和配置
自动启用。
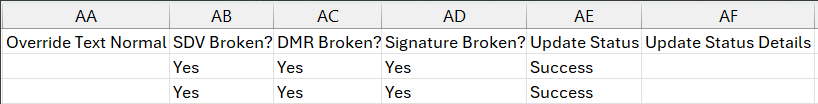
当地实验室:更新以预览和更新过期的实验室正常范围作业
用例
运行“过期的实验室正常范围”作业时,如果作业导致更改,可能会中断签名、SDV 和 DMR。此功能会在“预览和更新过期的实验室正常范围”作业输出文件中记录这一结果。
说明
“预览和更新过期的实验室正常范围”作业的输出文件新增以下列,所有列的值均为“是/否”:
- SDV 中断?(SDV Broken?)
- DMR 中断?(DMR Broken?)
- 签名中断?(Signature Broken?)
当这些列标记为“是”时,仅在更新成功的情况下,审查状态才会被中断。
启用和配置
自动启用。
了解详情
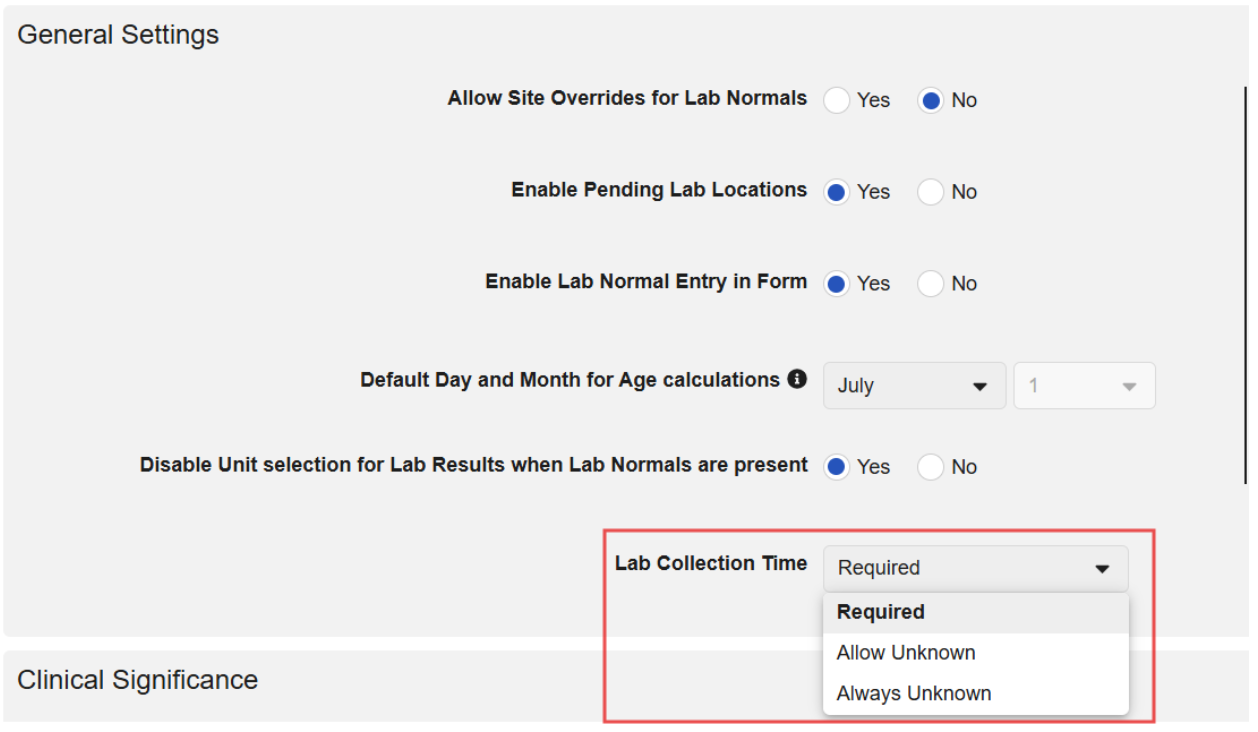
当地实验室:实验室收集日期时间和正常范围生效日期时间的时间未知
用例
实验室样品采集日期和时间用于评估实验室正常范围。此前版本要求必须填写采集时间。现在可配置研究以支持未知时间值,简化了实验室未提供采集时间时研究中心用户的体验。此外,对于实验室未提供时间的场景,我们新增了为正常范围生效日期时间输入未知时间的功能。
说明
实验室设置
申办方可选择实验室采集时间是必填、允许未知值还是始终未知。此设置可在系统常规设置(System General Settings)中配置(作为新研究的默认设置),也可在研究级别的研究常规设置(Study General Settings)中配置。
所选设置值会包含在从工作室导出的研究设计规范(SDS)中。
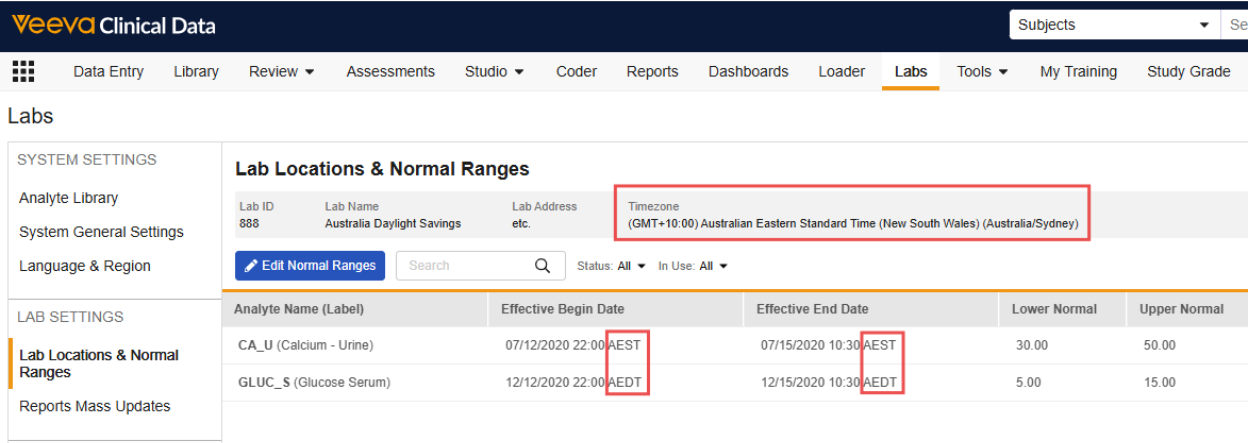
实验室位置:时区收集
Vault 现在会为每个实验室位置收集时区,以支持更精确地评估实验室正常范围的生效开始和结束日期/日期时间,并便于实验室数据管理员录入。版本发布后,新建实验室位置时此字段为必填项,且会显示在“实验室位置”网格和“正常范围”网格的标题中。为实验室位置录入的所有正常范围生效日期时间均以该实验室位置的时区 为准。
对于版本发布时已存在的实验室位置,时区(Timezone)字段将按以下顺序填充(如适用):
- 尽可能基于为实验室位置录入的地址和国家/地区值
- 如果第一个选项不可行,则基于与实验室位置关联的研究中心的时区
-
如果实验室位置未关联任何研究中心,则实验室位置时区将更新为与 Vault 时区一致
- 强烈建议客户在版本发布后检查其实验室位置的时区设置,并根据需要进行编辑。
实验室位置导入文件更新
现在支持通过导入功能更新实验室位置,以便更好地管理实验室位置,包括在版本发布后按需更新时区值。以前导入仅支持创建新实验室位置。
- 更新实验室位置时,LabID 为必填项。如果要更新其他字段值,可提供相应值。空白值不会覆盖现有值。
- 通过导入功能创建或更新实验室位置时,应使用支持的时区值。
实验室正常范围管理和评估
生效开始和结束日期时间值现在支持未知 时间。当时间未知时,实验室数据管理员可以使用问号(?)选项。此项更改后,时间值必须以 24 小时制输入。
所有录入的日期时间值都将基于实验室位置的时区进行评估,并与研究中心录入、基于研究中心时区评估的实验室采集日期时间(Lab Collection Datetime)值进行比较。
提取
在研究数据提取(SDE)和 EDC 核心列表 中,未知时间值将输出为 UN:UN:UN.UNKZ,字段数据类型将为字符串/字符(SAS 数据集)。长度将更新为 64(SAS 长度 256)。
如果使用 CDB,将保留日期时间数据类型,并使用 12:00 作为输入时间。日期时间字段的原始值将以字符串 UN:UN 显示。
上线后限制
研究部署到生产环境后,若要更新实验室采集时间设置,需创建新的病例手册版本。
启用和配置
此功能立即可用。版本发布时已存在的研究将设置为要求完整的日期和时间。
了解详情
电子邮件通知中的重复条目组数据
用例
电子邮件通知规则的额外配置选项提升了电子邮件收件人获得的数据可见性。
说明
电子邮件通知规则现在支持来自重复条目组的数据。配置规则时,研究设计者可在“发送电子邮件(Send Email)”规则操作的“消息(Message)”区域添加重复条目组内条目的令牌。规则操作的新工具提示有助于指导研究设计者如何包含重复条目组的数据。
对于规则逻辑评估为“真”的所有条目组重复项,电子邮件收件人将在一封电子邮件通知中看到相应数据。
启用和配置
此更新在工作室中自动可用。
了解详情
规则编辑器支持 @StudyCountry 上的国家/地区代码
用例
此功能允许研究设计者基于 Veeva Vault Platform 的标准化国家/地区代码值编写规则。作为 24R3 正式版本的一部分新增的标准国家代码,可在不同应用程序之间实现国家/地区的无缝关联,无论国家/地区名称是否存在差异。这些代码现在可在规则编辑器中使用,以确保规则始终引用正确的研究国家/地区,即使 Clinical Operations - EDC 连接更改了国家/地区名称。
说明
现在,在工作室规则编辑器中创建规则标识符时,国家/地区代码 @StudyCountry.country_code__v 已可用。作为最佳实践,研究设计者在配置用户定义的规则时,应使用此引用,而非国家/地区名称文本字符串。
启用和配置
此更新在工作室中自动可用。对于 24R3 之前创建的 Vault,请联系 Veeva 支持人员,确保 Vault 已更新至最新的国家/地区代码。
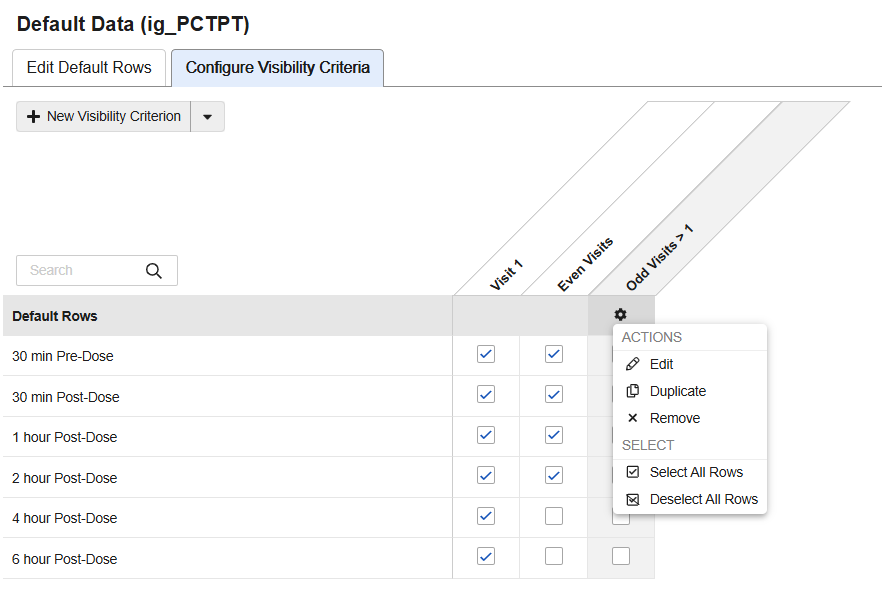
计划驱动的默认数据
用例
工作室的新设计选项通过允许重复条目组在病例手册中的特定事件、事件组和表单上配置不同的默认数据,提高了标准化程度和设计复用性。研究设计者可以通过减少独特表单的总数,并根据研究设计需求在不同的独特表单中进一步复用条目组,从而减少开发和测试工作。这也减少了后续在报告和提取中合并表单数据的编程工作。
说明
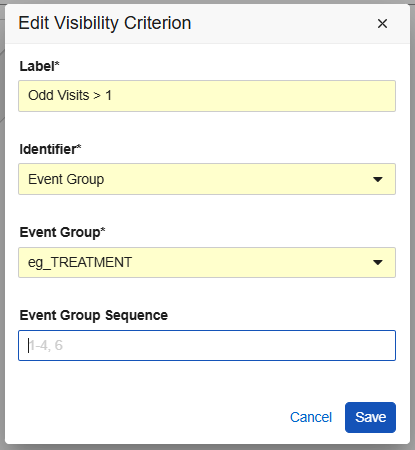
在重复条目属性的默认数据(Default Data)区域中,新增了可见性标准(Visibility Criteria)选项卡,研究设计者可在此设置确定哪些默认代码列表条目值在研究计划内的各个位置可见的标准。创建新的可见性标准后,菜单操作和复选框便于查看和选择默认行。从选择网格中,研究设计者可以根据研究方案的要求选择、隐藏数据默认值或重新排序。
默认数据可分配给特定的表单、事件组和事件。对于重复事件组和重复表单,可以输入序号来指定将在哪些特定的研究计划位置默认应用选定的值。配置选项会根据标识符和研究设计动态调整。验证和警告可帮助设计者正确配置默认数据。
研究设计规范(SDS)中新增了条目组默认值(Item Group Default Values)选项卡,详细说明了可见性标准的设计配置。带注解的 PDF 和附录中的注释也包含可见性标准。部署后,在工作室中运行比较报告时可以看到对条件的变化。可见性标准也可以从研究和库中复制。
启用和配置
此更新自动可用。
了解详情
工作室复制改进
用例
此功能为从库或其他研究中复制内容的研究设计者提供了额外功能,以进一步促进研究设计的复用,并减少配置研究时的工作量。
说明
工作室中的复制功能已新增和改进,包括以下特性:
- 复制实验室表单
- 当目标研究启用了实验室功能时,可以复制源研究中的实验室表单
- 复制表单时始终包含系统规则
- 单变量规则和渐进显示规则在复制表单时将始终包含在内,这些规则作为表单属性的一部分进行复制,与是否勾选“包含规则”的复选框无关
- 复制时新增筛选器并改进搜索功能
- 复制对话框中新增了“搜索方式”筛选器,用户可以按所有字段、名称、描述或表单进行筛选
- 复制表单时勾选“包含规则”复选框后,用户定义的规则会根据计划进行评估,以进一步确保规则复制成功,减少被跳过的规则数量。
- 表单复制将始终作为一个作业运行,并提供日志,无论复制的表单数量多少。这取代了之前选择 20 个或更少表单时显示的进度对话框。
启用和配置
在工作室中自动可用。
EDC:空白 PDF 的研究语言和区域设置
用例
此增强功能在 25R1 版本发布的研究语言功能基础上进行了扩展,将 EDC 生成的空白 PDF 也纳入其中。
说明
从“数据录入”或“审查”中导出空白 PDF 时,如果“强制实施研究语言(Enforce Study Language)”设置为“是”,PDF 将以指定的研究语言和区域设置显示。如果未强制使用研究语言,则空白 PDF 将以用户的语言和区域设置生成。
启用和配置
在工作室中自动可用。
工作室标签的研究语言
用例
以前,需要将“强制实施研究语言”设置为“是”才能在工作室中查看和保存翻译。此功能允许研究设计者在工作室中查看翻译后的标签,以确保构建内容使用研究语言,特别是当研究语言与 Vault 语言和用户语言不同时。
说明
借助此功能,系统将使用为研究语言输入的值(与强制实施研究语言(Enforce Study Language)设置无关)来在工作室中显示和保存翻译内容。工作室中的设计对象标签将以选定的研究语言在已为研究上传翻译内容的情况下保存。这包括事件组、事件、表单、条目组、条目 和代码列表 值标签等的标签。作为此功能的一部分,工作室生成的 PDF 将以选定的研究语言显示。如果未选择研究语言,则标签将默认使用 Vault 语言。
请注意,应用程序标签(非研究标签)仍将以用户的语言显示。
启用和配置
在工作室中自动可用。
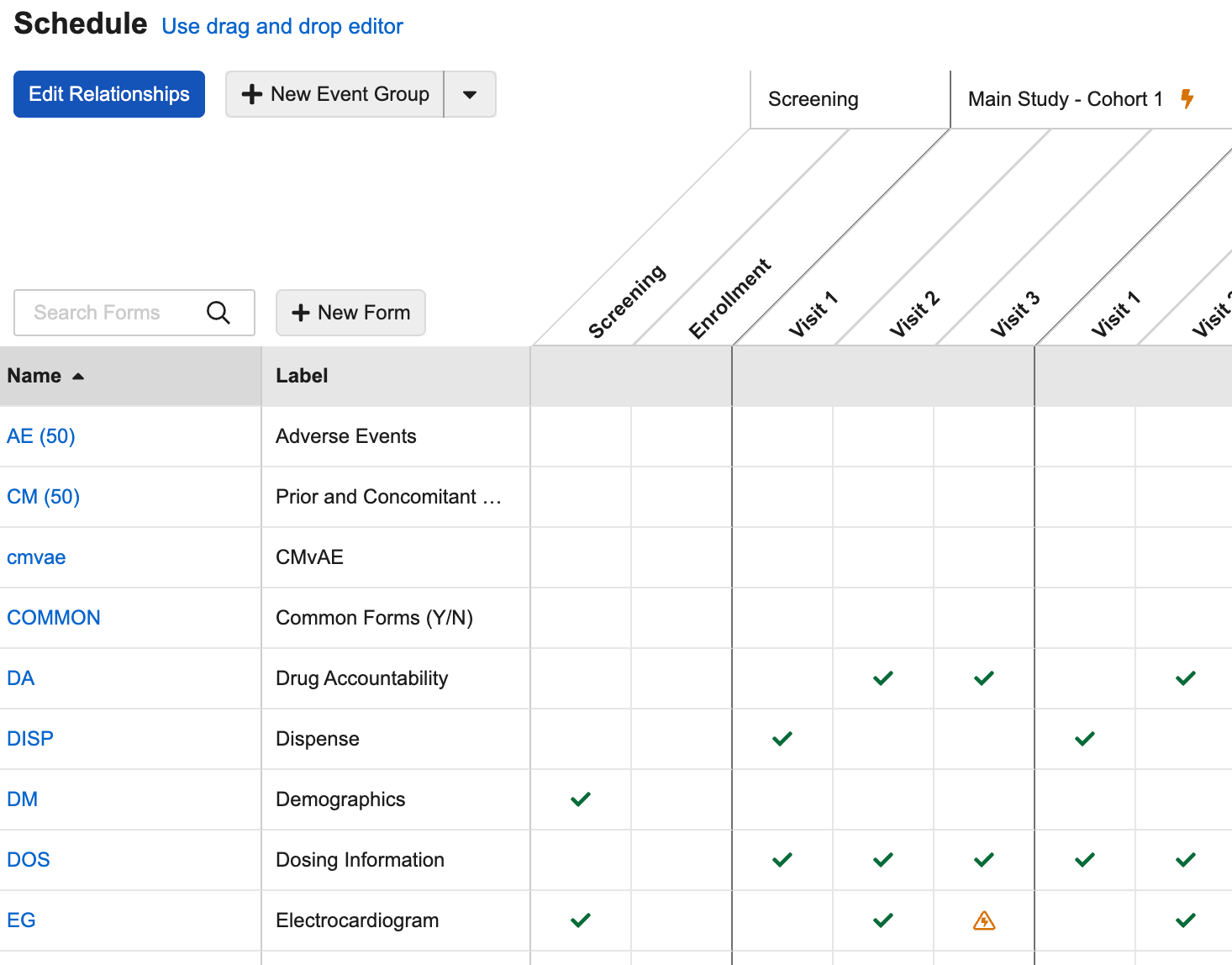
动态规则的计划网格改进
用例
这些针对动态规则查看的增强功能为研究设计者在工作室计划网格中工作时提供了更好的可用性和清晰度。
说明
工作室计划网格中的更新包括:
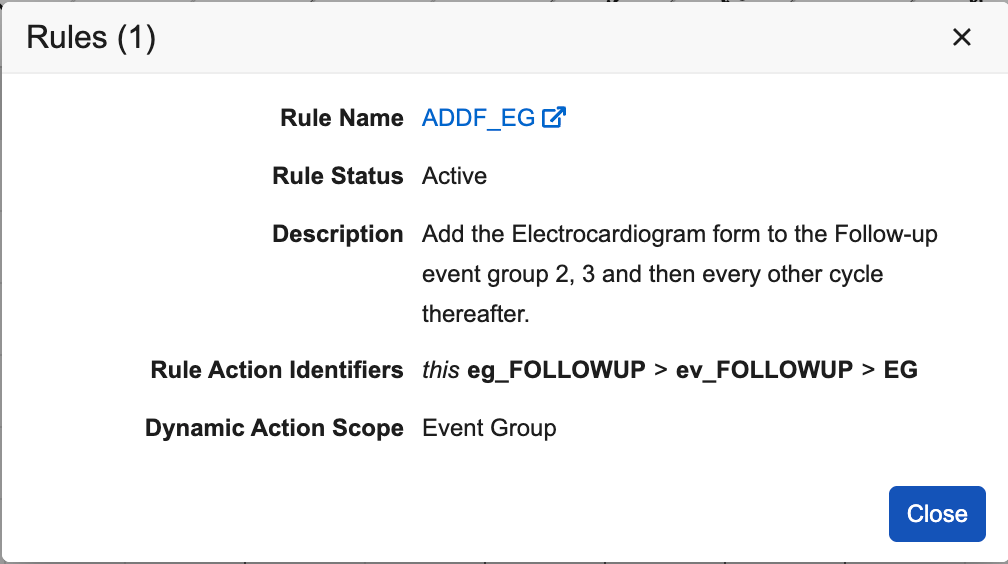
- 为未配置规则的动态表单、事件和事件组新增了一个图标。将鼠标悬停在该图标上时,提示框消息会显示“无规则。单击以添加(No rule. Click to add.)”,单击该图标可直接打开规则编辑器。
- 为动态对象配置的规则数量(活动 + 非活动):将鼠标悬停在动态规则图标()上时,会显示“查看规则(#)(View rules (#))”。
- 单击动态规则图标时,会弹出新的对话框,显示规则的更多详细信息。
启用和配置
这些更新在工作室中自动可用。
了解详情
研究管理
本部分中的功能适用于系统工具(System Tools)或 EDC 工具(EDC Tools),即 Veeva EDC 的研究级管理区域。
管理:支持 VeevaID 用户名更新
用例
在 25R2 版本中,VeevaID 的平台更新现在允许用户更新其用户名(即电子邮件地址)。此功能支持在 EDC 中显示这些更改。
说明
为支持 25R2 平台中允许 VeevaID 用户更新电子邮件地址的功能,我们在 EDC 中做出了以下变更以体现这一更新:
- 用户活动报告已更新,包含 VeevaID 和申办方用户的用户名及电子邮件更改。
- 当 VeevaID 用户更新电子邮件地址/用户名后发生访问事件时,“用户访问(User Access)”报告现在会同时引用新旧用户名。
启用和配置
这些更新立即可用。
了解详情
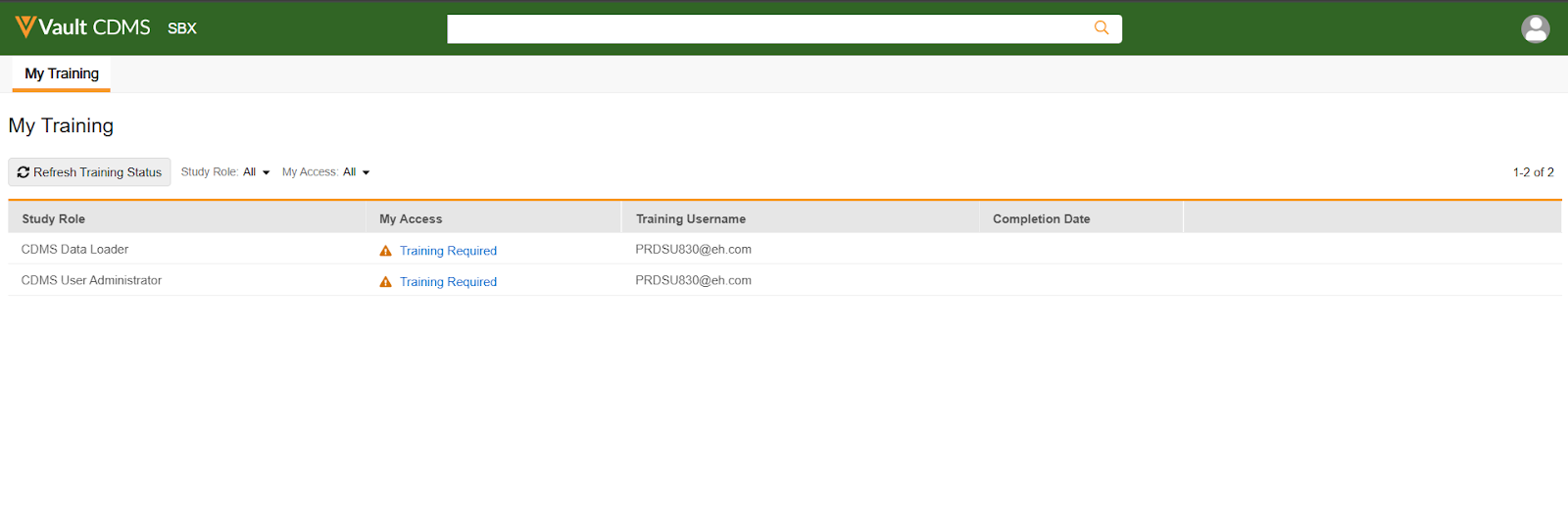
VeevaID 和 Veeva 培训报告的增强功能
用例
拥有多个 Veeva 帐户的用户在 CDMS Vault 培训和 EDC Vault 中可能使用不同的帐户。这些更新明确了访问培训时应使用哪个用户名。
说明
我们对培训报告和我的培训(My Training)选项卡实施了以下增强:
- 对用户培训报告进行了两项列更改。这些列大约每 12 小时更新一次:
- 学习系统用户名(Learning System Username):填充此列的逻辑已更新。
- 报告将显示与用户培训访问相关的 VeevaID(研究中心用户)或域用户名(申办方用户)。
- 如果培训用户名尚未可用且 CDMS 用户为“申办方”,则学习系统用户名 列将为空。
- 如果培训用户名尚未可用且 CDMS 用户为“研究中心”,则学习系统用户名 列将显示 CDMS 用户的电子邮件地址。
- 如果 CDMS 用户没有用户类型,则学习系统用户名 列将为空。
- VeevaID 注册状态:此列已添加到报告中,并显示 VeevaID 用户的注册状态(已注册(Registered)、邀请已发送(Invitation Sent)、邀请尝试次数已用尽(Invite Attempts Exhausted)等)。
- 学习系统用户名(Learning System Username):填充此列的逻辑已更新。
- 我的培训(My Training)选项卡上的表格已更新,以显示每个培训要求对应的培训用户名。
-
当用户单击我的培训选项卡上的培训访问(Training Access)链接,且登录需要使用不同的用户名时,系统会在登录屏幕中预先填充正确的培训用户名。
-
当 CDMS 中的用户与 Vault 培训中的用户相同时,改进了向 Vault 培训的重定向,以避免重新认证。
启用和配置
此功能立即可用。
了解详情
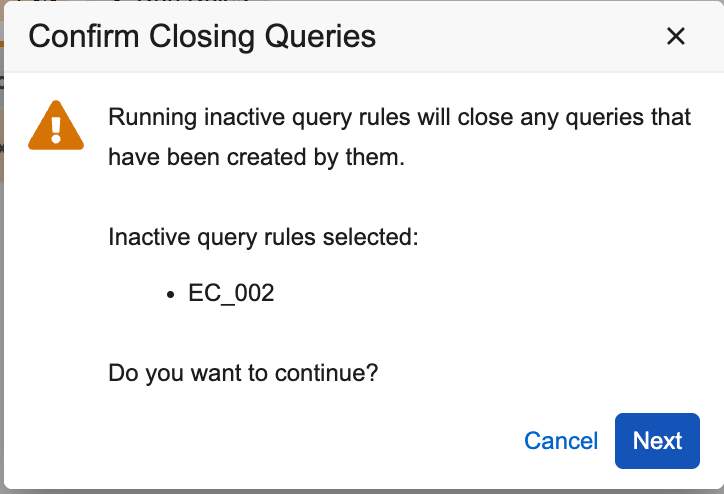
规则作业:为非活动规则关闭查询
用例
拥有“运行规则”权限的用户现在能够关闭由已不再活动的规则所打开的查询,从而减少 CRA 和数据管理员的工作量。
说明
从 EDC 工具的“运行规则”作业中,可以选择并运行已停用的“打开查询”规则,以关闭这些规则在活动状态时创建的未处理的查询。可以使用“规则状态”筛选器来查找那些最初处于活动状态、随后在工作室中被停用并已部署的特定规则。运行已停用的规则时,会弹出确认对话框,允许用户在运行作业前检查其选择。
规则预览作业和规则作业的输出文件将在相关作业文件中显示“已关闭”操作。“审计跟踪(Audit Trail)”和“查询详细信息(Query Details)”列表将显示该查询由系统关闭。只有处于“未处理”状态的查询会被关闭。已回答的查询不会被关闭。作为此功能的一部分,规则作业页面上列出的规则默认视图仅筛选出活动规则。当用户需要运行非活动规则时,可以将其添加到筛选视图中。这有助于防止无意中选择和运行过多的非活动查询规则。
启用和配置
此功能自动启用。
了解详情
在审计跟踪中不显示“CTMS 的来源研究中心”条目
用例
此更新通过不再显示对用户无意义的无用 ID 值,提高了审计跟踪的可读性。
说明
在 25R1 版本中,我们发布了对“移动受试者”功能的更新,包括在事件和方案偏离上标记原始研究中心,以支持 Clinical Operations Vault 中处理的研究中心付款。在 25R2 版本中,我们将不再在事件或方案偏差的审计跟踪用户界面、详细 PDF 或审计跟踪导出输出中显示“CTMS 的原始研究中心”值的条目,因为显示的 ID 值对最终用户没有意义。移除的审计跟踪条目格式如下:
“CTMS 的原始研究中心”设置为“[原始研究中心 ID 号]”将受试者移动到新研究中心这一操作的审计跟踪条目仍保留在审计跟踪中。
启用和配置
此更新自动可用。
成像提取物作业
用例
批量提取功能为下载成像检查提供了更高效的方式,使申办方能够更轻松地接收检查并将其传输到存储位置以进行长期保留。此功能对包含大量检查文件的大型研究中心和研究特别有益。
说明
现在可以从 EDC 工具中新增的成像提取物 临时作业中批量提取成像检查。首席数据管理员和管理员可以添加作业,将检查副本传输到用户 Vault 文件暂存区域内的父文件夹 imaging_extract 中。运行作业时,可以选择是否包含受限数据,以及是否运行所选的研究中心或受试者。只有拥有“受限数据访问”权限的用户才能看到受限数据选项。
作业成功传输后,用户会收到电子邮件通知,并可以通过 GUI 客户端或 API 访问暂存文件,以便与下游系统集成。拥有新“Vault 文件管理器访问”权限的用户可以使用 Veeva 的 Vault 文件管理器客户端从文件暂存区访问提取的影像。作业完成后,文件将在 72 小时后从文件暂存区自动删除。根文件夹将采用以下显示格式,并包含研究中心、受试者和检查的子文件夹。
Study_Imaging_Extract_2024_05_27_11_25
Study_Imaging_Extract_2024_05_27_11_25_RESTRICTED
请注意,该研究一次只能运行一个“成像提取物”作业。
启用和配置
请联系 Veeva 服务,以启用此功能。此功能将在 25R2 常规版本中自动启用。
了解详情
在审计跟踪导出中包含编码器审计跟踪
用例
医疗编码审计历史记录以前仅能在 UI 内查看。此版本现在支持将该信息作为审计跟踪导出的一部分进行导出,以便审查和分析。
说明
“受试者(Subject)”、“研究中心(Site)”和“研究审计跟踪导出(Study Audit Trail Export)”作业现在提供了包含医疗编码审计跟踪的选项。
为提升这些审计跟踪的可用性,我们从审计跟踪 UI 和导出内容中屏蔽了对标签键和“全大写”值的引用,包括以下字段:
- 所采取的 AE 操作标签键(AE Action Taken Label Key)
- AE 预期结果标签键(AE Expected Outcome Label Key)
- AE 结果标签键(AE Outcome Label Key)
- AE 关系标签键(AE Relationship Label Key)
- AE 严重性标签键(AE Seriousness Label Key)
- AE 严重程度标签键(AE Severity Label Key)
- 所采取的 AE 操作(全部大写)(AE Action Taken AllCaps)
- AE 预期结果(全部大写)(AE Expected Outcome AllCaps)
- AE 结果(全部大写)(AE Outcome AllCaps)
- AE 关系(全部大写)(AE Relationship AllCaps)
- AE 严重性(全部大写)(AE Seriousness AllCaps)
- AE 严重程度(全部大写)(AE Severity AllCaps)
- CM 课程编号标签键(CM Course Number Label Key)
- CM 剂量标签键(CM Dose Label Key)
- CM 剂量单位标签键(CM Dose Unit Label Key)
- CM 频率标签键(CM Frequency Label Key)
- CM 适应症标签键(CM Indication Label Key)
- CM 途径标签键(CM Route Label Key)
- CM 课程编号(全部大写)(CM Course Number AllCaps)
- CM 剂量(全部大写)(CM Dose AllCaps)
- CM 剂量单位(全部大写)(CM Dose Unit AllCaps)
- CM 频率(全部大写)(CM Frequency AllCaps)
- CM 适应症(全部大写)(CM Indication AllCaps)
- CM 途径(全部大写)(CM Route AllCaps)
- 逐字(全部大写)(Verbatim AllCaps)
启用和配置
此功能自动启用。
了解详情
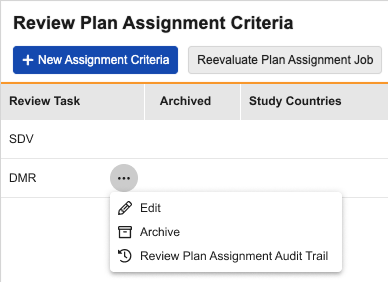
审查计划任务审计跟踪
用例
数据管理员和拥有“管理审查计划任务”权限的用户现在可以在 EDC 中查看审查计划任务的审计跟踪。此功能使客户无需联系 Veeva 支持团队,就能更好地监督审查计划的变更。
说明
审查计划任务审计跟踪(Review Plan Assignment Audit Trail)已作为选项添加到审查计划任务标准(Review Plan Assignment Criteria)页面上的操作菜单中。选择审查计划任务审计跟踪选项将打开审查计划任务记录的审计跟踪对话框,以查看审计追踪的用户所在时区显示事件描述(Event Description)、用户名(Username)和时间戳(Timestamp)。
作为此功能的一部分,已存档列已添加到网格以及 CSV 和 Excel 导出内容中。新增的显示已存档的任务(Show Archived Assignments)复选框允许用户筛选视图。该复选框默认处于未选中状态。
已存档的审查计划任务无法取消存档。用户存档后必须添加新的任务记录。存档审查计划时,系统会弹出对话框并显示以下警告信息:
- 此后将不会根据此标准分配审查计划
- 现有审查计划任务不受影响
- 此操作无法撤消
- 若要再次使用相同标准,必须创建新记录
启用和配置
自动启用。
了解详情
S3 提取文件交付支持
用例
通过客户的 Amazon S3 存储桶交付文件,扩展了 Veeva EDC 导出文件的交付选项。
说明
此版本新增了一个外部交付选项:能够配置客户拥有的 Amazon S3 存储桶,以接收来自 Veeva EDC 和 Veeva 编码器的文件。配置系统工具后,此额外交付选项允许按计划运行的作业将文件交付到 Amazon 云。
启用和配置
拥有“所有研究”、“系统工具”访问权限以及经重命名的“管理出站连接”权限(原“管理 FTP”)的用户可使用此功能。
在用户活动报告中纳入已合并的用户
用例
将研究中心用户转换为 EDC 的 VeevaID 时,某些申办方域用户帐户无法直接转换为 VeevaID。在这种情况下,会单独添加 VeevaID 用户帐户,并且映射记录会将 VeevaID 用户与申办方用户关联以用于报告。
说明
当申办方域用户帐户必须通过映射记录与 VeevaID 账户合并时,系统会在用户活动报告的操作(Action)列中记录此操作,并显示标注为“用户已禁用——VeevaID 域冲突自动解决(User disabled—VeevaID Domain Collision Auto-Resolution)”。
启用和配置
此更新自动启用。
阐明规则作业文件中的动态规则冲突和规则结果
用例
从 EDC 工具运行动态规则期间遇到冲突的规则结果时,规则作业输出文件新增了列且减少了行数,以更准确、清晰地呈现发生的操作信息。
说明
在 rule_details.csv 和 create_delete_dynamics_details.csv 输出文件的规则作业预览和作业结果中,新增了规则结果(Rule Result)和操作详细信息(Action Details)两列。冲突规则会在操作详细信息 列中记录,当冲突规则未作为当前作业的一部分运行时,不再在文件中单独占行显示。
规则结果 列显示所运行规则的评估结果(True 或 False)。
操作详细信息 列显示有关规则操作的额外信息,并告知用户哪些其他规则可能覆盖了所运行规则的预期操作。当存在另一个对同一动态目标对象有更具体结果的规则时,会显示消息“操作被现有规则结果覆盖:ruledef_name(Action overridden by existing rule results: ruledef_name)”,其中可能会列出一个或多个规则定义。
启用和配置
此功能自动启用。
了解详情
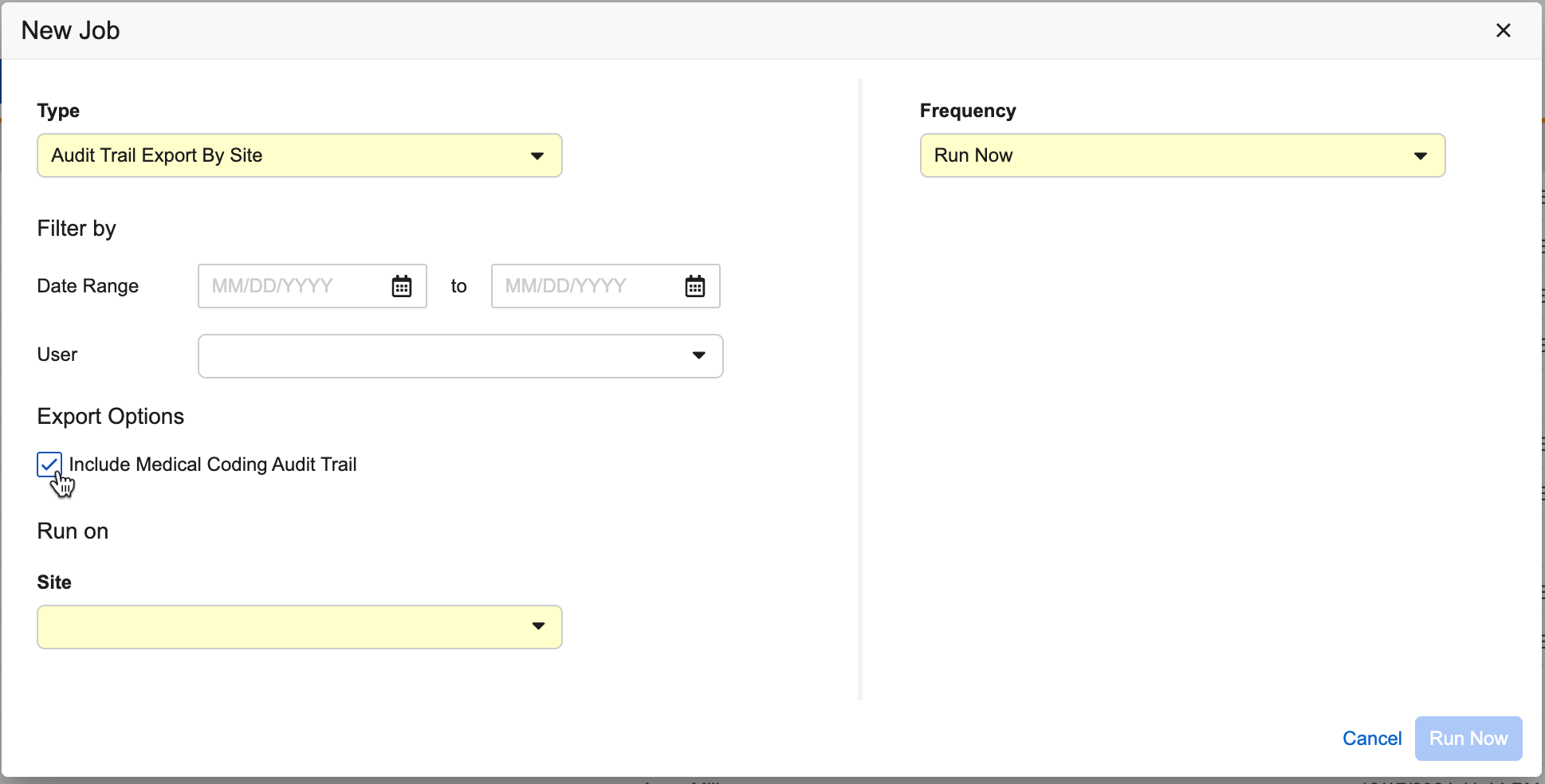
增强了审计跟踪导出作业的提示框
用例
提示框的增强提供了更多细节,帮助最终用户快速识别审计作业中包含的作业选项。
说明
将鼠标悬停在“作业历史记录”中“审计跟踪导出”作业旁的信息图标上会显示该作业的详细信息。所选的日期范围、用户、研究中心、受试者,以及“包括定义、关系和外观审计更改”和“包括医疗编码审计跟踪”的选项将显示在提示框中。当未进行任何选择时,信息图标会隐藏。以下作业可查看相关选择:
- 按受试者导出审计跟踪
- 按研究中心导出审计跟踪(Audit Trail Export By Site)
- 按研究导出审计跟踪
启用和配置
此更新自动可用。
角色管理与安全
本节中的功能是对系统工具 > 角色管理(Role Management)和系统工具 > 用户(Users)区域的增强,以及对 Veeva Clinical Data 中的标准研究角色(Study Roles)、安全性和访问控制的更改。
针对方案偏离的 CDMS API Read Write(CDMS API 读写)和 CDMS API Read Only(CDMS API 只读)权限更新
用例
为在未来版本中通过 API 管理方案偏离做准备,我们正在更新 CDMS API 用户的权限。
说明
CMDS API 读写标准角色已更新,包含以下权限:
- 查看方案偏离
- 创建方案偏离
- 编辑方案偏离
CDMS API 只读标准角色已更新,包含查看方案偏离 权限。
启用和配置
权限更新在版本发布时自动分配给 CMDS API 读写和 CDMS API 只读角色。
新的 Vault 文件管理器访问权限
用例
新权限“Vault 文件管理器访问”允许用户在 Vault 文件管理器应用程序的“文件暂存(File Staging)”选项卡中查看和管理文件。
说明
“Vault 文件管理器访问”权限可在“角色管理(Role Management)”表格(“研究管理(Study Administration)”部分)中看到,它授予对通用文件暂存访问的权限,其中包含发送到 Vault 级 FTP 连接的所有提取作业。新权限已添加到以下标准角色中:
- CDMS Super User(CDMS 超级用户)
- CDMS 首席数据管理员(CDMS Lead Data Manager)
- CDMS 数据管理员(CDMS Data Manager)
- CDMS 用户管理员(CDMS User Administrator)
- CDMS API Read Write(CDMS API 读写)
启用和配置
此功能自动启用。
了解详情
连接与集成
本节中的功能是与 Veeva Clinical Data 的新连接或集成,或对现有连接或集成的增强。
Safety-EDC 连接:安全病例跟进遵循安全决策
用例
通过 Safety-EDC 连接,Veeva EDC 不仅将受试者数据作为实际安全病例 的一部分发送到 Veeva Safety,还会发送额外的受试者信息,以便获得病例数据之外的见解。通过简单选择,这些额外的受试者信息可以添加到 Veeva Safety 病例中,也可以从病例中移除。
在另一种场景中,从 Veeva EDC 发送的安全病例 可能包含多个事件,在 Safety 端可以拆分为单个病例,或者单个安全病例可以合并为一个。
现在,Veeva EDC 通过 Safety-EDC 连接了解这些安全决策。虽然 Veeva EDC 中的 EDC 临床数据和研究中心链接决策保持不变,但在编制下一次后续发送时,会遵循在 Veeva Safety 中做出的有关添加、移除、拆分或合并的决定。
例如,在 Veeva Safety 中可能添加了伴随用药。此功能保证,如果对该伴随用药 表单进行更改,安全病例 将收到后续发送,即使该表单未被研究中心在 EDC 中链接。在本版本之前,由于表单未被研究中心链接,不会有后续发送。
说明
Veeva Safety 中的安全决策包括添加和移除额外的受试者信息,或拆分和合并病例。Veeva EDC 会收到这些操作的通知,并在更智能的病例后续发送中遵循在 Veeva Safety 中做出的决策。
此功能对 EDC 用户体验没有影响,不能仅在 EDC 中测试,需要与 Veeva Safety 进行集成测试。在 Veeva Safety 中必须追踪 Veeva EDC 中的数据更改和安全决策所产生的适当后续操作。
启用和配置
对于使用安全-EDC 连接的研究,此功能会自动启用。
E2BLink:在安全病例中包含有关安全病例启动事件的相关数据
用例
为提高复杂研究设计的灵活性,嵌入在安全病例启动事件(通常是不良事件 EDC 表单)中的条目组现在可以包含在安全病例中。这些重复条目组通常涵盖不良事件表单上的研究药物分配、药物史、如果死亡、病史或测试结果,而研究设计中没有为这些内容设置独立的表单。借助此功能,当某个事件将为受试者启动安全病例时,研究中心用户可以根据需要输入相关信息。
说明
在“工作室(Studio)”>“安全集成(Safety Integrations)”>“表单配置(Form Configurations)”中,研究设计人员现在可以将已映射到安全病例启动事件 数据类型的 EDC 表单映射到其他安全数据类型,包括伴随用药、如果死亡、病史、药物史、研究药物 或测试结果。
例外情况是不能第二次映射到安全病例启动事件 或患者特征 安全数据类型。按系统划分的报告者/发送者评论 数据类型已经支持在安全病例启动事件 数据类型上的双重使用。
如果已映射到安全病例启动事件 数据类型的 EDC 表单正在映射到另一种安全数据类型,以下范围内的每个条目(Each Entry In)字段现在会自动选择表单中的重复条目组(Repeating item group in form)。请注意,对于如果死亡、患者特征 和按系统划分的报告者/发送者评论安全数据类型,以下范围内的每个条目 字段仅允许该字段的表单(Form)选项。
此新功能受表单复制功能支持,并反映在研究设计规范(SDS)中。
启用和配置
对于使用 E2BLink 链接的研究,此功能会自动启用。
E2BLink:研究药物安全类型中的研究药物适应症
用例
主要来源报告的适应症(G.k.7.r.1)记录了报告者对研究药物使用适应症的描述。虽然对于研究中的所有受试者或每个受试者来说,这可能是一个单一值,但这个新选项允许适应症的配置在主要研究药物表单上因分配而异。如果在受试者病例手册中使用多个值,所有值都将包含在 E2B XML 中。
说明
对于 E2BLink 研究,在“工作室”>“表单配置”>“条目配置(Item Configuration)”中,用户现在可以将 G.k.7.r.1(主要来源报告的适应症)映射到研究药物 安全数据类型上的条目定义。
启用和配置
对于使用 E2BLink 链接的研究,此功能会自动启用。实时研究的配置可能会导致对现有安全病例发送后续安全消息。
安全集成:将次要事件研究中心链接包含在安全病例中
用例
安全病例由主要的安全病例启动事件(最常见的是严重不良事件)启动。根据 Veeva EDC 安全集成设置中的包含规则,其他次要事件(通常是非严重不良事件)可以包含在病例中。这些事件可以通过研究中心链接到其他与安全病例相关的信息,包括伴随用药和病史。虽然这些链接的信息总是可以包含在主要启动事件的安全病例中,但现在也可以包含在作为安全病例一部分的次要事件中。
说明
这一新的研究设置适用于 Safety-EDC 连接和 E2BLink。
在“工作室”>“安全集成”>“安全设置(Safety Settings)”中,用户现在能够将研究配置为将次要事件研究中心链接包含到病例中。
将此字段设置为是 会导致从链接到任何次要事件的表单中配置的所有数据都包含在病例中。请注意,在所有新研究 中,此设置默认设为是。
对于 Safety-EDC 连接,所有未链接的安全相关数据仍将传输至 Veeva Safety,并作为额外的受试者信息提供,超出现在包含在实际安全病例中的新信息。
作为此功能的一部分,“安全集成”>“表单配置”中的安全表单类型 标签已重命名为安全数据类型,以更好地反映数据传输的类型。
启用和配置
对于使用 Safety-EDC 连接或 E2BLink 链接的研究,此功能会自动启用。对正在进行的研究配置包含次要事件研究中心链接可能会导致现有安全病例的后续安全消息。
Clinical Operations-EDC 连接:将事件组定义-事件定义关系发送到 CTMS
用例
目前,Clinical Operations - EDC 连接自动将访视组定义和访视定义从 Veeva EDC 传输到 Veeva CTMS,但不传输它们之间的关系。此功能增强了 Clinical Operations - EDC 连接,使其能够基于 EDC 中相应的“事件组定义 - 事件定义”对象,在 Veeva CTMS 中创建和管理访视组定义与访视定义之间的关系。此增强功能在 Veeva CTMS 中提供了更详细和准确的研究访视结构表示,从而更好地管理并与研究方案保持一致。
说明
如果为 Clinical Operations - EDC 连接配置了此功能,对于在 EDC 中找到的每个相关事件组定义 - 事件定义记录,系统将更新 CTMS 中的现有记录或创建新记录。如果 CTMS 中缺少匹配的访视组定义或访视定义,会生成用户异常消息。
此功能对 EDC 用户体验没有影响,不能在 EDC 中测试。在 CTMS 端,此功能使 Veeva CTMS 能够显示“访视组定义 - 访视定义”关系。
启用和配置
在 EDC 中,对于使用 Clinical Operations - EDC 连接的研究,此功能会自动启用。在 CTMS 中,必须激活新的集成点才能启用该功能。
Clinical Operations-EDC 连接:将收尾 PDF 文件传输到 Veeva Clinical Operations
用例
此自动化流程简化了将收尾 PDF 传输到 Veeva eTMF 和研究中心进行存档的过程,不仅减少了传输单个文档所需的手动工作,还自动将详细 PDF 作为每个受试者的一个文档在 Veeva eTMF 中进行存储和更新。
说明
研究中关闭研究中心时,Veeva EDC 允许为该研究中心的每个受试者生成包含详细 PDF 的收尾 PDF。以前,收尾 PDF 只能从 Veeva EDC 下载进行归档。在此版本中,收尾 PDF 还可以通过 Clinical Operations - EDC 连接自动传输到 Veeva eTMF,并通过 SiteConnect 与研究中心共享。在 Veeva EDC 中重新生成收尾 PDF 将通过 Clinical Operations - EDC 连接自动更新 Veeva eTMF 中的相关文档。
一旦为 Clinical Operations - EDC 连接配置了此功能,为使用该连接的研究生成的每个收尾 PDF 都将自动传输到 Veeva eTMF。详细 PDF 将按照配置被 Veeva eTMF 作为单个文档接收。如果收尾 PDF 生成失败(例如,对没有受试者的研究中心执行研究中心收尾),则不会传输任何 PDF。
作为“EDC 工具”>“研究设置”中此实现的一部分,以下字段的标签已更新:
- “连接到 Vault CTMS”改为“连接到 Clinical Operations Vault”
- “CTMS 研究链接 ID”改为“Clinical Operations 研究链接 ID”。
此功能对 EDC 用户体验没有影响,不能在 EDC 中测试。必须在 Veeva Clinical Operations 中追踪适当的收尾 PDF 传输。
启用和配置
对于使用 Clinical Operations – EDC 连接的研究,此功能会自动启用。该功能需要在 Veeva Clinical Operations 中进行配置。
了解详情
EDC API
EDC API 的新功能如下。请参阅我们的开发者门户的发行说明,了解更详细的功能信息。
EDC API 功能
该版本为 EDC 开发者提供了以下功能:
- 所有端点的研究国家/地区为可选
- 支持 S3 连接和编码审计跟踪的作业启动
- 由许可和计费状态控制的病例手册创建
临床数据库(CDB)和 EDC 临床报告
以下是 Veeva CDB 应用程序和/或 EDC 临床报告(即用于数据清理和报告的 Veeva Clinical Data 解决方法)的新功能。
可用性:临床数据库(CDB)仅对 CDB 许可证持有者提供。请联系 Veeva 服务代表了解详细信息。
SFF API 列名称去重
用例
SFF API 中的重复列名可能会给下游系统带来问题。
说明
使用研究文件格式(SFF)API 时,如果多个列具有相同的定义名称,系统会为每个重复列附加“_n”(从 n = 1 开始)。第一列将保留原始名称,后续每列都会使用附加的后缀进行更新。清单文件已更新,以反映这种新的命名约定。
SFF 的 API 版本控制和数据包版本控制将分开。在 25R2 版本中,所有提取都将生成新的数据包版本 2.0。
启用和配置
版本发布时,此功能将自动可用。
了解详情
CDB 自动分表功能
用例
这是一种自我修复操作,以前需要提交支持工单由 Veeva 处理。
说明
大型研究设计或第三方数据导入包可能会因存储数据所需的表过大而导致摄取失败。CDB 会自动拆分这些表,但如果拆分后的表仍然过大,就需要减小拆分大小以处理所需的大量列。此版本启用了一个自动流程:如果因数据设计导致摄取失败,系统会重试摄取,并在每个部分表中使用更少的列,从而无需提交 Veeva 支持工单即可完成摄取。
启用和配置
版本发布时,此功能将自动可用。
第三方数据的代码列表支持
用例
在清单中定义代码列表的代码和解码有助于更好地控制第三方数据集或 OpenEDC 研究中的报告值,还支持代码列表数据值的转换。
说明
现在可以在清单文件中定义来源的代码列表,确保报告的数据与该代码列表中允许值的定义一致,并将输入的数据从编码转换为解码。
启用和配置
版本发布时,此功能将自动可用。
增强了有条件揭盲规则
用例
为支持更复杂的揭盲数据规则,我们为有条件揭盲规则添加了额外的运算符
说明
文本和数字条目(整数、浮点数)的有条件揭盲规则现在支持 IN 和 NOT IN 运算符。这使得规则可以轻松检查某个条目的值是否匹配(或不匹配)单个逗号分隔列表中的任何值。此增强功能克服了以前的限制,即规则最多可以组合六(6)个不同的条件或条件组,因为现在一个 IN 或 NOT IN 条件可以同时高效地测试多个值。
启用和配置
版本发布时,此功能将自动可用。
启用更改:SYS 列表中的已计算字段
用例
这些字段提供 SDE 中可用的数据,可原生包含在 CDB 中以用于导出。
说明
此版本中,“SYS 列表中的计算字段”功能(25R1)现在自动对所有客户启用。在此之前,该功能需要通过 Veeva 支持团队启用。
启用后,这些字段会自动应用。这不会导致对现有导出定义 进行更改检测。
有关更多信息,请参阅“SYS 列表中的计算字段”发行说明。
启用和配置
版本发布时,此功能将自动可用。
导出:在原始核心列表中添加了新列
用例
额外的实验室和编码数据为标准导出提供了更多详细信息。
说明
使用原始导出类型时,标准导出现在包含实验室修改器和药物代码。例如,实验室修改器提供实验室值的大于或小于等修改器。在使用 WHODrug 词典进行医学编码的表单中,药物代码显示为 DrugCD。这些更改将在现有导出的更改检测中突出显示。
启用和配置
版本发布时,此功能将自动可用。
了解详情
手动刷新非生产审查列表
用例
为减少不需要持续刷新的测试研究的系统处理量,我们移除了每小时运行一次以刷新审查列表的作业。相反,用户可以在非生产研究环境中按需刷新列表。
说明
此版本在非生产研究环境的审查列表中引入了新的“刷新(Refresh)”选项,允许研究构建者和测试人员按需刷新列表。这将减轻系统持续运行不必要的每小时作业的负担,并加快测试人员和研究程序员按需刷新列表的处理时间,而无需等待队列处理列表。
此版本中,CDB 在非生产研究中不再每 24 小时重新处理第三方数据。
启用和配置
版本发布时,此功能将自动可用。
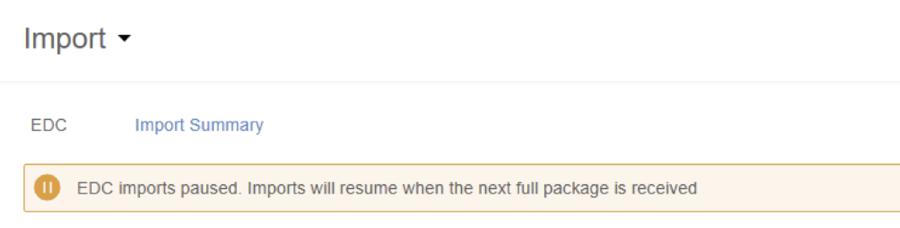
增量摄取横幅已暂停
用例
在临床报告和 CDB 工作台中,当增量摄取暂停时,新横幅能提高其可见性。
说明
当因研究设计更改或意外的加载错误导致增量摄取(每 15 分钟从 Veeva EDC 向研究更新数据)暂停时,CDB 的“导入(Import)”页面会显示一条横幅。
启用和配置
版本发布时,此功能将自动可用。
第三方数据导入增强功能
用例
这些对第三方数据(3PD)处理的增强提高了 CDB 工作台的易用性。
说明
此版本包含 CDB 工作台中第三方数据导入的两项增强:
- 对于 Open EDC 研究,当 3PD 源的第一个数据包加载失败时,CDB 不再阻止该研究中其他任何来源的数据导入。
- 清单生成器 JSON 将以更易于人类阅读的格式导出。
启用和配置
这些增强功能在版本发布时自动可用。
导出 API:运行和导出现有定义的角色更新
用例
API 导出在启动导出作业和检索文件方面提供了更大的灵活性。
说明
为 CDB 工作台和临床报告创建了新的 API 调用。这些调用允许用户通过 API 检索研究信息以及运行和检索导出定义。在开发者门户中了解更多关于这些新 API 调用的信息。
CDB API 读写标准角色(供拥有 CDB 工作台的客户使用)已更新,包括以下权限:
- 查看导出
- 查看导出数据包
- 生成导出数据包
- 创建导出定义
- 临床报告选项卡
启用和配置
这些新 API 以及自动分配给 CDB API 读写角色的权限更新在版本发布后可用。
CDB:数据更改后保持审查
用例
此功能使数据管理员能够知道审查列表行中的数据在其审查状态设置后是否已更改,同时保留最新的审查状态和评论。
说明
一旦审查列表中的某一行设置了审查状态,如果数据发生更改,将显示一个增量图标(Δ)。然后,用户可以忽略该增量,保留现有的状态和评论,或者根据需要更新状态。审查信息板上的新列也将显示这些增量变化,显示有更改的行数。有更改的审查列表在审查信息板和患者清理跟踪器中会被视为未完成。
包含在导出中的审查列表将包含一个新列,用于表示先前审查过的行中的数据是否已更改。
启用和配置
版本发布时,此功能将自动可用。
了解详情
观察功能增强
用例
这些增强功能允许将用户分配到观察、新的核心观察列表以及观察 CQL 语法。
说明
拥有查看所有列表(View All Listings)和查看观察(View Observations)权限的用户可以被分配到观察中。这有助于跟踪多个审查,促进同事之间关于数据条目的问题交流,或支持数据审查方面的其他形式协作。
与查询列表类似,现在有了新的核心观察列表,包括核心列表和观察消息。在每个核心列表中,可以对观察进行筛选和排序,对其执行操作,并导航到创建观察的数据列表。这些核心列表可以下载和/或包含在导出定义中。
现在可以在自定义列表中使用 @OBS 和 @OBSMSG CQL 语法。与 @QRY 语法一样,可以将观察语法与研究标题数据结合使用,但不能与特定于表单的数据结合使用。数据列表中的观察摘要链接可用。这些链接将用户导航到“所有观察”列表,并筛选显示从该列表创建的观察。
数据列表中的查询摘要链接也可用。这些链接将用户导航到“所有查询”列表,并筛选显示从该列表生成的查询。
启用和配置
对于拥有观察权限(查看、创建、回复和关闭)的用户,这些功能自动可用。
了解详情
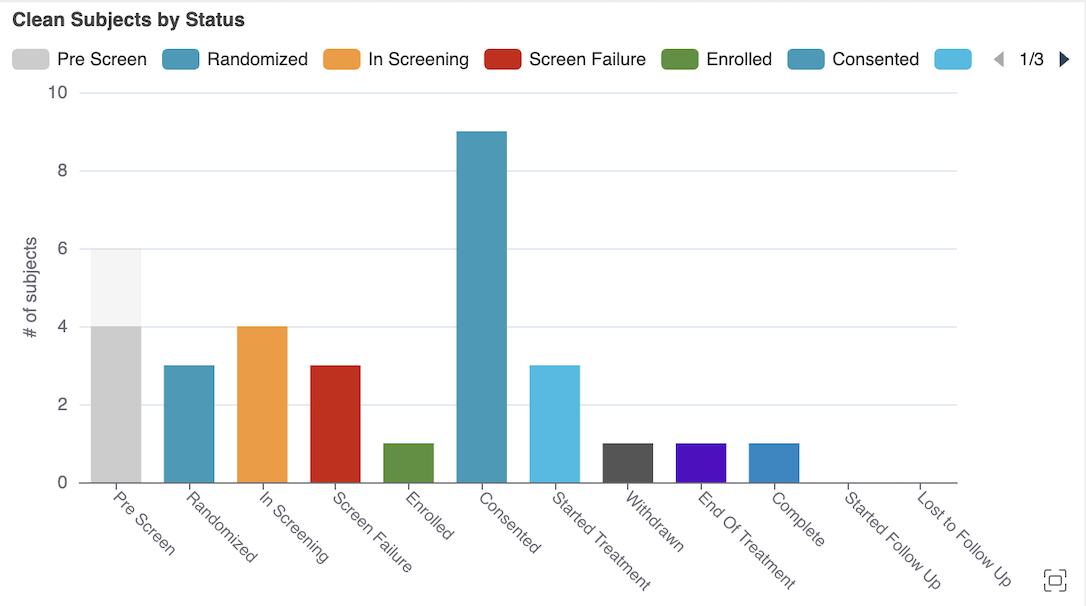
CDB 患者清理跟踪器研究中心和受试者图表
用例
CDB 工作台中患者清理跟踪器(“受试者(Subject)”页面)中的新图表以更易于访问和理解的方式展示了仍需数据清理和数据录入逾期的病例手册。这些图表提供了高级概述,让数据管理员了解并沟通数据清理状态以及研究中心的任何数据录入逾期情况。
说明
患者清理跟踪器中的两个新图表显示了研究中病例手册的数据清理和数据录入信息。一个气泡图显示了数据录入逾期与仍需数据清理之间的关系。第二个图表是条形图,按状态显示受试者数量及其清理状态。
启用和配置
版本发布时,此功能将自动可用。
了解详情
CDB 快速查询
用例
快速查询为数据管理员和研究中心提供了一种简洁且自动化的方式来提供标准化的查询消息。这大大减少了用户在更新数据以及创建和回答查询时所需的击键次数。
说明
与 Veeva EDC 中的更新类似,CDB 工作台现在支持创建快速查询,这是一种表示某个查询是否旨在确认所输入的值的简单方式。这为研究中心用户提供了简单的回复选项,同时也保留了包含自定义消息的能力。单个和批量查询创建都支持快速查询选项,CDB 检查也支持。
我们已更新“所有查询消息(All Query Messages)”和“EDC 查询消息(EDC Query Messages)”列表,增加了新列,显示查询是否是使用快速查询创建的。
启用和配置
当在工作室中启用研究配置时,此功能可用。
了解详情
CDB API
以下是 CDB API 的新功能。请参阅我们的开发者门户的发行说明,了解更详细的功能信息。
CDB API 功能
该版本为 CDB 开发者提供了以下功能:
- 研究文件格式(SFF)API 更新:CSV 列去重
- 导出 API:运行和导出现有定义
EDC 迁移器
本部分中的功能是针对 Veeva EDC 迁移器的新功能。
“迁移 Vault”已重命名为“Veeva EDC 迁移器”
用例
为求简洁明了,我们更新了系统名称。此更改还确保了 Veeva 应用程序之间的一致性,并与 25R1 版本的“名称和徽标更改”功能保持一致。
说明
迁移 Vault 系统徽标将更新为显示名称“Veeva EDC 迁移器”。
启用和配置
版本发布时,此功能将自动可用。
自动执行“更新过期的正常范围”作业
用例
在研究迁移期间,任何影响实验室正常范围的更改(例如重新计算缺失受试者的年龄)以前都需要手动运行“更新过期的正常范围”作业。此版本将自动执行这一步骤。
说明
现在有了重新计算缺失受试者年龄并运行“更新过期的正常范围”作业的新功能,无需手动干预这些任务。
启用和配置
此功能对新迁移立即可用。
YAML 生成器和映射增强功能
用例
这些更新提高了 YAML 生成器及其文件的清晰度,并最大限度地减少了手动映射的需求。
说明
此版本包含多项增强功能:
-
单位条目定义:迁移 Vault 现在支持在表单的 YAML 中映射单位条目定义并发送条目单位数据。
-
实验室代码列表值映射:在 25R2 版本之前,实验室代码列表需要手动映射。在此版本中,YAML 生成器现在支持这些条目的映射。
-
重命名日志事件的 YAML 文件:以前,YAML 生成器创建的文件名为 events_unscheduled.yaml,现在将更名为 events_log.yaml。
-
YAML 生成器:在数据源(Data Source)选项中,“CDMS”已重命名为“Veeva”。
启用和配置
这些更新立即可用。