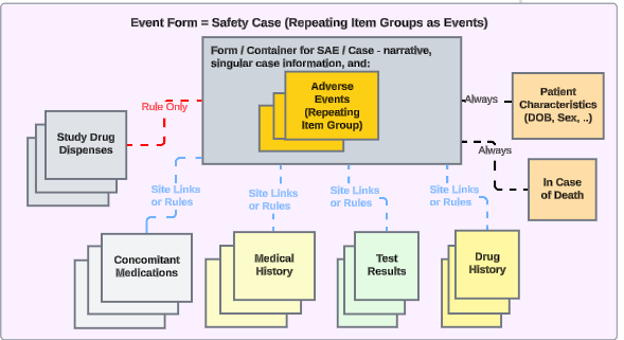
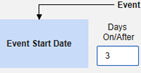
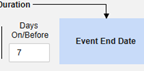
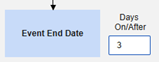
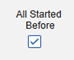
Safety-EDC Connection 스터디 구성
Veeva EDC와 Veeva Safety 간의 안전성 연동은 Veeva Vault 플랫폼의 독점 통신 교환을 기반으로 합니다. 적절하게 연동을 구성하면 모든 필수적 및 보완적 안전성 관련 EDC 데이터가 안전성 사례로 안전성 시스템으로 전송됩니다. 전송을 유발할 수 있는 예로는 임상 시험에서 심각한 이상 사례, 특별 관심 이상 사례, 예상하지 못한 임신 등이 있습니다.
스터디 디자인에 대한 연동 설정을 통해 사이트에서 안전성 사례 시작 기준을 충족하는 이벤트를 생성할 때마다, Veeva EDC는 자동으로 첫 번째 전송을 생성하고 데이터를 안전성 시스템으로 전송합니다.
해당 위치를 다음 안전성 데이터 유형 중 하나로 분류하여 안전성 사례에 관련 데이터를 삽입할 수도 있습니다.
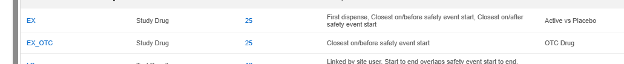
- 스터디 약물(제품 또는 임상 시험에서 테스트 중인 제품)
- Concomitant Medications
- Medical History
- 약물력
- 시험 결과
- 환자 특성
- 사망 시
안전성 사례 시작 또는 관련 데이터가 업데이트되면 주어진 시간 간격 내에 안전성 시스템으로 전송될 팔로우업 전송이 자동으로 생성됩니다.
스터디 설계자는 EDC 스터디 디자인 아이템을 적절한 Veeva Safety 위치에 매핑하여 이 연동을 구성합니다. 매핑된 사례집 요소를 안전성 사례에 포함시키는 것은 구성된 포함 규칙에 따라 추가로 달라지며, 이때 대상자의 모든 사례집 폼, 사이트에서 안전성 사례 시작 폼에 링크한 항목 또는 시작 이벤트와 관련하여 선택한 날짜 범위에 속하는 항목에 매핑된 아이템을 포함할 수 있는 옵션을 활용할 수 있습니다.
안전성 사례는 단일 이벤트로 인해 생성되거나 여러 이벤트로 구성될 수 있습니다. 이때 사이트 연결 및/또는 날짜 기준 포함 규칙을 사용하여 구성됩니다.
안전성 연동은 초기 전송을 시작한 기준이 더 이상 사실이 아닌 경우 발생하는 무효화도 지원합니다. 예를 들면 폼 재설정(잘못된 입력) 또는 이벤트 다운그레이드가 있습니다.
Safety-EDC Connection과 E2B Link의 주요 차별화 요소:
- Safety-EDC Connection은 각 전송 시 원격 시스템의 승인 파일을 기다리지 않습니다. 대신 Vault Safety(받은 편지함)에 도착하면 사례에 대한 추가 승격에 관계없이 Veeva EDC에 기록됩니다. 나중에 정상적인 분류 프로세스를 통해 공식 안전성 사례로 승격되면 사례 위치가 Veeva EDC에 기록됩니다.
- 안전성 사례의 일부로 전송된 실제 데이터 외에도, 표준 안전성 데이터 유형에 매핑된 임상 시험 참가자의 모든 안전성 관련 데이터는 첫 번째 안전성 이벤트가 발생하면 Veeva Safety로 전송됩니다. 이 데이터는 Veeva Safety에서 안전성 사례 처리에 필요한 경우 추가 대상자 정보로 표시할 수 있습니다. EDC의 데이터를 변경하면 Veeva Safety의 안전성 사례 데이터와 추가 대상자 정보가 모두 업데이트됩니다. "사례 내" 데이터 변경은 팔로우업 받은 편지함 아이템을 생성하지만, 추가 대상자 정보에 대한 업데이트는 사례를 변경하지 않고 백그라운드에서 수행됩니다. Veeva Safety 사용자는 Veeva Safety의 추가 대상자 정보 사용자 인터페이스를 통해 표준 안전성 데이터 유형 '사례 외'에 매핑된 모든 항목에 쉽게 접근할 수 있으며, 의학적 결정에 따라 콘텐츠를 선택/선택 취소할 수 있습니다. 이때 해당 시스템을 떠날 필요가 없으며, 결과적으로 Veeva EDC의 팔로우업 전송에서 반영됩니다.
- Veeva Safety의 작업은 Veeva EDC로 다시 전달됩니다. 특히 사이트와 CRA에 표시할 사례 상태와 Veeva Safety에서 내린 안전성 결정을 포함합니다. Veeva Safety에서 추가 대상자 정보는 간단한 선택으로 안전성 사례에 추가할 수 있습니다. 마찬가지로, 사례에서 대상자 정보를 제거할 수도 있습니다. 또 다른 시나리오에서는 Veeva EDC에서 전송된 안전성 사례에 여러 이벤트가 포함될 수 있으며, 이 사례가 Safety 측에서 개별 사례로 분할되거나 개별 안전성 사례가 하나로 병합될 수 있습니다. Veeva EDC는 이제 Veeva Safety에서 내린 결정을 알고 있습니다. EDC 임상 데이터 및 사이트 연결 결정은 변경되지 않지만 추가, 제거, 분할 또는 병합에 대해 Veeva Safety에서 내린 결정은 다음 팔로우업 전송을 컴파일할 때 준수됩니다.
안전성 관리자는 첫 번째 전송 시기와 팔로우업 빈도, 연동을 위한 기타 운영 설정을 설정합니다. 자세한 내용은 안전성 연동 관리의 안전성 설정을 참조하십시오.
사전 구성 요소
Vault 소유자 보안 프로필이 있는 사용자는 Veeva EDC와 Veeva Safety 간에 연결을 생성해야 합니다.
표준 CDMS Study Designer(CDMS 스터디 설계자) 또는 CDMS Librarian(CDMS 라이브러리 관리자) 스터디 역할이 있는 사용자는 안전성 구성을 보고 편집할 수 있습니다. 조직에서 커스텀 스터디 역할을 사용하는 경우, 역할에서 다음 권한을 부여해야 합니다.
| 유형(Type) | 권한 레이블 | 제어 |
|---|---|---|
| 표준 탭 | Studio 탭 | Studio 탭에 접근할 수 있는 기능 |
| 표준 탭 | 라이브러리 탭 | 라이브러리(Library) 탭에 접근할 수 있는 기능 |
| 기능적 권한 | 스터디 디자인 보기 | 스터디 디자인에 대한 보기 전용 접근권한 |
| 기능적 권한 | 스터디 디자인 | Studio에서 스터디 디자인 정의 및 스터디 일정을 생성할 수 있는 기능 |
| 기능적 권한 | 안전성 구성 관리(Manage Safety Configuration) | 스터디의 안전성 연동에 대해 설계하고 구성할 수 있는 기능. 여기에는 관련된 폼, 해당 폼에서 안전성 시스템으로 전송되는 아이템, 안전성 사례에서 폼 데이터를 포함하거나 제외할 시기를 나타내는 포함 기준을 결정하는 것이 포함됩니다. |
| 기능적 권한 | 라이브러리 보기 | Studio > 라이브러리에서 라이브러리 수집 및 설계를 볼 수 있는 기능 |
| 기능적 권한 | 라이브러리 설계 | Studio > 라이브러리에서 수집 스터디 디자인 정의와 스터디 일정을 생성할 수 있는 기능 |
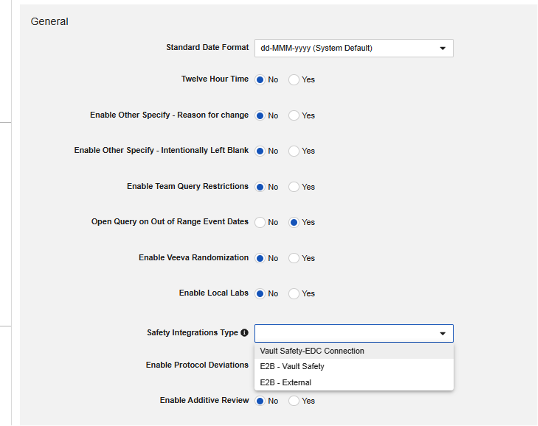
안전성 연동 유형
Veeva EDC에 대한 안전성 연동을 구성하는 첫 번째 단계는 스터디 설정의 안전성 연동 유형 값입니다.
-
저장을 클릭합니다.
안전성 연동 유형(Safety Integrations Type) 설정은 공백 외의 값이 있는 경우 읽기 전용이 됩니다. 이는 E2B 링크와 비교했을 때 Safety-EDC Connection 스타일 연동이 지닌 특성 때문입니다. 둘 사이를 전환해야 하는 경우 Veeva 담당자에게 지원 및 계획에 대해 문의하십시오.
E2B를 사용한 안전성 연동에 대한 자세한 내용은 E2B 스터디 구성을 참조하십시오.
전체 연동 유형을 저장하면 Studio 탐색 메뉴에 안전성 설정(Safety Settings) 및 폼 구성(Form Configurations)이라는 추가 옵션이 나타납니다.
안전성 설정
설정 업데이트
스터디 디자인에 대한 기본 안전성 설정을 지정하는 방법은 다음과 같습니다.
- 스터디의 Studio >안전성 설정으로 이동합니다.
- 편집을 클릭합니다.
- 원하는 대로 변경합니다. 아래 표에는 사용 가능한 사례 설정이 나와 있습니다.
- 저장을 클릭합니다.
사용 가능한 설정
다음과 같은 설정을 사용할 수 있습니다.
| 설정 | 기본값 | 선택 |
|---|---|---|
| 대상자 ID 위치 | 환자 이름 또는 이니셜 | 현재 스터디에 대해 Veeva EDC 대상자 ID가 전송될 위치를 선택합니다.
|
| 대상자 ID 형식 | 대상자 전용 | 다음 중에서 대상자 ID의 형식을 선택합니다.
|
| 기본 원본 자격 값 | 의사 | 분류는 안전성 사례의 각 이상 사례와 관련하여 스터디 약물이나 치료를 평가하는 사용자의 분류입니다. 다음 분류 유형에서 선택할 수 있습니다.
|
| ConMed 의심 스터디 약물 분류 | 항상 의심 | 이 설정은 데이터 입력 사용자가 병용약물(Concomitant Medications)로 분류된 폼을 안전성 사례 시작 이벤트(Safety Case Initiation Event)에 연결하고 기본 분류인 "병용"을 오버라이드할 수 있도록 스터디가 구성된 경우에만 적용됩니다.
|
| 스터디 이름 값 | 선택 사항: 전송에 사용할 스터디 이름을 정의할 수 있습니다. 공백으로 남겨 두면 Vault는 스터디 레이블을 보냅니다. |
|
| 의뢰자 스터디 번호 값 | 선택 사항: 전송에 사용할 의뢰자 스터디 번호를 정의할 수 있습니다. 공백으로 남겨 두면 Vault는 스터디 레이블을 보냅니다. |
|
| 스터디 유형 | 임상 시험 | 다음 옵션에서 반응의 스터디 유형(C.5.4)을 선택합니다.
|
| 보고자 | 전체 사이트 정보 | 안전성 사례의 보고자 필드 값입니다. 보고자 위치는 Veeva EDC의 사이트에 정의된 정보를 기반으로 채워집니다. 다음 옵션 중 선택합니다.
|
| 코딩용 NullFlavor | 코딩에 대한 null 값을 처리하는 방법을 선택합니다(MedDRA 코딩 값이 없는 경우). 이 설정은 폼이 코딩을 위해 활성화되어 있고, 사용자가 안전성 전송을 위한 위치를 할당한 Veeva EDC 스터디 디자인의 위치에만 적용됩니다. 다음 옵션 중 선택합니다.
연결에 대한 코딩은 안전성 데이터 유형별로 다음 각 위치에 있습니다.
참고: 위의 각 항목에 대한 탠덤 필드를 매핑할 필요는 없습니다(각각 안전성 필드 목록 아래에 있으며 "... (Coding LLT)"로 표시). 이러한 매핑 행은 특별한 경우에만 사용됩니다. 자세한 내용은 이 참조 자료의 뒷부분에 있는 관련 아이템 구성 섹션을 참조하십시오. |
|
| 음소거 코딩 팔로우업 | No | 이 설정을 예로 설정하면, Veeva EDC에서 코딩된 의료 용어(이벤트, 병력, 사망 원인)에 새 코드 또는 다른 코드를 할당하는 것이 유일한 변경 사항일 때 Vault에서 팔로우업을 전송하지 않습니다. 안전성 사례의 일부인 데이터에 대한 다른 변경 사항은 여전히 팔로우업 전송을 시작합니다. 아니요로 설정하면, Veeva EDC는 의학 용어 코딩 변경 사항을 포함하여 안전성 사례의 일부인 데이터 변경 사항에 대해 안전성 사례 팔로우업을 전송합니다. 주로 안전성 시스템에서 코딩을 수행하는 경우 이 옵션을 예로 설정하여 안전성 시스템의 코딩 할당 변경 사항에 대한 불필요한 팔로우업을 방지하는 것이 좋습니다. |
| 날짜 시간 값 동작 | 스크린 / 입력값 사용 | EDC 폼의 날짜 시간 필드에 대해 안전성 데이터를 구성할 때 이 옵션은 보낼 값을 나타냅니다. 스크린/입력 값 사용) 중에서 선택하여 사이트에서 입력한 값을 사용하거나, 정규화(UTC) 값 사용을 선택하여 UTC(스크린 값을 오프셋한 사이트 시간대 사용)로 정규화된 날짜 시간을 사용할 수 있습니다. |
| 현지 실험실 테스트에 대한 SAE 시작 전 일수 | 이 설정은 스터디가 로컬 실험실 모듈(Studio의 스터디 설정에서 활성화)을 사용하는 경우에만 적용됩니다. 안전성 사례 시작 이벤트가 실험실 테스트를 검색하는 시작 날짜 전 일수를 입력합니다. 이 값을 설정하면, 로컬 실험실 테스트(모든 폼)를 검색하고 검토를 위해 테스트를 안전성 시스템으로 전송해야 함을 의미합니다. 이러한 테스트는 전송 시 어떤 사례에서도 나타나지 않으며, 대신 특정 사례에 포함하기 위한 의료 결정을 위해 검토됩니다. 이 필드에는 0에서 21 사이의 숫자 값(일수)을 입력할 수 있습니다. |
|
| 현지 실험실 테스트에 대한 SAE 시작 후 일수 | 이 설정은 스터디가 로컬 실험실 모듈(Studio의 스터디 설정에서 활성화)을 사용하는 경우에만 적용됩니다. 안전성 사례 시작 이벤트가 실험실 테스트를 검색하는 시작 날짜 후 일수를 입력합니다. 이 값을 설정하면, 로컬 실험실 테스트(모든 폼)를 검색하고 검토를 위해 테스트를 안전성 시스템으로 전송해야 함을 의미합니다. 이러한 테스트는 전송 시 어떤 사례에서도 나타나지 않으며, 대신 특정 사례에 포함하기 위한 의료 결정을 위해 검토됩니다. 이 필드에는 0에서 7 사이의 숫자 값(일수)을 입력할 수 있습니다. |
|
| 의학적으로 확인됨으로 자동 설정 | No | 이 설정은 안전성 사례에, 그리고 Veeva EDC가 전송하는 모든 사례에 "의료 전문가의 의학적 확인"을 포함할지 여부를 결정합니다. 예를 선택하여 포함합니다. 아니요를 선택하면 전송에서 값이 생략됩니다. 가장 일반적인 사용 형태는 예인데, 안전성 사례가 임상 사이트/연구자에게서 시작되기 때문입니다. |
| 사례에 2차 이벤트 사이트 링크 포함 | Yes | 이 설정에서 예를 사용하면 1차 안전성 사례 시작 이벤트뿐만 아니라 사례의 2차 이벤트에 연결된 관련 데이터도 포함됩니다. |
폼 구성
기본 안전성 설정을 업데이트한 후, 다음 단계는 스터디 디자인에서 안전성 연동에 참여할 폼을 구성하는 것입니다. 이는 Studio > 폼 구성에서 설정합니다.
안전성 설정을 구성한 후에만 + 새 폼 구성(+ New Form Configuration) 버튼이 활성화됩니다.
심각한 이상 사례(안전성 사례 시작 이벤트) 폼과 데이터를 안전성 시스템으로 전송할 다른 폼에 대해 폼 구성을 생성해야 합니다. Studio > 폼에서 폼 구성을 생성합니다.
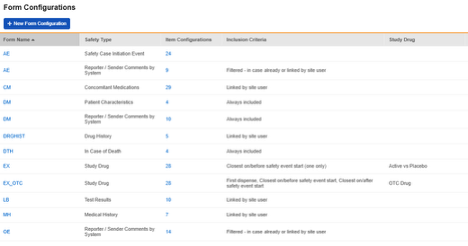
구성된 폼의 스터디 요약 목록의 예:
각 폼 구성에는 다음 세 가지 단계가 있습니다.
- 폼 속성: 안전성 데이터 유형과 키 아이템이 포함된 폼 속성을 정의합니다.
- 아이템 구성: 해당 아이템에 안전성 필드를 매핑합니다.
- 포함 기준: 안전성 시스템으로 보내기에 포함된 폼 데이터를 결정하고 Vault에서 사용할 포함 기준을 정의합니다.
안전성 데이터 유형
안전성 연동을 위해 구성된 각 폼에는 안전성 데이터 유형(Safety Data Type)이 포함되어 있습니다. 이러한 유형은 안전성 시스템의 표준 데이터 모델/유형을 나타냅니다.
Veeva EDC의 안전성 구성 유형은 다음과 같이 요약됩니다. E2B 형식(R3)에 익숙한 사용자를 위해 관련 섹션이 표시되어 있습니다.
| EDC 유형 | 관련 E2B(R3) 위치 | Veeva Safety | 메모 |
|---|---|---|---|
| 안전성 사례 시작 이벤트 | E.* | Adverse Events | 이 유형의 폼(이전의 심각한 이상 사례)은 안전성 사례의 전송을 시작합니다. 이전에 전송한 사례가 더 이상 초기 전송 기준을 충족하지 않는 경우 사례는 무효화됩니다. 안전성 사례에는 구성된 포함 기준에 따라 기본 이벤트 또는 여러 다른 이벤트 폼, 심각하지 않은 이벤트의 데이터만 포함될 수 있습니다. 안전성 시스템 및 안전성 사례에서는 이를 이벤트라고 합니다. |
| 스터디 약물 | G.* | 제품 / 제품 투여량 | 스터디에서 스터디 약물 또는 제품의 조제를 추적하는 각 EDC 폼에 이 유형을 사용합니다. 안전성 시스템에서는 이를 제품이라고 하며, 그 안에는 하나 이상의 조제/투여량이 그룹화되어 있습니다. 스터디 약물에 대한 포함 기준에 따라 EDC는 사례의 이벤트과 관련하여 스터디 약물 조제를 포함합니다. 사이트 사용자 작업과 관계없이 관련 스터디 약물 조제 발생을 포괄적으로 전송할 수 있도록, 중요한 스터디 약물 조제에 대한 사이트 연결은 지원되지 않습니다. |
| Concomitant Medications | G.* | 제품 / 제품 투여량 | 이 폼은 스터디 임상시험계획서의 일부가 아닐 수도 있는 대상자에게 제공된 다른 약물 또는 제품을 추적합니다. 안전성 시스템 및 사례에서는 이 역시 제품이라고 하며, 그 안에는 하나 이상의 조제/투여량이 그룹화되어 있습니다. |
| Medical History | D.7.* | 병력 및 동반 질환 | 이 폼은 일반적으로 스터디에 참여하기 전에 발생한 대상자의 과거 질환이나 시술을 추적합니다. |
| 약물력 | D.8.* | 약물력 | 이 폼은 일반적으로 스터디에 참여하기 전에 발생한 대상자의 과거 약물 사용을 추적합니다. |
| 시험 결과 | F.* | 시험 결과 | 이 폼은 대상자가 경험하고 있는 이벤트와 관련이 있는 것으로 간주되는 특정 실험실 및 진단 결과를 추적합니다. |
| 환자 특성 | D.1~D.6 | 환자 | 이 폼은 생년월일이나 성별과 같은 대상자의 일반적인 특성을 추적합니다. |
| 사망 시 | D.9.* | 환자 또는 사망 원인 | 이 폼은 대상자가 사망한 경우에 보고된 사망 날짜 또는 사망 원인과 같은 관련 정보를 추적합니다. |
폼 구성을 생성하는 방법
새 폼 구성을 생성하는 방법은 다음과 같습니다.
- 스터디의 Studio > 형식 구성으로 이동합니다.
- 완료되면 저장하고 닫기(Save and Close)를 클릭합니다.
누락된 버튼: 필요한 권한이 있지만 + 새 폼 구성(+ New Form Configuration) 버튼이 표시되지 않는 경우, 먼저 안전성 설정이 저장되었는지 확인합니다.
폼 속성(Form Properties), 아이템 구성(Item Configurations) 및 포함 기준(Inclusion Criteria)에 대한 옵션은 이 문서의 뒷부분에서 안전성 유형별로 자세히 설명됩니다.
각 단계에서 저장(Save) 버튼은 다음 단계로 진행하지 않고 해당 정보를 저장하기만 합니다. 저장 및 다음 버튼은 정보를 저장하고 다음 단계로 이동합니다.
폼 구성 삭제
단일 폼 구성을 삭제하거나 모든 폼 구성을 한 번에 삭제하여 재시작할 수 있습니다. 폼 구성과 연결된 안전성 사례가 있는 경우 Vault에서 삭제 옵션을 비활성화합니다.
단일 폼 구성을 제거하려면
- 스터디의 Studio > 형식 구성으로 이동합니다.
- 폼 구성 이름 위로 마우스를 가져가면 작업 메뉴가 표시됩니다.
- 삭제를 선택합니다.
- 확인 대화 상자에서 삭제를 클릭합니다.
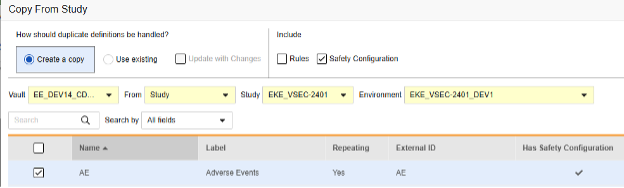
폼 구성 복사
현재 릴리스에서 안전성 폼 구성 정보를 복사하는 유일한 방법은 폼 복사를 사용하는 것입니다. 다른 복사 수준인 이벤트 그룹 복사와 이벤트 복사는 폼 수준 안전성 구성의 복사를 지원하지 않습니다.
이벤트 그룹 또는 이벤트가 소스 라이브러리/스터디에서 복사되고(안에 폼이 있는 상태) 해당 폼에 안전성 폼 구성 정보가 포함되어 있는 경우, 후속 작업으로 기존 항목 사용/변경 사항으로 업데이트(Use Existing / Update with Changes) 옵션과 함께 폼 복사를 사용하면 됩니다.
폼의 핵심 복사를 수행하는 동안 안전성 폼 구성을 복사하는 것은 선택 사항입니다.
포함(Include) 섹션에서 안전성 구성(Safety Configuration)을 선택하여 이전에 구성된 구성을 복사해야 합니다.
복사하는 동안 기존 안전성 구성을 가져오는 시나리오:
-
나중에 복사: 이전에 폼에서 이벤트 그룹 복사(Copy Event Groups) 또는 이벤트 복사(Copy Events)를 통해 복사했거나 처음에 안전성 구성이 포함되지 않은 상태로 폼 복사(Copy Forms)를 사용한 경우에 수행됩니다. 변경 사항으로 업데이트를 선택해야 합니다. 이 시퀀스는 폼 조정 시 "적합한 항목"을 복사합니다. 여기서 AE 폼은 대상 스터디에 이미 존재합니다.
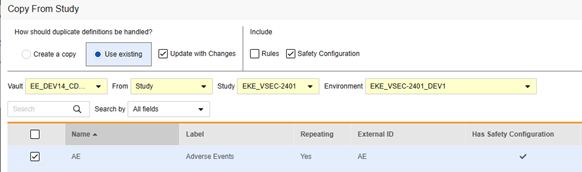
폼에 대한 안전성 구성을 복사하는 방법은 다음과 같습니다.
- Studio > 폼으로 이동합니다.
- 스터디에서 복사를 클릭합니다.
- 복사본 생성(Create a copy) 또는 기존 항목 사용/변경 사항으로 업데이트를 적절하게 선택합니다(위의 예 참조).
- 안전성 구성 확인란을 선택하면 폼과 연결된 안전성 구성도 복사합니다. Vault는 대화 상자의 안전성 구성 있음 열에 폼의 안전성 구성이 있는지를 나타냅니다. 이 작업에는 안전성 구성 관리 권한이 있는 스터디 역할이 필요합니다. 원본 스터디와 대상 스터디가 안전성 구성과 관련하여 일치하지 않는 경우 안전성 구성 확인란이 비활성화됩니다. 둘 다 설정되어 있어야 하며, 동일한 안전성 연동 유형을 사용해야 합니다.
- Vault를 선택합니다.
- 스터디에서 복사의 경우 복사할 위치(다른 스터디에서 또는 라이브러리에서)를 선택합니다.
- 복사할 스터디 환경을 선택합니다.
- 복사할 폼 정의를 검색하거나 스크롤하여 찾습니다.
- 복사할 폼을 선택합니다.
- 폼 복사를 클릭합니다. Vault는 폼 정의를 스터디로 복사하기 시작합니다.
- 선택 사항: 스터디에서 복사 대화 상자에서 다음 작업을 수행합니다.
- 요약 보기를 클릭하여 복사된 폼 목록과 복사본 상태를 확인합니다.
- 복사한 폼이 20개 이하인 경우, 로그 보기를 클릭하여 복사된 각 오브젝트 레코드에 대한 상태 세부 정보를 확인합니다.
- 복사한 폼이 20개를 넘는 경우, 완료되면 Vault에서 로그 파일을 다운로드할 수 있는 링크가 포함된 이메일 알림을 보냅니다.
- 완료되면 닫기(Close)를 클릭합니다. 닫기를 클릭하면 요약 또는 로그 파일에 더 이상 접근할 수 없습니다.
- 복사 후에는 반드시 복사된 폼의 안전성 폼 구성을 방문합니다. 매핑/값 번역에 대한 조정이 필요할 수 있습니다.
폼 복사에 대한 자세한 내용은 디자인 복사를 참조하십시오.
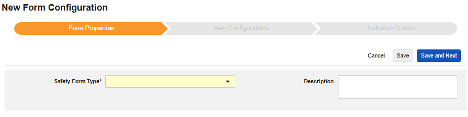
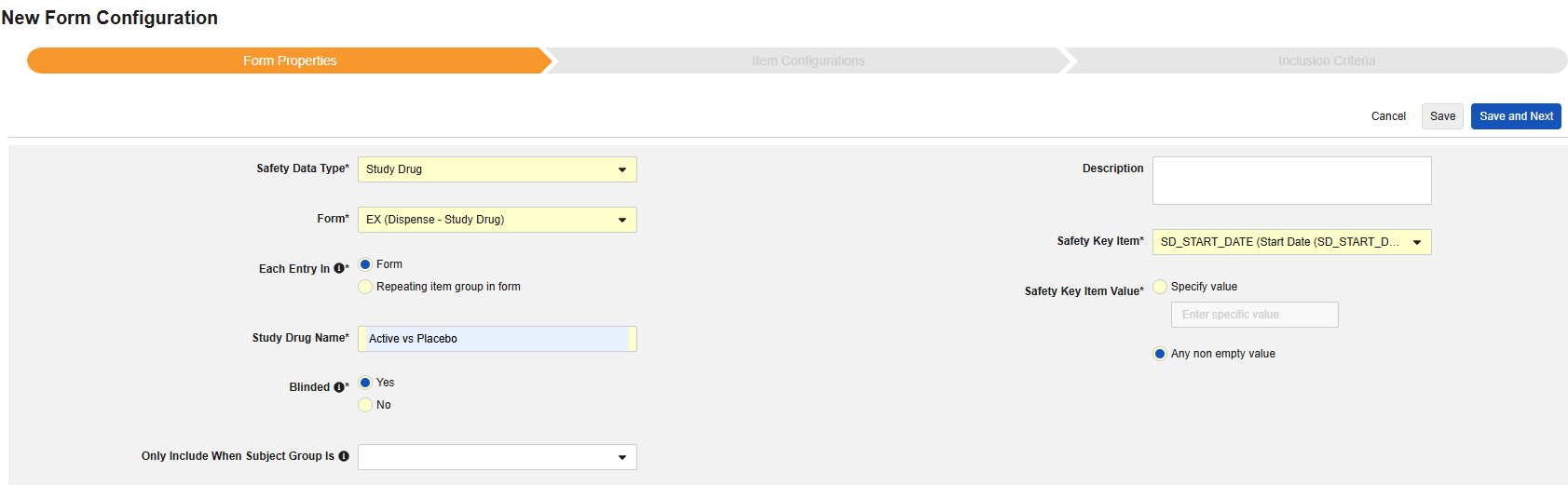
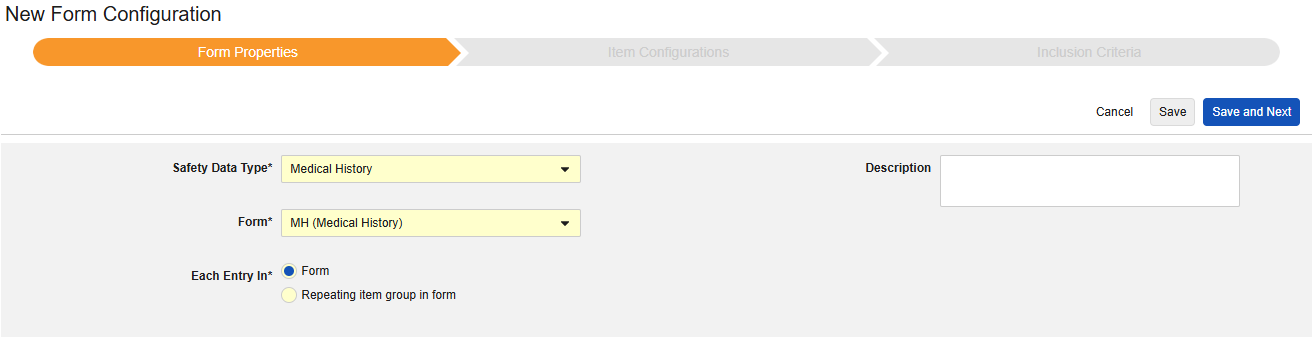
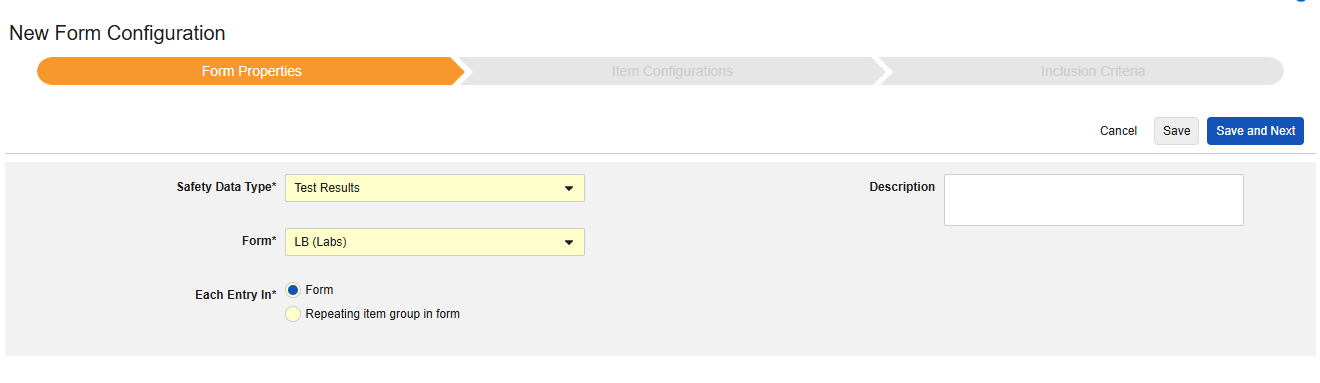
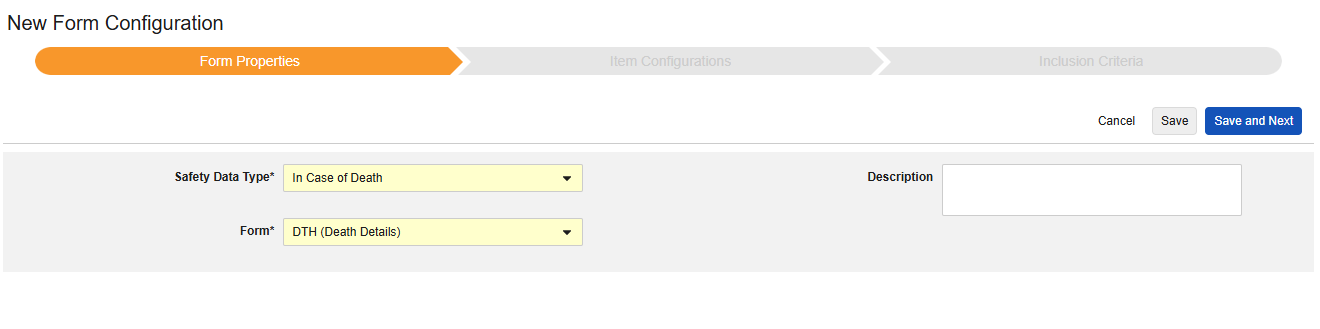
Form Properties
폼 구성의 첫 번째 단계는 폼 속성입니다. 드롭다운 메뉴에서 안전성 유형을 선택하면 일반 속성을 구성에 사용할 수 있습니다. 이는 안전성 데이터 유형에 따라 다릅니다.
| 안전성 데이터 유형 | 속성 | ||||
|---|---|---|---|---|---|
| 폼(Form) | 안전성 키 아이템 | 다음에 포함된 모든 입력 | 제품 정보 | 선택 | |
| 안전성 사례 시작 이벤트 | * | * | * | ||
| 스터디 약물 | * | * | * | * | |
| Concomitant Medications | * | * | |||
| Medical History | * | * | |||
| 약물력 | * | * | |||
| 시험 결과 | * | * | |||
| 환자 특성 | * | ||||
| 사망 시 | * | ||||
|
* 이 속성이 존재하며 안전성 데이터 유형에 필요함을 나타냅니다. 이 속성이 존재하며 안전성 데이터 유형에 선택 사항임을 나타냅니다. |
|||||
- 폼은 안전성 관련 항목에 매핑하기 위해 EDC 폼을 선택해야 합니다.
- 안전성 키 아이템은 폼이 다른 기준보다 먼저 사례 시작 또는 포함에 대해 고려되는지 여부를 평가하는 특수 속성입니다. 안전성 사례 시작 이벤트 유형의 경우, 전체 사례의 초기 전송(또는 이후 무효화)을 유도합니다. 스터디 약물 유형의 경우, 다른 날짜 기반 기준이 평가되기 전 포함의 초기 기준에 해당합니다.
- 다음에 포함된 모든 입력은 EDC 폼이 설계되는 방식에 따라 정보를 다양한 안전성 데이터 유형으로 그룹화하는 방법을 나타내는 설정입니다. 예시 및 자세한 내용은 다음 섹션에서 확인할 수 있습니다. 적절한 안전성 구성을 위해 이를 이해하는 것이 중요합니다.
- 제품 정보는 임상 시험의 알려진 스터디 약물, 이름, 눈가림(또는 눈가림 해제), 적응증, 적용되는 스터디 그룹에 대한 정보입니다.
- 설명은 스터디 설계자에게 유용한 선택적 텍스트입니다.
다음에 포함된 모든 입력 - 설계 고려 사항
안전성 폼 구성의 폼 속성에 있는 다음에 포함된 모든 입력 개념은 데이터 전송 구성의 핵심입니다. 특히 Veeva EDC에 반복 폼의 데이터 또는 반복 아이템 그룹의 데이터를 고려하도록 지시합니다. 이 옵션에는 두 가지 선택 사항이 있습니다.
- 폼: 반복되지 않는 아이템 그룹에 입력된 데이터는 전송의 대상으로 간주됩니다. 예를 들어 스터디에서 여러 이벤트를 허용하기 위해 폼이 반복될 수 있지만, 폼의 아이템 그룹은 반복되어서는 안 됩니다.
- 폼의 반복 아이템 그룹: 폼의 반복 아이템 그룹에 입력된 데이터는 전송을 위해 고려됩니다. 이 경우 여러 이벤트는 폼 반복이 아닌 아이템 그룹의 각 반복으로 표시됩니다.
폼의 일부 아이템 구성에서는 다음에 포함된 모든 입력 폼 속성에서 사용 가능한 선택 항목이 다를 수 있습니다. 유형의 대부분의 아이템 구성은 '단일 항목'을 의미하지만, 일부 특이값은 반복되지 않거나 제한(반복 아이템 또는 반복되지 않는 아이템)이 없어야 합니다. 특이값에 대한 자세한 내용은 이 페이지 뒷부분의 유형별 하위 섹션을 참조하십시오.
다음에 포함된 모든 입력: 폼
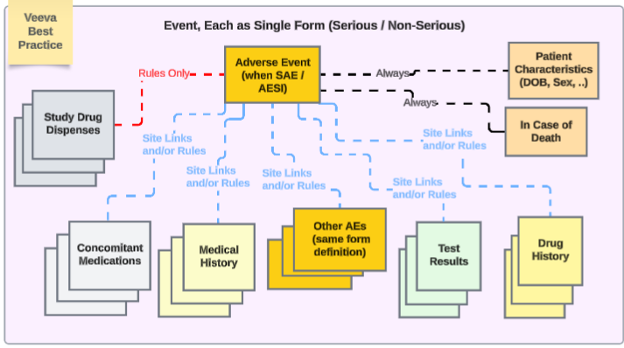
안전성 연동이 포함된 스터디 디자인에 대한 Veeva 모범 사례는 다양한 안전성 유형에서 반복 폼을 사용할 것을 권장합니다.
예에서 다음이 적용됩니다.
- 이상 사례 폼(심각한 경우와 심각하지 않은 경우 모두)은 동일한 폼 디자인을 사용합니다. 이렇게 하면 사이트 사용자의 업그레이드/다운그레이드 이슈가 방지되어, 한 위치(심각하지 않은 AE 폼)에서 다른 위치(심각한 SAE 폼)로 또는 그 반대로 이동할 필요가 없습니다.
- EDC 사용자가 여러 이벤트 안전성 사례를 관리해야 하는 경우, 날짜 규칙 및/또는 특정 사이트 링크를 통해 기본 이벤트에 다른 심각하거나 심각하지 않은 이벤트를 포함시킬 수 있습니다.
- 다른 안전성 데이터 유형은 단일 답변 정보(환자 특성 및 사망 시)를 제외하고 각각 반복 폼입니다. 이때 '반복 폼'은 다음 중 하나를 말합니다.
- 폼이 반복으로 정의되었습니다(예: 로그 폼).
- 스터디 방문 일정 전반에 걸쳐 발생하는 반복되지 않는 폼입니다(예: 방문 1의 스터디 약물, 방문 2의 스터디 약물...).
- 스터디 필요에 따라 사이트 의견(연결) 및/또는 날짜 기반 포함 규칙에는 다양한 유형에 걸쳐 적절한 관련 데이터가 포함될 수 있습니다.
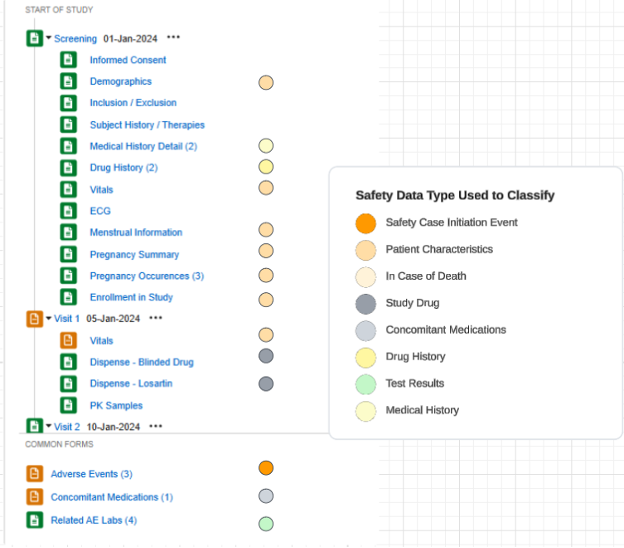
이 구성을 사용하는 스터디 예시 및 스터디 디자인 폼에 적용된 안전성 데이터 유형:
사용자 지정 필드: Safety-EDC Connection을 통해 Veeva Safety의 사용자 지정 필드/구성된 필드를 사용하여 전송할 수 있는 폼/데이터를 확장할 수 있습니다.
다음에 포함된 모든 입력: 반복 아이템 그룹 대 폼
다음에 포함된 모든 입력의 두 가지 옵션을 모두 사용하는 예로 다음 스터디를 고려할 수 있습니다.
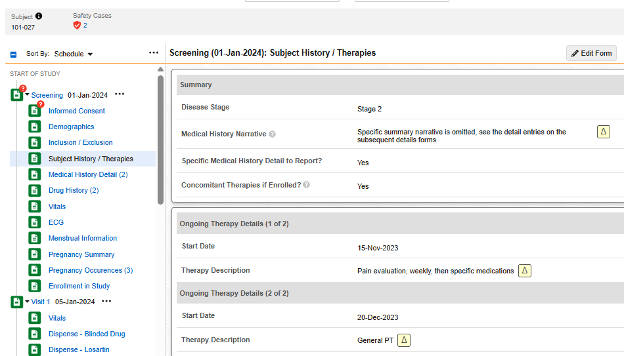
- 대상자 기록/치료 폼에서는 첫 번째 아이템 그룹에서 몇 가지 반복되지 않는 질문을 합니다.
- 보고할 특정 병력 세부 사항(Specific Medical History Detail to Report)?에 예라고 답하면 동적 규칙(폼 제출 시)이 일정의 다음 폼인 병력 세부 사항(Medical History Details)을 엽니다. 여기에 입력된 폼은 폼당 병력 항목으로 구성됩니다.
- 등록 시 병행 치료(Concomitant Therapies if Enrolled)?에 예라고 답하면 Progressive Display를 사용하여 동일한 폼에 반복 아이템 그룹을 표시합니다. 병력 항목은 필요에 따라 동일한 폼의 반복 아이템 그룹으로 입력됩니다.
- 병력 세부 사항 폼은 반복되지만, 반복되지 않는 모든 아이템 그룹/질문이 디자인에 포함되어 있으므로 다음에 포함된 모든 입력(Each Entry In) = 폼(Form)입니다.
- 위의 그림 예시에서 안전성 사례에 대한 4개의 병력이 있는 것으로 간주하는 안전성 구성은 다음과 같습니다.
- 폼 CTHERAPY(대상자 기록/치료):
- 유형 = 병력
- 다음에 포함된 모든 입력 = 폼의 반복 아이템 그룹
- 폼 MH(병력 세부 사항):
- 유형 = 병력
- 다음에 포함된 모든 입력 = 폼
- 폼 CTHERAPY(대상자 기록/치료):
다음에 포함된 모든 입력: 이벤트의 반복 아이템 그룹
하나의 EDC 폼 디자인에서 안전성 사례의 여러 이벤트를 추적하는 스터디의 경우 접근 방식은 다음과 같습니다.
- 안전성 사례는 이벤트가 포함된 폼의 존재만으로 시작됩니다.
- 이 스터디 디자인에서는 다음에 포함된 모든 입력이 폼의 반복 아이템 그룹(Repeating item group in form)으로 설정되어야 합니다.
안전성 키 아이템/값
폼 속성 설정 안전성 키 아이템(Safety Key Item) 및 안전성 키 아이템 값(Safety Key Item Value)은 사례의 시작 또는 사례에 대한 폼 포함을 평가합니다. 이는 다음 안전성 유형에 적용됩니다.
- 안전성 사례 시작 이벤트 - 시스템 평가가 true이면 안전성 시스템으로의 첫 번째 전송이 시작됩니다. 반대로, 시스템에서 평가를 false라고 판단하고 이전 안전성 사례가 전송된 경우, 안전성 시스템으로 무효화가 전송됩니다.
- 스터디 약물 - 시스템 평가가 true경우 폼의 조제 정보는 사례에 포함될 수 있는 것으로 간주됩니다. 스터디 약물 포함 기준에 대한 추가 평가는 최종적으로 안전성 사례와의 데이터 전송을 결정합니다.
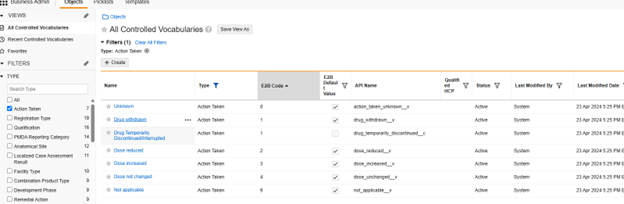
안전성 키 아이템 값을 코드 목록에 참조하려면 코드 목록 레이블이 아닌 코드 목록 코드를 지정해야 합니다.
다음은 안전성 사례 시작 이벤트 유형에 대한 몇 가지 일반적인 예입니다.
예시 1
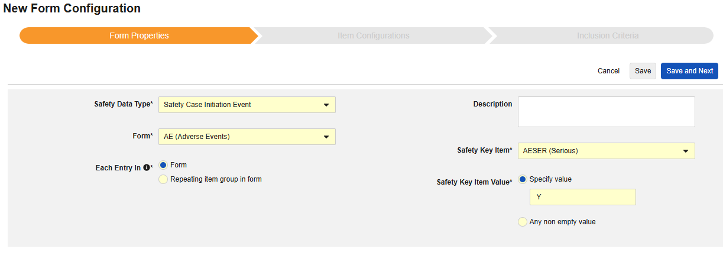
안전성 키 아이템은 코드 목록 유형 아이템 "AESER"를 참조하며, 안전성 사례를 시작하는 데 코드 목록 코드 "Y"가 필요합니다. 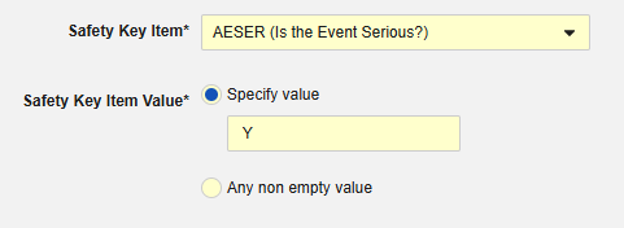
안전성 키 아이템은 AE 폼의 다음 아이템을 참조합니다. 안전성 키 아이템 값에는 코드 목록 코드가 필요하며, 사이트 사용자는 코드 목록 레이블에서 선택합니다.
- 이 규정된 답변과 함께 이러한 폼을 처음 제출하면, 폼이 안전성 전송 및 관련 데이터를 전송할 수 있는 자격을 갖추게 됩니다.
- 전송은 구성된 타이밍에 발생합니다. 자세한 내용은 안전성 연동 관리의 안전성 설정을 참조하십시오.
- 또한 전송을 진행하려면 안전성 필드 이벤트 보고됨에도 폼에 비어 있지 않은 값이 있어야 합니다.
- 이 예에서는 이상 사례 폼에 대한 심각한 질문을 사용하여 안전성 사례를 전송할지 여부를 결정합니다. 이 필드는 모든 스터디/폼 디자인에서 일반적으로 안전성 필드 심각함(Serious)에도 매핑됩니다.
첫 번째 안전성 시스템으로 전송한 후, 이러한 조건 중 어느 것도 더 이상 충족될 수 없습니다. (예: 심각함 = 아니요 또는 이벤트 보고됨 값 부재). 이 경우 시스템은 더 이상 안전성 사례로 자격이 없음을 나타내는 무효화(Nullification) 팔로우업을 안전성 시스템으로 자동 전송합니다. 사이트 사용자가 폼 데이터를 수정한 후에는 안전성 연동과 관련하여 특정 사이트 작업이 필요하지 않습니다.
예시 2
예시 1은 심각한 질문을 안전성 키 아이템으로 사용했습니다. 그러나 안전성 전송 위치에 매핑하는 데 사용되지 않는 필드를 포함하여 모든 필드를 해당 목적으로 사용할 수 있습니다.
이 예시에서는 대신 AE 폼에서 더 일반적인 질문을 사용합니다.
이것이 폼의 주요 심각한 질문은 아니지만, 심각한 이상 사례와 심각하지 않을 수도 있지만 여전히 데이터를 안전성 시스템으로 전송해야 하는 '특별 관심 이상 사례'(AESI) 모두에 대한 안전성 사례를 시작할 수 있도록 합니다.
예시 3
다음 예시에서는 안전성 사례 시작 및 무효화가 사이트 사용자에게 더 투명하게 표시되는 한편, 하나의 안전성 키 아이템 값을 계속 사용합니다.
코드 목록 아이템에서 사용할 수 있는 옵션은 다음과 같습니다.
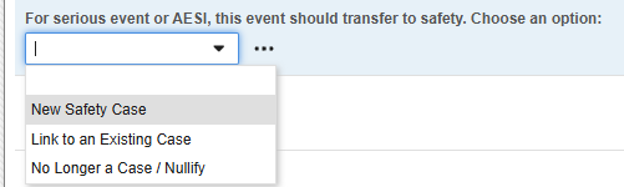
- 새 안전성 사례(사례의 코드 목록 코드): 안전성 키 아이템에 사용됩니다. 따라서 이 선택만 안전성 사례를 시작합니다.
- 기존 사례에 연결: 이 코드는 답변이 있으면 안전성 키 아이템 값을 false로 평가합니다. 따라서 폼이 독립형/추가 사례를 시작하지 않습니다. 대신 디자인 규칙을 사용하여 사이트 사용자가 현재 폼을 안전성 사례를 시작한 다른 이벤트에 연결하도록 합니다.
- 더 이상..: 이전에 안전성 사례에 대한 자격을 갖추었으며 전송된 이벤트에 사용됩니다. 사이트 사용자는 다운그레이드 또는 무효화를 표시하는 한편, EDC 시스템은 이 선택의 코드 목록 코드를 false로 평가합니다. 이로 인해 이전에 시작된 안전성 사례에 대한 무효화 팔로우업이 발생합니다.
무효화
안전성 사례에 포함된 데이터 변경이 발생할 때마다 Veeva EDC에서 팔로우업을 전송합니다. 무효화는 다음과 같은 속성이 있는 특별한 종류의 팔로우업입니다.
- 다음 중 하나에 해당하는 경우 발생합니다.
- 안전성 키 아이템 및 안전성 키 아이템 값 평가가 false가 됩니다.
- EDC 폼의 아이템 값이 이벤트 보고됨 안전성 필드 위치에 대해 비어 있습니다.
- Veeva Safety에 대한 다음 메시지에서 무효화 유형으로 표시됩니다.
- 안전성 사례를 안전성 시스템에 보내는 마지막 전송입니다.
- 참고: 사례의 첫 번째 전송은 이전에 발생했습니다. Veeva EDC는 첫 번째 전송(즉, 초기 전송 타이머 이후)에 위의 두 가지 조건을 재평가하고, 안전성 시스템으로 전송하지 않고 즉시 안전성 사례를 무효화합니다. 이는 첫 번째 전송 타이머가 끝나기 전에 사이트 사용자가 실수를 하거나 폼을 재설정하는 등의 작업을 수행할 때 가장 일반적으로 발생합니다.
- 안전성 보고에는 일반적으로 그러한 전송에 대한 무효화 사유가 필요합니다. 사이트 사용자에게 질문하도록 스터디를 구성할 수 있습니다. 사이트 답변에 대해 구성되지 않았거나 사이트가 답변하지 않는 경우, 시스템은 기본 이유인 "사례가 더 이상 처음 전송된 시점의 조건을 충족하지 않습니다. 여기에는 현재 심각하지 않은 것으로 다운그레이드된 이벤트 또는 모든 이벤트를 제거하는 사용자 작업이 포함될 수 있습니다"를 사용합니다.
무효화의 일반적인 예:
- EDC 폼 재설정
- 이전 폼 제출 후 의도적으로 EDC 폼에서 의도적으로 공백으로 남김
- "다운그레이드"(예: 안전성 키 아이템/값을 통해 안전성 사례를 충족하는 데 사용) 상황이 아니지만 이벤트가 여전히 지속됨
Veeva EDC의 안전성 사례에 대해 무효화가 발생하면 활성 안전성 사례로 되돌아가지 않습니다. 동일한 폼을 변경하여 안전성 키 아이템/값이 true이고 이벤트 보고자 안전성 필드의 값이 다시 한 번 비어 있지 않으면 새 안전성 사례가 생성되고 전송됩니다. 원래의 안전성 사례가 다시 시작되지 않습니다.
안전성 데이터 유형별
이 섹션에서는 각 안전성 데이터 유형에 대한 폼 구성 단계에 대해 설명합니다.
안전성 사례 시작 이벤트
이 안전성 데이터 유형의 폼 구성은 안전성 사례 전송 프로세스를 시작하는 데 중요합니다. 이후 다른 모든 안전성 데이터 유형은 구성된 규칙에 따라 사례로 가져옵니다. 이벤트는 Veeva Safety의 다음 섹션에 나타납니다.
Veeva Safety EDC Connection을 사용하면 여러 폼을 안전성 사례 시작 이벤트로 구성할 수 있습니다. 이를 통해 이상 사례 폼 디자인의 유연성을 높일 수 있습니다. 이 기능을 사용하면 심각한 이상 사례, 그리고 임신과 같이 안전성 시스템에 보고해야 하는 기타 상황에 대해 별도의 폼을 마련할 수 있습니다.
안전성 사례 시작 이벤트 폼을 구성하는 방법은 다음과 같습니다.
- 스터디의 Studio > 형식 구성으로 이동합니다.
- + 새 형식 구성을 클릭합니다.
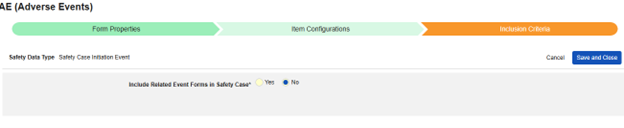
- 안전성 데이터 유형(Safety Data Type)에 대해 안전성 사례 시작 이벤트(Safety Case Initiation Event)를 선택합니다.
- 폼을 선택합니다.
- 각 다음에 포함된 모든 입력(Each Entry In)에 대해 개별 사례를 결정하는 방법을 선택합니다.
- 폼: 이 옵션을 선택하여 폼의 각 인스턴스를 자체 사례로 처리합니다.
- 폼 내 반복 아이템 그룹: 이 옵션을 선택하여 반복 아이템 그룹의 각 인스턴스를 자체 사례로 처리합니다.
- 선택 사항: 설명(Description)을 입력합니다.
- 안전성 키 아이템 값을 정의합니다. 다음 중 하나를 선택합니다.
- 값 지정: 이 옵션을 사용하면 일치시킬 특정 값을 입력해야 합니다. 코드 목록 유형 아이템의 경우 레이블이 아닌 코드 목록 아이템의 코드를 제공해야 합니다.
- 비어 있지 않은 값: 이 옵션은 비어 있지 않은 값을 일치하는 항목으로 간주합니다.
- 저장 또는 저장 및 다음을 클릭하여 아이템 구성 단계를 진행합니다.
안전성 데이터 유형, 폼 및 다음에 포함된 모든 입력 설정은 처음 저장될 때만 읽습니다. 아이템 구성 및 포함 기준 탭의 추가 구성은 이러한 설정에 따라 달라집니다. 이러한 설정을 변경하려면 폼 구성을 삭제하고 다시 생성해야 합니다.
스터디 약물
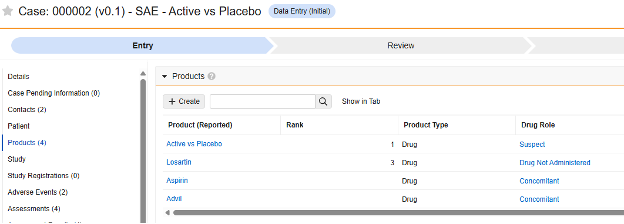
이 안전성 데이터 유형은 스터디 약물의 투약/조제 정보, 즉 임상 스터디에서 대상자에 대해 테스트하고 있는 정보를 추적하는 데 사용됩니다. 정보는 Veeva Safety의 제품/제품 투여량 섹션으로 전달됩니다. 아래 예는 두 가지 약물을 보여 줍니다.
다중 폼: 스터디 약물 안전성 데이터 유형으로 여러 폼 정의를 구성할 수 있습니다.
스터디 약물 폼(이전에는 레이블이 지정된 치료)의 데이터를 포함하려면
- 스터디의 Studio > 형식 구성으로 이동합니다.
- + 새 형식 구성을 클릭합니다.
- 안전성 데이터 유형에 맞는 스터디 약물을 선택합니다.
- 각 항목 입력에 대해 개별 스터디 약물을 결정하는 방법을 선택합니다.
- 폼: 이 옵션을 선택하여 폼의 각 인스턴스를 자체 스터디 약물로 처리합니다.
- 폼 내 반복 아이템 그룹: 이 옵션을 선택하여 반복 아이템 그룹의 각 인스턴스를 자체 스터디 약물로 처리합니다.
- 스터디 약물 이름을 입력합니다. 이 값은 Veeva Safety에서 약물 이름이 지정되는 방식과 일치해야 합니다. 일치하지 않는 경우, 전송/흐름이 중지되지는 않지만 결국 동기화가 필요합니다.
-
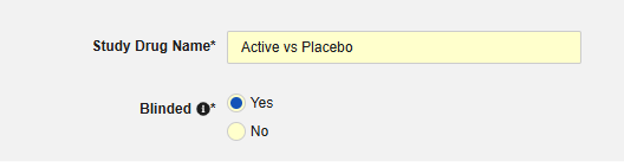
눈가림에 예 또는 아니요를 선택합니다. 스터디 약물이 시험에서 눈가림으로 간주되는지 여부를 나타냅니다. 이 속성은 표시일 뿐이며, 보고 목적으로만 사용됩니다. 모든 데이터는 EDC의 데이터에 제한이 적용되더라도 눈가림되지 않은 상태로 안전성 시스템으로 전송됩니다.
-
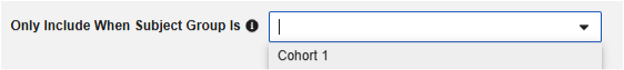
선택 사항: 대상자가 특정 대상자 그룹에 있는 경우에만 이 폼을 포함하도록 선택할 수 있습니다. 대상자 그룹이 다음인 경우에만 포함에 맞는 그룹을 선택합니다. 선택된 그룹에 속하지 않은 대상자에는 전송 시 스터디 약물 폼이 없습니다. 이 필드가 비어 있는 경우 포함 기준이 충족되면 Vault는 모든 대상자의 폼을 포함합니다.
- 선택 사항: 설명(Description)을 입력합니다.
- 안전성 키 아이템을 선택합니다. 일반적으로 조제가 수행되었음을 나타내는 아이템입니다. 스터디 약물 유형의 경우, 평가를 통해 전송에 포함될 수 있는 폼/조제를 고려합니다. 또한 안전성 사례에서 스터디 약물의 적절한 조제를 포함하는 데 추가 포함 기준을 평가합니다.
- 안전성 키 아이템 값을 정의합니다. 다음 중 하나를 선택합니다.
- 값 지정: 이 옵션을 사용하면 일치시킬 특정 값을 입력해야 합니다.
- 비어 있지 않은 값: 이 옵션은 비어 있지 않은 값을 일치하는 항목으로 간주합니다.
- 저장 또는 저장 및 다음을 클릭하여 아이템 구성 단계를 진행합니다.
안전성 데이터 유형, 폼 및 다음에 포함된 모든 입력 설정은 처음 저장될 때만 읽습니다. 아이템 구성 및 포함 기준 탭의 추가 구성은 이러한 설정에 따라 달라집니다. 이러한 설정을 변경하려면 폼 구성을 삭제하고 다시 생성해야 합니다.
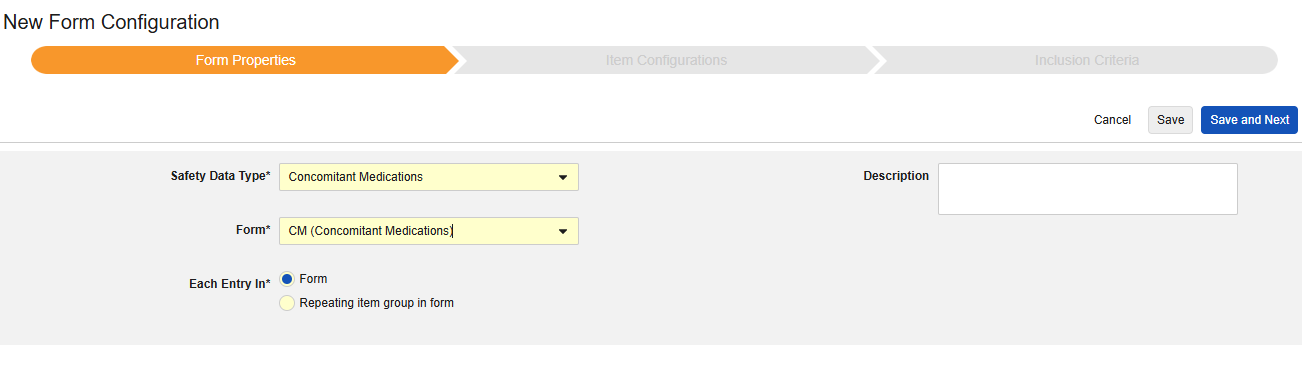
Concomitant Medications
이 유형의 안전성 구성은 스터디의 병용약물 폼에 적용됩니다. 정보는 Veeva Safety의 제품/제품 투여량 섹션으로 전달됩니다. 아래 예는 Aspirin과 Advil을 보여 줍니다.
다중 폼: 병용약물 안전성 데이터 유형으로 여러 폼 정의를 구성할 수 있습니다.
병용약물을 포함하려면
- 스터디의 Studio > 형식 구성으로 이동합니다.
- + 새 형식 구성을 클릭합니다.
- 안전성 데이터 유형에 맞는 병용약물을 선택합니다.
- 각 항목 입력에 대해 개별 ConMed를 결정하는 방법을 선택합니다.
- 폼: 이 옵션을 선택하여 폼의 각 인스턴스를 자체 ConMed로 처리합니다.
- 폼 내 반복 아이템 그룹: 이 옵션을 선택하여 반복 아이템 그룹의 각 인스턴스를 자체 ConMed로 처리합니다.
- 선택 사항: 설명(Description)을 입력합니다.
- 저장 또는 저장 및 다음을 클릭하여 아이템 구성 단계를 진행합니다.
안전성 데이터 유형, 폼 및 다음에 포함된 모든 입력 설정은 처음 저장될 때만 읽습니다. 아이템 구성 및 포함 기준 탭의 추가 구성은 이러한 설정에 따라 달라집니다. 이러한 설정을 변경하려면 폼 구성을 삭제하고 다시 생성해야 합니다.
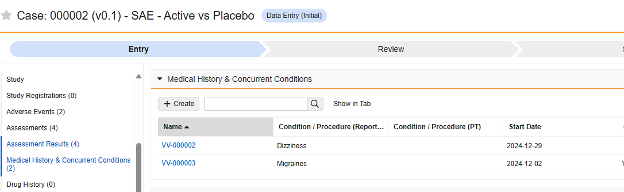
Medical History
이 유형의 안전성 구성은 스터디의 병력 폼에 적용됩니다. 정보는 Veeva Safety의 병력 및 동반 질환 섹션으로 전달됩니다.
다중 폼: 병력 안전성 데이터 유형으로 여러 폼 정의를 구성할 수 있습니다.
병력을 포함하려면
- 스터디의 Studio > 형식 구성으로 이동합니다.
- + 새 형식 구성을 클릭합니다.
- 안전성 데이터 유형에 맞는 병력을 선택합니다.
- 각 항목 입력에 대해 개별 병력 이벤트를 결정하는 방법을 선택합니다.
- 폼: 이 옵션을 선택하여 폼의 각 인스턴스를 자체 병력으로 처리합니다.
- 폼 내 반복 아이템 그룹: 이 옵션을 선택하여 반복 아이템 그룹의 각 인스턴스를 자체 병력으로 처리합니다.
- 선택 사항: 설명(Description)을 입력합니다.
- 저장 또는 저장 및 다음을 클릭하여 아이템 구성 단계를 진행합니다.
안전성 데이터 유형, 폼 및 다음에 포함된 모든 입력 설정은 처음 저장될 때만 읽습니다. 아이템 구성 및 포함 기준 탭의 추가 구성은 이러한 설정에 따라 달라집니다. 이러한 설정을 변경하려면 폼 구성을 삭제하고 다시 생성해야 합니다.
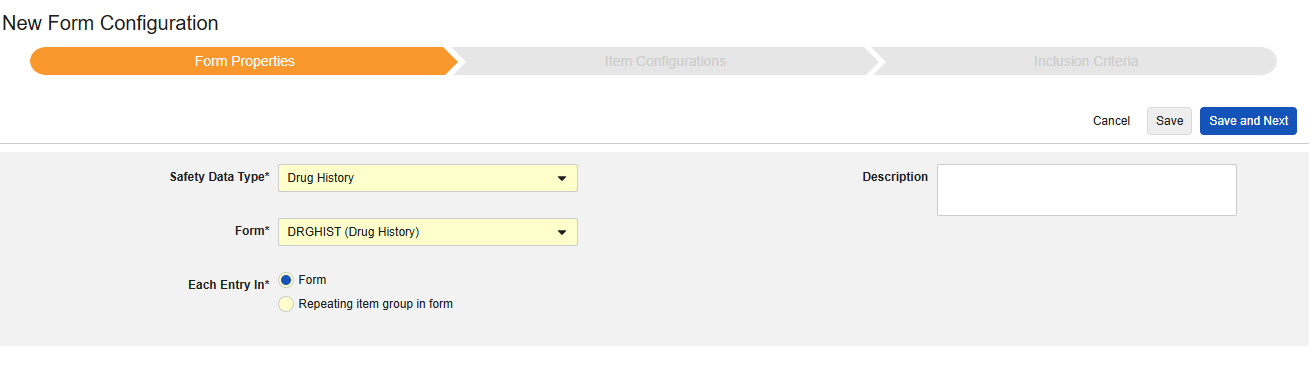
약물력
이 유형의 안전성 구성은 스터디의 약물력 폼에 적용됩니다. 정보는 Veeva Safety의 약물력 섹션으로 전달됩니다.
다중 폼: 약물력 안전성 데이터 유형으로 여러 폼 정의를 구성할 수 있습니다.
약물력 폼의 데이터를 포함하려면
- 스터디의 Studio > 형식 구성으로 이동합니다.
- + 새 형식 구성을 클릭합니다.
- 안전성 데이터 유형에 맞는 약물력을 선택합니다.
- 각 항목 입력에 대해 개별 약물력을 결정하는 방법을 선택합니다.
- 폼: 이 옵션을 선택하여 폼의 각 인스턴스를 자체 약물력으로 처리합니다.
- 폼 내 반복 아이템 그룹: 이 옵션을 선택하여 반복 아이템 그룹의 각 인스턴스를 자체 약물력으로 처리합니다.
- 선택 사항: 설명(Description)을 입력합니다.
- 저장 또는 저장 및 다음을 클릭하여 아이템 구성 단계를 진행합니다.
안전성 데이터 유형, 폼 및 다음에 포함된 모든 입력 설정은 처음 저장될 때만 읽습니다. 아이템 구성 및 포함 기준 탭의 추가 구성은 이러한 설정에 따라 달라집니다. 이러한 설정을 변경하려면 폼 구성을 삭제하고 다시 생성해야 합니다.
시험 결과
이 유형의 안전성 구성은 스터디의 실험실/시험 결과 폼에 적용됩니다. 정보는 Veeva Safety의 시험 결과 섹션으로 전달됩니다.
다중 폼: 시험 결과 안전성 데이터 유형으로 여러 폼 정의를 구성할 수 있습니다.
Veeva EDC에서 로컬 실험실 모듈(실험실 패널)을 사용하는 경우, 폼은 추가적인 안전성 구성이 특별히 설정되지 않습니다. 대신 실험실 날짜가 안전성 사례의 시작에 가까운 모든 테스트는 검토를 위해 Veeva Safety로 전송됩니다. 그곳에서 Veeva Safety 사용자는 의료 검토에 따라 사례에 특정 테스트를 포함할 수 있습니다. 사례 주변의 일수 범위는 스터디 안전성 설정에서 구성됩니다.
시험 결과의 데이터를 포함하는 방법은 다음과 같습니다.
- 아직 편집 모드에 있지 않은 경우 편집을 클릭합니다.
- 시험 결과(Test Results)를 클릭하여 해당 섹션을 확장합니다.
- 시험 결과 포함(Include Test Results)에 대해 예(Yes)를 선택합니다.
- 시험 결과 폼(Test Results Form)을 선택합니다.
- 폼에 포함하는 각 필드의 아이템을 선택합니다. 아이템에는 올바른 데이터 형식이 있어야 합니다. 아이템 목록과 예상 데이터 형식은 아래 표를 참조하십시오.
- 저장 또는 저장 및 다음을 클릭하여 아이템 구성 단계를 진행합니다.
안전성 데이터 유형, 폼 및 다음에 포함된 모든 입력 설정은 처음 저장될 때만 읽습니다. 아이템 구성 및 포함 기준 탭의 추가 구성은 이러한 설정에 따라 달라집니다. 이러한 설정을 변경하려면 폼 구성을 삭제하고 다시 생성해야 합니다.
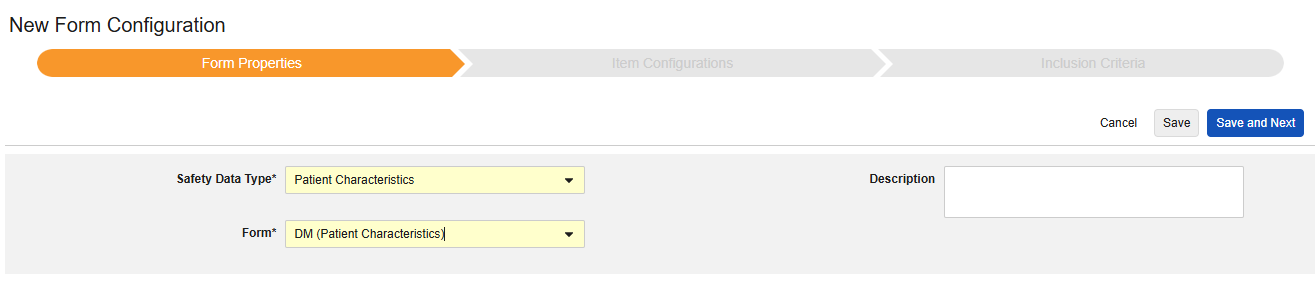
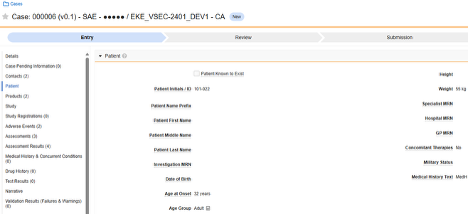
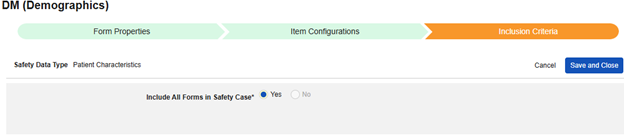
환자 특성
이 유형의 안전성 구성은 대상자에 대한 일반 정보에 적용됩니다. 정보는 Veeva Safety의 환자 섹션으로 전달됩니다.
다중 폼: 환자 특징 안전성 데이터 유형으로 여러 폼 정의를 구성할 수 있습니다. 예를 들어 한 폼에서 성별 아이템을 수집하고 다른 폼에서 생년월일 아이템을 수집할 수 있습니다.
환자 특성을 포함하려면
- 스터디의 Studio > 형식 구성으로 이동합니다.
- + 새 형식 구성을 클릭합니다.
- 안전성 데이터 유형에 맞는 환자 특성을 선택합니다.
- 선택 사항: 설명(Description)을 입력합니다.
- 저장 또는 저장 및 다음을 클릭하여 아이템 구성 단계를 진행합니다.
안전성 데이터 유형, 폼 및 다음에 포함된 모든 입력 설정은 처음 저장될 때만 읽습니다. 아이템 구성 및 포함 기준 탭의 추가 구성은 이러한 설정에 따라 달라집니다. 이러한 설정을 변경하려면 폼 구성을 삭제하고 다시 생성해야 합니다.
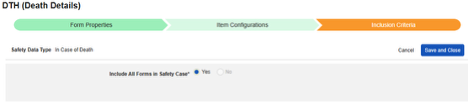
사망 시
이 유형의 안전성 구성은 대상자에 대한 사망 세부 사항과 관련된 폼에 적용됩니다. 이 유형의 일부 필드는 반복되지 않아야 하며(예: 사망 날짜), 다른 필드는 반복되거나 반복되지 않을 수 있습니다(사망 원인). 정보는 Veeva Safety의 두 곳, 즉 환자 또는 사망 원인으로 전달됩니다.
다중 폼: 사망 시 안전성 데이터 유형으로 여러 폼 정의를 구성할 수 있습니다.
사망 시 폼의 데이터를 포함하려면
- 스터디의 Studio > 형식 구성으로 이동합니다.
- + 새 형식 구성을 클릭합니다.
- 안전성 데이터 유형에 맞는 사망 시 항목을 선택합니다.
- 선택 사항: 설명(Description)을 입력합니다.
- 저장 또는 저장 및 다음을 클릭하여 아이템 구성 단계를 진행합니다.
안전성 데이터 유형, 폼 및 다음에 포함된 모든 입력 설정은 처음 저장될 때만 읽습니다. 아이템 구성 및 포함 기준 탭의 추가 구성은 이러한 설정에 따라 달라집니다. 이러한 설정을 변경하려면 폼 구성을 삭제하고 다시 생성해야 합니다.
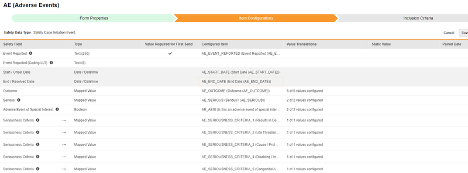
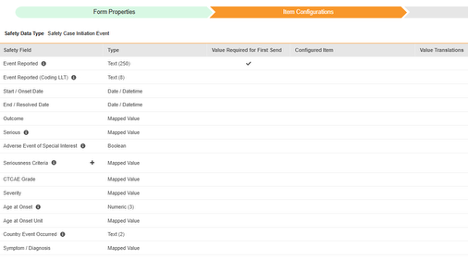
아이템 구성
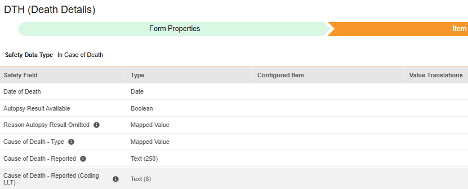
안전성 폼 구성의 두 번째 단계는 아이템 구성 탭입니다. 예를 들어 다음 AE(이상 사례) 폼 디자인은 안전성 사례 시작 이벤트로 분류되었습니다.
이 그리드의 목적은 폼 디자인(아이템 정의)의 답변을 Veeva Safety의 적절한 위치에 할당하는 것입니다.
다음 표는 그리드의 열을 요약합니다.
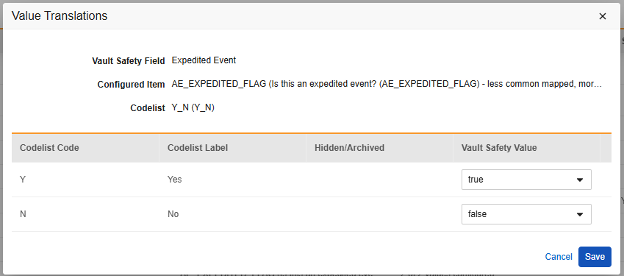
값 번역
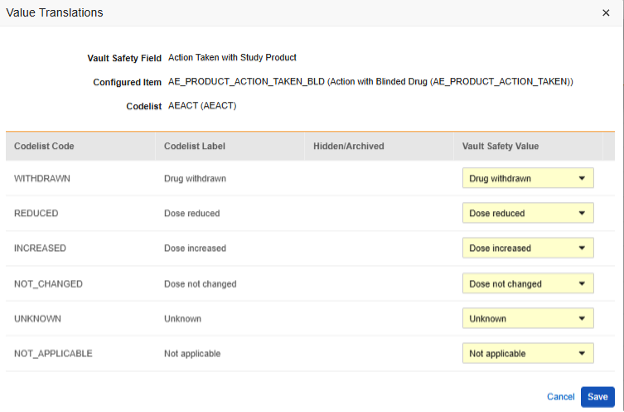
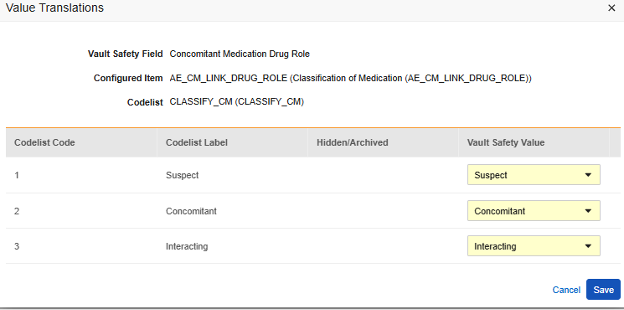
E2B 위치에 매핑되는 아이템 정의가 코드 목록 또는 불린(Boolean)(확인란) 데이터 유형이고 E2B 위치에 매우 구체적인 E2B 값이 필요한 경우, 값 번역(Value Translations)을 설정해야 전송이 올바르게 작동합니다.
- 구성된 아이템(Configured Item) 열에서 아이템 정의(Item Definition)를 선택합니다.
-
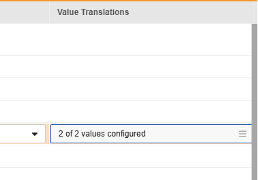
값 번역 열의 셀을 클릭합니다. 값 번역을 구성할 수 있는 경우, 마우스를 가져가면 셀이 주황색으로 표시됩니다. 그러면 값 번역 대화 상자가 열립니다.
- 각 코드 목록 유형 아이템에 대해 Veeva Safety에서 적절한 값을 선택합니다.
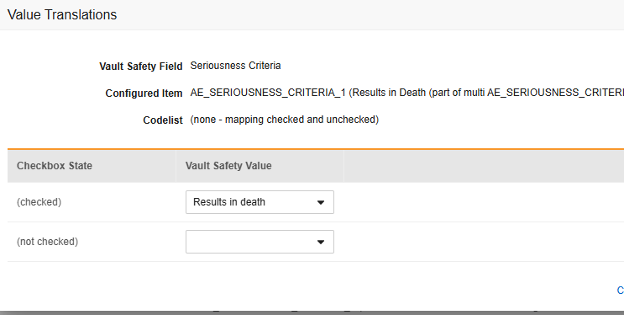
- 불린(Boolean) 유형 아이템의 경우 (선택됨) 또는 (선택되지 않음) 중 하나가 매핑됩니다. 예를 들면 다음과 같습니다.
- 완료되면 저장을 클릭합니다.
- 값 번역이 지정되면 구성된 번역 수가 셀에 표시됩니다.
- 자체 표준에 따라 특정 값이 필요한 모든 위치에 대해 이 단계를 반복합니다. 이들 중 하나라도 누락되면 Studio 검증 작업에서 오류가 표시되고 배포가 방지됩니다.
번역 값은 이 작업 후에 일시적으로만 저장됩니다. 이후에 탭 수준에서 저장 또는 저장 및 다음을 사용하면 번역이 저장됩니다.
정적 값
일부 안전성 필드에서는 EDC 폼 정의의 특정 아이템 정의를 사용하는 대신 정적 값이 허용됩니다. 필드별 세부 사항, 특히 정적 값의 구성을 허용하는 필드는 아래의 안전성 데이터 유형 섹션을 참조하십시오.
예시:
페어링된 날짜
일부 안전성 필드에서는 일련의 값을 Veeva Safety로 전송할 수 있습니다. 각 값은 해당 값의 날짜와 페어링됩니다. 예를 들어 EDC 스터디 디자인 전반에 걸쳐 활력징후 폼에 체중이 존재할 수 있습니다. 연결은 참조를 위해 모든 값을 전송합니다. 사례 생성 시 Veeva Safety는 사례 시작 전 또는 시작 시점에 가장 가까운 값을 자동으로 결정합니다. 다른 값은 추가 대상자 정보로 제공되며, Veeva Safety에서 검토할 수 있습니다. 이러한 값과 페어링된 날짜는 이벤트 날짜이거나 동일한 폼의 다른 날짜 유형 아이템 정의의 값일 수 있습니다.
필드별 세부 사항, 특히 이 방식의 구성을 허용하는 필드는 안전성 데이터 유형별 아이템 구성을 참조하십시오.
예시:
스터디 약물 연관성
안전성 사례 시작 이벤트로 분류된 폼에서 스터디 약물에 대해 질문하는 안전성 필드에는 답변이 적용되는 특정 스터디 약물도 명시되어야 합니다.
필드별 세부 사항, 특히 '스터디 약물별'로 답변해야 하는 필드는 안전성 데이터 유형별 아이템 구성을 참조하십시오.
예:
-
중요한 이벤트 대 스터디 약물 질문에 대한 답변(스터디 제품을 대상으로 실시한 작업(Action Taken with Study Product), 스터디 약물 평가 결과(Result of Assessment to Study Drug), 스터디 약물 재개 시 반응/이벤트가 다시 발생했습니까(Did Reaction / Event Recur when Study Drug Resumed))이 구성되며, 각 스터디 약물에 대해 답변합니다.
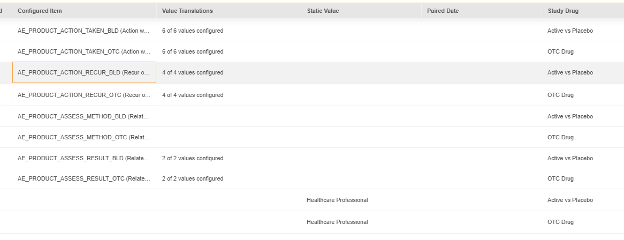
-
위의 정적 값은 스터디 약물 평가 소스(Source of Assessment to Study Drug)를 대상으로 각각에 대해서도(폼의 아이템 대신) 설정됩니다.
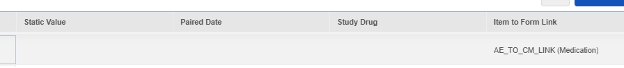
아이템-폼 링크 연관성
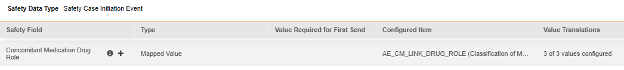
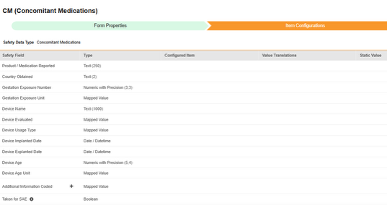
현재 하나의 아이템 구성에는 아이템 정의의 아이템-폼 링크 유형과 '링크 포함'이 주어진 답변 간의 관계가 포함됩니다. 특히 안전성 사례 시작 이벤트 데이터 유형인 병용약물 약물 역할(Concomitant Medication Drug Role)의 필드가 그러합니다.
EDC 폼에 제공된 답변에는 병용약물에 대한 사이트 의견이 포함됩니다. 특정 안전성 사례/이벤트의 경우 사이트는 해당 사례/이벤트에 연결되지만 병용과 다른 의견/답변, 상호 작용 또는 의심을 제공합니다. 위의 아이템 정의 AE_CM_LINK_DRUG_ROLE이 해당 질문이며, 값 번역이 함께 있습니다.
안전성 사례 시작 이벤트 폼 디자인에 여러 아이템-폼 링크가 있을 수 있으므로, 특정 아이템-폼 링크를 선택해야 합니다. 이 예에서 아이템 정의 AE_TO_CM_LINK는 다음과 같습니다.
안전성 데이터 유형별
안전성 사례 시작 이벤트
이 안전성 데이터 유형의 폼 구성은 안전성 사례 전송 프로세스를 시작하는 데 중요합니다. 이후 다른 모든 안전성 데이터 유형은 구성된 규칙에 따라 사례로 가져옵니다. 이벤트는 Veeva Safety의 다음 섹션에 나타납니다.
이 안전성 데이터 유형에 대한 아이템 구성 단계를 수행하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
-
매핑할 각 행에 대해 구성된 아이템 열의 셀을 사용하여 적절한 아이템 정의를 선택합니다. 예를 들어 Veeva Safety 필드에서 이벤트 보고됨에 대한 폼에서 AETERM 아이템을 선택합니다(아래 그림 참조). 아이템 선택 시 선택 항목은 일반적으로 이전에 저장된 폼 속성 > 다음에 포함된 모든 입력의 설정에 따라 달라집니다. 일부 안전성 위치에는 반복 아이템 그룹 또는 반복되지 않는 아이템 그룹에서만 수행할 수 있거나 때로는 둘 중 하나에서 수행할 수 있음을 나타내는 특별 규칙이 있습니다. 이러한 특이값은 이 단계의 끝에 있는 표와 이 유형의 모든 안전성 위치에 대한 중요한 참고 사항을 참조하십시오.
-
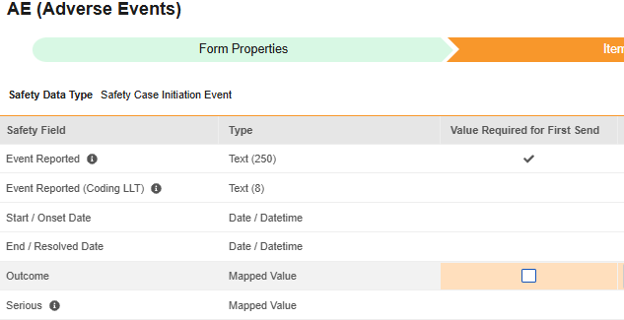
매핑할 각 행에 대해 첫 번째 전송에 필요한 값(Value Required for First Send) 확인란을 선택하여, 이 아이템이 첫 번째 전송에 대한 값을 보유하도록 합니다. 그렇지 않으면 이 확인란을 비워 둡니다.
- 구성된 아이템과 안전성 필드의 데이터 유형에 따라 값 번역을 제공해야 할 수 있습니다. 지침은 위의 값 번역 섹션을 참조하십시오.
- 안전성 필드에 따라 추가 정보가 필요할 수 있습니다. 행의 해당 셀을 사용하여 정보를 제공합니다.
- 저장을 클릭하여 페이지에 남아 있거나, 저장 및 다음을 클릭하여 다음 탭인 포함 기준으로 이동합니다.
| EDC 안전성 데이터 유형 | EDC 필드 레이블 | 필드 데이터 유형 | 메모 | 관련 E2B(R3) 위치 | 받은 편지함/ 사례 오브젝트 및 필드 |
EDC 필드 식별자 |
|---|---|---|---|---|---|---|
| 안전성 사례 시작 이벤트 | 보고된 이벤트 | 텍스트(250) |
|
E.i.1.1a, E.i.1.2 | case_adverse_event__v, event_reported__v | AE_EVENT_REPORTED |
| 안전성 사례 시작 이벤트 | 보고된 이벤트(코딩 LLT) | 텍스트(8) |
|
E.i.2.1a, E.i.2.1b | case_adverse_event__v, event_meddra__v | AE_CODING_LLT |
| 안전성 사례 시작 이벤트 | 시작/발명 날짜 | 날짜/날짜 시간 |
|
E.i.4 | case_adverse_event__v, onset_idate__v | AE_START_DATE |
| 안전성 사례 시작 이벤트 | 종료/해결 날짜 | 날짜 |
|
E.i.5 | case_adverse_event__v, resolved_idate__v | AE_END_DATE |
| 안전성 사례 시작 이벤트 | 결과 | 매핑된 값 |
|
E.i.7 | case_adverse_event__v, outcome__v | AE_OUTCOME |
| 안전성 사례 시작 이벤트 | 심각도 | 매핑된 값 |
|
E.i.3.1 | case_adverse_event__v, highlighted_term__v | AE_SERIOUS |
| 안전성 사례 시작 이벤트 | 특별한 이상 사례 | 불린(Boolean) |
|
case_adverse_event__v, aesi_watchlist__v | AE_AESI | |
| 안전성 사례 시작 이벤트 | 심각도 기준 | 매핑된 값 |
|
E.i.3.2a, E.i.3.2b, E.i.3.2c, E.i.3.2d, E.i.3.2e, E.i.3.2f | case_adverse_event__v, seriousness__v | AE_SERIOUSNESS_CRITERIA |
| 안전성 사례 시작 이벤트 | CTCAE 등급 | 매핑된 값 |
|
case_adverse_event__v, ctcae_grade__v | AE_CTCAE_GRADE | |
| 안전성 사례 시작 이벤트 | Severity | 매핑된 값 |
|
case_adverse_event__v, severity__v | AE_SEVERITY | |
| 안전성 사례 시작 이벤트 | 발병 연령 | 숫자(3) |
|
D.2.2a | case_version__v, age_value__v(age_calculation_status__v를 "예"로 설정한 경우) | AE_AGE_AT_ONSET |
| 안전성 사례 시작 이벤트 | 발병 연령(단위) | 매핑된 값 |
|
D.2.2b | case_version__v, age_unit__v | AE_AGE_AT_ONSET_UNIT |
| 안전성 사례 시작 이벤트 | 이벤트가 발생한 국가 | 텍스트(2) |
|
E.i.9 | case_adverse_event__v, event_country__v | AE_EVENT_COUNTRY |
| 안전성 사례 시작 이벤트 | 증상/진단 | 매핑된 값 |
|
case_adverse_event__v, symptom_diagnosis__v | AE_SYMPTOM_DIAGNOSIS | |
| 안전성 사례 시작 이벤트 | 신속 이벤트 | 불린(Boolean) |
|
case_adverse_event__v, expedited_flag__v | AE_EXPEDITED_FLAG | |
| 안전성 사례 시작 이벤트 | 확인된 전문 의료인 | 불린(Boolean) |
|
E.i.8 | case_adverse_event__v, hcp_confirmed__v | AE_HCP_CONFIRMED |
| 안전성 사례 시작 이벤트 | 입원 날짜 | 날짜 |
|
case_adverse_event__v, hospital_admission_date__v | AE_HOSPITAL_ADM_DATE | |
| 안전성 사례 시작 이벤트 | 퇴원 날짜 | 날짜 |
|
case_adverse_event__v, hospital_discharge_date__v | AE_HOSPITAL_DISCHARGE_DATE | |
| 안전성 사례 시작 이벤트 | 입원 일수 | 숫자(4) |
|
case_adverse_event__v, days_hospitalized__v | AE_DAYS_HOSPITALIZED | |
| 안전성 사례 시작 이벤트 | 병원 이름 | 텍스트(200) |
|
case_adverse_event__v, hospital_name__v | AE_HOSPITAL_NAME | |
| 안전성 사례 시작 이벤트 | 병원이 있는 도시 | 텍스트(35) |
|
case_adverse_event__v, hospital_city__v | AE_HOSPITAL_CITY | |
| 안전성 사례 시작 이벤트 | 병원이 있는 주 | 텍스트(40) |
|
case_adverse_event__v, hospital_state__v | AE_HOSPITAL_STATE | |
| 안전성 사례 시작 이벤트 | 내러티브 | 텍스트(30000) |
|
H.1(사이트 내러티브의 토큰으로) | case_version__v, site_narrative__v | AE_NARRATIVE |
| 안전성 사례 시작 이벤트 | 보고자 코멘트 | 텍스트(20000) |
|
H.2 | case_version__v, reporters_comments__v | AE_REPORTER_COMMENTS |
| 안전성 사례 시작 이벤트 | 발신자 코멘트 | 텍스트(20000) |
|
H.4 | case_version__v, sender_comments__v | AE_SENDER_COMMENTS |
| 안전성 사례 시작 이벤트 | 무효화 이유 | 텍스트(200) |
|
C.1.11.2 | inbox_item__v, edc_reason__v(받은 편지함 아이템에서만 사용할 수 있으며, 사용자에게 이것이 무효화 사례임을 알리고 그 이유를 나타낼 수 있습니다. 사례 데이터 모델에는 영향을 주지 않습니다.) | AE_NULLIFY_REASON |
| 안전성 사례 시작 이벤트 | 보고자 자격 | 매핑된 값 |
|
C.2.r.4 | case_contact__v, qualification__v | AE_REPORTER_QUALIFICATION |
| 안전성 사례 시작 이벤트 | 보고 언어 | 텍스트(20) |
|
E.i.1.1b | case_adverse_event__v, event_reported_language__v | AE_REPORTER_LANGUAGE |
| 안전성 사례 시작 이벤트 | 보고자 국가 | 텍스트(2) |
|
C.2.r.3 | case_contact__v, country_value__v(유효한 경우 2자 ISO 국가 코드) | AE_REPORTER_COUNTRY |
| 안전성 사례 시작 이벤트 | 보고자 이름 | 텍스트(50) |
|
C.2.r.1.2 | case_contact__v, firstname_value__v | AE_REPORTER_FIRST_NAME |
| 안전성 사례 시작 이벤트 | 보고자 성 | 텍스트(50) |
|
C.2.r.1.4 | case_contact__v, lastname_value__v | AE_REPORTER_LAST_NAME |
| 안전성 사례 시작 이벤트 | 보고자 조직 | 텍스트(100) |
|
C.2.r.2.1 | case_contact__v, organization_value__v | AE_REPORTER_ORGANIZATION |
| 안전성 사례 시작 이벤트 | 보고자 이메일 | 텍스트(100) |
|
case_contact__v, email_address__v | AE_REPORTER_EMAIL | |
| 안전성 사례 시작 이벤트 | 보고자 전화번호 | 텍스트(33) |
|
C.2.r.2.7 | case_contact__v, telephone_value__v | AE_REPORTER_TELEPHONE |
| 안전성 사례 시작 이벤트 | 보고자 도로명 1 | 텍스트(100) |
|
C.2.r.2.3 | case_contact__v, street_value__v | AE_REPORTER_STREET |
| 안전성 사례 시작 이벤트 | 보고자 도로명 2 | 텍스트(100) |
|
C.2.r.2.3 | case_contact__v, street_line_2_value__v | AE_REPORTER_STREET_2 |
| 안전성 사례 시작 이벤트 | 보고자 도시 | 텍스트(35) |
|
C.2.r.2.4 | case_contact__v, city_value__v | AE_REPORTER_CITY |
| 안전성 사례 시작 이벤트 | 보고자 주/지방 | 텍스트(40) |
|
C.2.r.2.5 | case_contact__v, state_province_value__v | AE_REPORTER_STATE_PROVINCE |
| 안전성 사례 시작 이벤트 | 보고자 우편 번호 | 텍스트(15) |
|
C.2.r.2.6 | case_contact__v, postalcode_value__v | AE_REPORTER_POSTAL_ZIP |
| 안전성 사례 시작 이벤트 | 전체 실시한 작업 | 매핑된 값 |
|
G.k.8 | , | AE_ACTION_TAKEN |
| 안전성 사례 시작 이벤트 | 병용약물 역할 | 매핑된 값 |
|
G.k.1 | case_product__v, drug_role__v | |
| 안전성 사례 시작 이벤트 | 스터디 제품을 대상으로 실시한 작업 | 매핑된 값 |
|
G.k.8 | case_assessment_result__v, action_taken__v | AE_PRODUCT_ACTION_TAKEN |
| 안전성 사례 시작 이벤트 | 스터디 약물 재개 시 반응/이벤트가 다시 발생했습니까? | 매핑된 값 |
|
G.k.9.i.4 | case_assessment__v, reaction_recurrence__v | AE_PRODUCT_ACTION_RECUR |
| 안전성 사례 시작 이벤트 | 스터디 약물 평가 결과 | 매핑된 값 |
|
G.k.9.i.2.r.3 | case_assessment_result__v, assessment_result__v 또는 result_text__v | AE_PRODUCT_ASSESS_RESULT |
| 안전성 사례 시작 이벤트 | 스터디 약물 평가 방법 | 텍스트(60) |
|
G.k.9.i.2.r.2 | case_assessment_result__v, method_of_assessment__v or method_text__v | AE_PRODUCT_ASSESS_METHOD |
| 안전성 사례 시작 이벤트 | 스터디 약물 평가 소스 | 텍스트(60) |
|
G.k.9.i.2.r.1 | case_assessment_result__v, source_type__v 또는 source_text__v | AE_PRODUCT_ASSESS_SOURCE |
| 안전성 사례 시작 이벤트 | 임신 사례 | 불린(Boolean) |
|
case_version__v, pregnancy__v | AE_PREG_CASE | |
| 안전성 사례 시작 이벤트 | 임신 횟수 | 숫자(2) |
|
case_version__v, gravida_gravidity__v | AE_PREG_INFO_GRAV | |
| 안전성 사례 시작 이벤트 | 출생 횟수 | 숫자(2) |
|
case_version__v, para_parity__v | AE_PREG_INFO_PARA | |
| 안전성 사례 시작 이벤트 | 스터디 약물 노출 시 임신 여부 | 불린(Boolean) |
|
case_version__v, pregnancy_at_vaccination__v | AE_PREG_INFO_AT_VX | |
| 안전성 사례 시작 이벤트 | 마지막 생리 날짜(임신 사례) | 날짜 |
|
D.6 | case_version__v, last_menstrual_idate__v | AE_PREG_LAST_MENSTRUAL_DATE |
| 안전성 사례 시작 이벤트 | 임신 날짜 | 날짜 |
|
case_version__v, pregnancy_conception_idate__v | AE_PREG_INFO_CONC_DT | |
| 안전성 사례 시작 이벤트 | 임신 예정일 | 날짜 |
|
case_version__v, pregnancy_due_idate__v | AE_PREG_INFO_DUE_DT | |
| 안전성 사례 시작 이벤트 | 임신 결과 날짜 | 날짜 |
|
case_version__v, idate_of_pregnancy_outcome__v | AE_PREG_INFO_OUTCOME_DT | |
| 안전성 사례 시작 이벤트 | 임신 결과 | 매핑된 값 |
|
case_version__v, pregnancy_outcome__v | AE_PREG_INFO_OUTCOME | |
| 안전성 사례 시작 이벤트 | 분만 방법 | 매핑된 값 |
|
case_version__v, delivery_method__v | AE_PREG_INFO_DELV_METH |
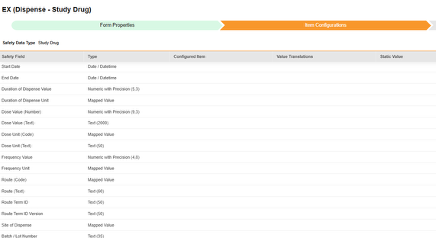
스터디 약물
이 안전성 데이터 유형은 스터디 약물의 투약/조제 정보, 즉 임상 스터디에서 대상자에 대해 테스트하고 있는 정보를 추적하는 데 사용됩니다. 정보는 Veeva Safety의 제품/제품 투여량 섹션으로 전달됩니다. 아래 예는 두 가지 약물을 보여 줍니다.
현재 스터디 약물의 이름은 Studio의 폼 속성 탭에 구성되어 있습니다. 약물 이름에 대한 아이템 구성은 향후 릴리스에서 사용할 수 있습니다.
중요한 "약물 분류"는 이 유형의 EDC 폼에 매핑되는 항목이 아닙니다. 대신 이벤트 시작 날짜 또는 그 이전에 하나 이상의 조제 폼이 있을 때 시스템에서 "의심"을 설정합니다. 조제가 없으면 시스템에서 "투여되지 않음"을 사용합니다.
이 안전성 데이터 유형에 대한 아이템 구성 단계를 수행하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
-
매핑할 각 행에 대해 구성된 아이템 열의 셀을 사용하여 적절한 아이템 정의를 선택합니다. 예를 들어 아래 그림에 표시된 시작 날짜(Start Date) 위치의 폼에서 SD_START_DATE 아이템을 선택합니다. 아이템 선택 시 선택 항목은 일반적으로 이전에 저장된 폼 속성 > 다음에 포함된 모든 입력의 설정에 따라 달라집니다. 일부 안전성 위치에는 반복 아이템 그룹 또는 반복되지 않는 아이템 그룹에서만 수행할 수 있거나 때로는 둘 중 하나에서 수행할 수 있음을 나타내는 특별 규칙이 있습니다. 이러한 특이값은 이 단계의 끝에 있는 표와 이 유형의 모든 안전성 위치에 대한 중요한 참고 사항을 참조하십시오.
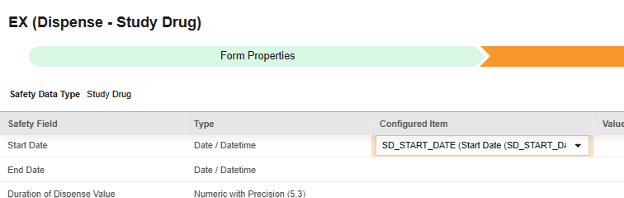
- 구성된 아이템과 안전성 필드의 데이터 유형에 따라 값 번역을 제공해야 할 수 있습니다. 지침은 위의 값 번역 섹션을 참조하십시오.
- 안전성 필드에 따라 추가 정보가 필요할 수 있습니다. 행의 해당 셀을 사용하여 정보를 제공합니다.
- 저장을 클릭하여 페이지에 남아 있거나, 저장 및 다음을 클릭하여 다음 탭인 포함 기준으로 이동합니다.
| EDC 안전성 데이터 유형 | EDC 필드 레이블 | 필드 데이터 유형 | 메모 | 관련 E2B(R3) 위치 | 받은 편지함/ 사례 오브젝트 및 필드 |
EDC 필드 식별자 |
|---|---|---|---|---|---|---|
| 스터디 약물 | 시작 일자 | 날짜/날짜 시간 |
|
G.k.4.r.4 | case_product_dosage__v, firstadmin_idate__v | SD_START_DATE |
| 스터디 약물 | 종료 일자 | 날짜/날짜 시간 |
|
G.k.4.r.5 | case_product_dosage__v, lastadmin_idate__v | SD_END_DATE |
| 스터디 약물 | 조제 기간 값 | 정밀한 숫자(5,3) |
|
G.k.4.r.6a | case_product_dosage__v, duration_number__v | SD_DURATION_VALUE |
| 스터디 약물 | 조제 기간 값(단위) | 매핑된 값 |
|
G.k.4.r.6b | case_product_dosage__v, duration_unit__v | SD_DURATION_UNIT |
| 스터디 약물 | 투여량 값(숫자) | 정밀한 숫자(9,3) |
|
G.k.4.r.1a | case_product_dosage__v, dose_number__v | SD_DOSE_VALUE_NUMBER |
| 스터디 약물 | 투여량 값(텍스트) | 텍스트(2000) |
|
G.k.4.r.8 | case_product_dosage__v, dose_text_long_text__v | SD_DOSE_VALUE_TEXT |
| 스터디 약물 | 투여량 단위(코드) | 매핑된 값 |
|
G.k.4.r.1b | case_product_dosage__v, dose_unit__v | SD_DOSE_UNIT_CODE |
| 스터디 약물 | 투여량 단위(텍스트) | 텍스트(50) |
|
G.k.4.r.8 | case_product_dosage__v, dose_unit_text__v | SD_DOSE_UNIT_TEXT |
| 스터디 약물 | 빈도 값 | 정밀한 숫자(4,8) |
|
G.k.4.r.2 | case_product_dosage__v, frequency_number__v | SD_FREQUENCY_VALUE |
| 스터디 약물 | 빈도 단위 | 매핑된 값 |
|
G.k.4.r.3 | case_product_dosage__v, frequency_unit__v | SD_FREQUENCY_UNIT |
| 스터디 약물 | 경로(코드) | 매핑된 값 |
|
G.k.4.r.10.2b | case_product_dosage__v, patient_adminroute__v | SD_ROUTE_CODE |
| 스터디 약물 | 경로(텍스트) | 텍스트(60) |
|
G.k.4.r.10.1 | case_product_dosage__v, patient_adminroute_text__v | SD_ROUTE_TEXT |
| 스터디 약물 | 경로 용어 ID | 텍스트(50) |
|
G.k.4.r.10.2b | case_product_dosage__v, patient_adminroute_termid__v | SD_ROUTE_TERM_ID |
| 스터디 약물 | 경로 용어 ID 버전 | 텍스트(50) |
|
G.k.4.r.10.2a | case_product_dosage__v, patient_adminroute_termid_version__v | SD_ROUTE_TERM_ID_VERSION |
| 스터디 약물 | 조제 사이트 | 매핑된 값 |
|
case_product_dosage__v, anatomical_site__v | SD_SITE_OF_DISPENSE | |
| 스터디 약물 | 배치/로트 번호 | 텍스트(35) |
|
G.k.4.r.7 | case_product_dosage__v, batchlot_number__v | SD_BATCH_LOT_NUMBER |
| 스터디 약물 | 투여 폼 용어 ID | 텍스트(50) |
|
G.k.4.r.9.2b | case_product_dosage__v, dose_form_termid__v | SD_DOSE_FORM_TERM_ID |
| 스터디 약물 | 투여 폼 용어 ID 버전 | 텍스트(50) |
|
G.k.4.r.9.2a | case_product_dosage__v, dose_form_termid_version__v | SD_DOSE_FORM_TERM_ID_VERSION |
| 스터디 약물 | 투여 폼 텍스트 | 텍스트(128) |
|
G.k.4.r.9.1 | case_product_dosage__v, dose_form_text__v | SD_DOSE_FORM_TEXT |
| 스터디 약물 | 상위 경로(텍스트) | 텍스트(60) |
|
G.k.4.r.11.1 | case_product_dosage__v, parent_adminroute_text__v | SD_PARENT_ROUTE_TEXT |
| 스터디 약물 | 상위 경로(코드) | 매핑된 값 |
|
G.k.4.r.11.2b | case_product_dosage__v, parent_adminroute__v | SD_PARENT_ROUTE_CODE |
| 스터디 약물 | 상위 경로 용어 ID | 텍스트(50) |
|
G.k.4.r.11.2b | case_product_dosage__v, parent_adminroute_termid__v | SD_PARENT_ROUTE_TERM_ID |
| 스터디 약물 | 상위 경로 용어 ID 버전 | 텍스트(50) |
|
G.k.4.r.11.2a | case_product_dosage__v, parent_adminroute_termid_version__v | SD_PARENT_ROUTE_TERM_ID_VERSION |
병용약물
이 유형의 안전성 구성은 스터디의 병용약물 폼에 적용됩니다. 정보는 Veeva Safety의 제품/제품 투여량 섹션으로 전달됩니다.
이 안전성 데이터 유형에 대한 아이템 구성 단계를 수행하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
-
매핑할 각 행에 대해 구성된 아이템 열의 셀을 사용하여 적절한 아이템 정의를 선택합니다. 예를 들어 아래 그림에 표시된 보고된 제품/의약품(Product / Medication Reported) 위치의 폼에서 CMTRT 아이템을 선택합니다. 아이템 선택 시 선택 항목은 일반적으로 이전에 저장된 폼 속성 > 다음에 포함된 모든 입력의 설정에 따라 달라집니다. 일부 안전성 위치에는 반복 아이템 그룹 또는 반복되지 않는 아이템 그룹에서만 수행할 수 있거나 때로는 둘 중 하나에서 수행할 수 있음을 나타내는 특별 규칙이 있습니다. 이러한 특이값은 이 단계의 끝에 있는 표와 이 유형의 모든 안전성 위치에 대한 중요한 참고 사항을 참조하십시오.
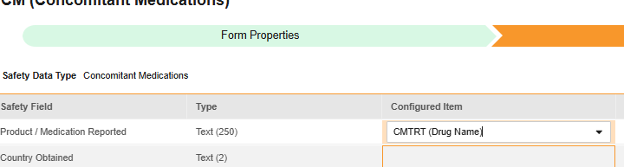
- 구성된 아이템과 안전성 필드의 데이터 유형에 따라 값 번역을 제공해야 할 수 있습니다. 지침은 위의 값 번역 섹션을 참조하십시오.
- 저장을 클릭하여 페이지에 남아 있거나, 저장 및 다음을 클릭하여 다음 탭인 포함 기준으로 이동합니다.
| EDC 안전성 데이터 유형 | EDC 필드 레이블 | 필드 데이터 유형 | 메모 | 관련 E2B(R3) 위치 | 받은 편지함/ 사례 오브젝트 및 필드 |
EDC 필드 식별자 |
|---|---|---|---|---|---|---|
| 병용약물 | 보고된 제품/의약품 | 텍스트(250) |
|
G.k.2.2 | case_product__v, product_reported__v | CM_REPORTED |
| 병용약물 | 약물을 취득한 국가 | 텍스트(2) |
|
G.k.2.4 | case_product__v, country_obtained__v | CM_COUNTRY_OBTAINED |
| 병용약물 | 임신 노출 번호 | 정밀한 숫자(3,3) |
|
G.k.6a | case_product__v, gestation_exposure_number__v | CM_GESTATION |
| 병용약물 | 임신 노출 단위 | 매핑된 값 |
|
G.k.6b | case_product__v, gestation_exposure_unit__v | CM_GESTATION_UNIT |
| 병용약물 | 장치 이름 | 텍스트(1000) |
|
case_product__v, device_name_part__v | CM_DEVICE_NAME | |
| 병용약물 | 평가된 장치 | 매핑된 값 |
|
case_product__v, device_evaluated__v | CM_DEVICE_EVALUATED | |
| 병용약물 | 장치 사용 유형 | 매핑된 값 |
|
case_product__v, device_usage_type__v | CM_DEVICE_USAGE_TYPE | |
| 병용약물 | 장치 이식 날짜 | 날짜/날짜 시간 |
|
case_product__v, date_implanted_idate__v | CM_IMPLANTED_DATE | |
| 병용약물 | 장치 외식 날짜 | 날짜/날짜 시간 |
|
case_product__v, date_explanted_idate__v | CM_DEVICE_EXPLANTED_DATE | |
| 병용약물 | 장치 사용 기간 | 정밀한 숫자(5,4) |
|
case_product__v, date_age__v | CM_DEVICE_AGE | |
| 병용약물 | 장치 사용 기간(단위) | 매핑된 값 |
|
case_product__v, device_age_unit__v | CM_DEVICE_AGE_UNIT | |
| 병용약물 | 추가 정보 코딩됨 | 매핑된 값 |
|
G.K.10.r | case_product__v, additional_information_coded__v | CM_ADDITIONAL_INFO_CODED |
| 병용약물 | 시작 일자 | 날짜/날짜 시간 |
|
G.k.4.r.4 | case_product_dosage__v, firstadmin_idate__v | CM_START_DATE |
| 병용약물 | 종료 일자 | 날짜/날짜 시간 |
|
G.k.4.r.5 | case_product_dosage__v, lastadmin_idate__v | CM_END_DATE |
| 병용약물 | 조제 기간 값 | 정밀한 숫자(5,3) |
|
G.k.4.r.6a | case_product_dosage__v, duration_number__v | CM_DURATION_VALUE |
| 병용약물 | 조제 기간 값(단위) | 매핑된 값 |
|
G.k.4.r.6b | case_product_dosage__v, duration_unit__v | CM_DURATION_UNIT |
| 병용약물 | 투여량 값(숫자) | 정밀한 숫자(9,3) |
|
G.k.4.r.1a | case_product_dosage__v, dose_number__v | CM_DOSE_VALUE_NUMBER |
| 병용약물 | 투여량 값(텍스트) | 텍스트(2000) |
|
G.k.4.r.8 | case_product_dosage__v, dose_text__v | CM_DOSE_VALUE_TEXT |
| 병용약물 | 투여량 단위(코드) | 매핑된 값 |
|
G.k.4.r.1b | case_product_dosage__v, dose_unit__v | CM_DOSE_UNIT_CODE |
| 병용약물 | 투여량 단위(텍스트) | 텍스트(50) |
|
G.k.4.r.8 | case_product_dosage__v, dose_unit_text__v | CM_DOSE_UNIT_TEXT |
| 병용약물 | 빈도 값 | 정밀한 숫자(4,8) |
|
G.k.4.r.2 | case_product_dosage__v, frequency_number__v | CM_FREQUENCY_VALUE |
| 병용약물 | 빈도 단위 | 매핑된 값 |
|
G.k.4.r.3 | case_product_dosage__v, frequency_unit__v | CM_FREQUENCY_UNIT |
| 병용약물 | 경로(코드) | 매핑된 값 |
|
G.k.4.r.10.2b | case_product_dosage__v, patient_adminroute__v | CM_ROUTE_CODE |
| 병용약물 | 경로(텍스트) | 텍스트(60) |
|
G.k.4.r.10.1 | case_product_dosage__v, patient_adminroute_text__v | CM_ROUTE_TEXT |
| 병용약물 | 경로 용어 ID | 텍스트(50) |
|
G.k.4.r.10.2b | case_product_dosage__v, patient_adminroute_termid__v | CM_ROUTE_TERM_ID |
| 병용약물 | 경로 용어 ID 버전 | 텍스트(50) |
|
G.k.4.r.10.2a | case_product_dosage__v, patient_adminroute_termid_version__v | CM_ROUTE_TERM_ID_VERSION |
| 병용약물 | 조제 사이트 | 매핑된 값 |
|
case_product_dosage__v, anatomical_site__v | CM_SITE_OF_DISPENSE | |
| 병용약물 | 배치/로트 번호 | 텍스트(35) |
|
G.k.4.r.7 | case_product_dosage__v, batchlot_number__v | CM_BATCH_LOT_NUMBER |
| 병용약물 | 투여 폼 용어 ID | 텍스트(50) |
|
G.k.4.r.9.2a | case_product_dosage__v, dose_form_termid__v | CM_DOSE_FORM_TERM_ID |
| 병용약물 | 투여 폼 용어 ID 버전 | 텍스트(50) |
|
G.k.4.r.9.1 | case_product_dosage__v, dose_form_termid_version__v | CM_DOSE_FORM_TERM_ID_VERSION |
| 병용약물 | 투여 폼(텍스트) | 텍스트(50) |
|
G.k.4.r.9.2b | case_product_dosage__v, dose_form_text__v | CM_DOSE_FORM_TEXT |
| 병용약물 | 상위 경로(텍스트) | 텍스트(60) |
|
G.k.4.r.11.1 | case_product_dosage__v, parent_adminroute_text__v | CM_PARENT_ROUTE_TEXT |
| 병용약물 | 상위 경로(코드) | 매핑된 값 |
|
G.k.4.r.11.2b | case_product_dosage__v, parent_adminroute__v | CM_PARENT_ROUTE_CODE |
| 병용약물 | 상위 경로 용어 ID | 텍스트(50) |
|
G.k.4.r.11.2b | case_product_dosage__v, parent_adminroute_termid__v | CM_PARENT_ROUTE_TERM_ID |
| 병용약물 | 상위 경로 용어 ID 버전 | 텍스트(50) |
|
G.k.4.r.11.2a | case_product_dosage__v, parent_adminroute_termid_version__v | CM_PARENT_ROUTE_TERM_ID_VERSION |
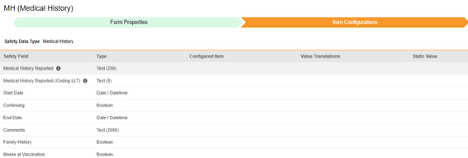
Medical History
이 유형의 안전성 구성은 스터디의 병력 폼에 적용됩니다. 정보는 Veeva Safety의 병력 및 동반 질환 섹션으로 전달됩니다.
이 안전성 데이터 유형에 대한 아이템 구성 단계를 수행하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
-
매핑할 각 행에 대해 구성된 아이템 열의 셀을 사용하여 적절한 아이템 정의를 선택합니다. 예를 들어 아래 그림에 표시된 보고된 병력(Medical History Reported) 위치의 폼에서 MHTERM 아이템을 선택합니다. 아이템 선택 시 선택 항목은 일반적으로 이전에 저장된 폼 속성 > 다음에 포함된 모든 입력의 설정에 따라 달라집니다. 일부 안전성 위치에는 반복 아이템 그룹 또는 반복되지 않는 아이템 그룹에서만 수행할 수 있거나 때로는 둘 중 하나에서 수행할 수 있음을 나타내는 특별 규칙이 있습니다. 이러한 특이값은 이 단계의 끝에 있는 표와 이 유형의 모든 안전성 위치에 대한 중요한 참고 사항을 참조하십시오.
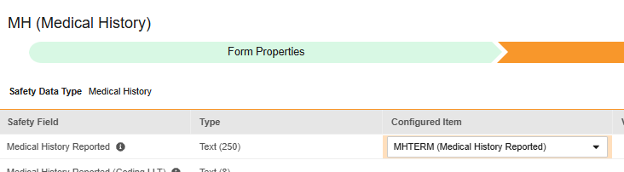
- 구성된 아이템과 안전성 필드의 데이터 유형에 따라 값 번역을 제공해야 할 수 있습니다. 지침은 위의 값 번역 섹션을 참조하십시오.
- 저장을 클릭하여 페이지에 남아 있거나, 저장 및 다음을 클릭하여 다음 탭인 포함 기준으로 이동합니다.
| EDC 안전성 데이터 유형 | EDC 필드 레이블 | 필드 데이터 유형 | 메모 | 관련 E2B(R3) 위치 | 받은 편지함/ 사례 오브젝트 및 필드 |
EDC 필드 식별자 |
|---|---|---|---|---|---|---|
| Medical History | 보고된 병력 | 텍스트(250) |
|
D.7.1.r.5(코멘트에서 자주 보고되는 용어) | case_medical_history__v, name_reported__v | MH_REPORTED |
| Medical History | 보고된 병력(코딩 LLT) | 텍스트(8) |
|
D.7.1.r.1a / D.7.1.r.1b | case_medical_history__v, name_meddra__v | MH_REPORTED_LLT |
| Medical History | 시작 일자 | 날짜/날짜 시간 |
|
D.7.1.r.2 | case_medical_history__v, startdate_idate__v | MH_START_DATE |
| Medical History | 계속 진행 | 불린(Boolean) |
|
D.7.1.r.3 | case_medical_history__v, continuing_value__v | MH_CONTINUING |
| Medical History | 종료 일자 | 날짜/날짜 시간 |
|
D.7.1.r.4 | case_medical_history__v, enddate_idate__v | MH_END_DATE |
| Medical History | 코멘트 | 텍스트(2000) |
|
D.7.1.r.5 | case_medical_history__v, comments__v | MH_COMMENTS |
| Medical History | 가족력 | 불린(Boolean) |
|
D.7.1.r.6 | case_medical_history__v, family_history__v | MH_FAMILY_HISTORY |
| Medical History | 백신 접종 시 발생 질병 | 불린(Boolean) |
|
case_medical_history__v, illness_at_vaccination__v | MH_ILLNESS_AT_VACCINATION |
약물력
이 유형의 안전성 구성은 스터디의 약물력 폼에 적용됩니다. 정보는 Veeva Safety의 약물력 섹션으로 전달됩니다.
이 안전성 데이터 유형에 대한 아이템 구성 단계를 수행하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
-
매핑할 각 행에 대해 구성된 아이템 열의 셀을 사용하여 적절한 아이템 정의를 선택합니다. 예를 들어 아래 그림에 표시된 보고된 약물력(Drug History Reported) 위치의 폼에서 DH_REPORTED 아이템을 선택합니다. 아이템 선택 시 선택 항목은 일반적으로 이전에 저장된 폼 속성 > 다음에 포함된 모든 입력의 설정에 따라 달라집니다. 일부 안전성 위치에는 반복 아이템 그룹 또는 반복되지 않는 아이템 그룹에서만 수행할 수 있거나 때로는 둘 중 하나에서 수행할 수 있음을 나타내는 특별 규칙이 있습니다. 이러한 특이값은 이 단계의 끝에 있는 표와 이 유형의 모든 안전성 위치에 대한 중요한 참고 사항을 참조하십시오.
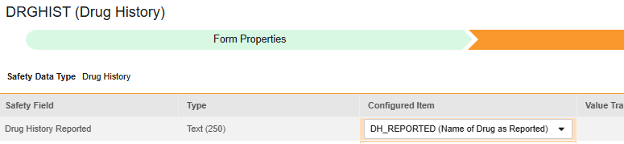
- 구성된 아이템과 안전성 필드의 데이터 유형에 따라 값 번역을 제공해야 할 수 있습니다. 지침은 위의 값 번역 섹션을 참조하십시오.
- 저장을 클릭하여 페이지에 남아 있거나, 저장 및 다음을 클릭하여 다음 탭인 포함 기준으로 이동합니다.
| EDC 안전성 데이터 유형 | EDC 필드 레이블 | 필드 데이터 유형 | 메모 | 관련 E2B(R3) 위치 | 받은 편지함/ 사례 오브젝트 및 필드 |
EDC 필드 식별자 |
|---|---|---|---|---|---|---|
| 약물력 | 보고된 약물력 | 텍스트(250) |
|
D.8.r.1 | case_drug_history__v, name_reported__v | DH_REPORTED |
| 약물력 | 시작 일자 | 날짜/날짜 시간 |
|
D.8.r.4 | case_drug_history__v, startdate_idate__v | DH_START_DATE |
| 약물력 | 종료 일자 | 날짜/날짜 시간 |
|
D.8.r.5 | case_drug_history__v, enddate_idate__v | DH_END_DATE |
| 약물력 | 백신 접종 연령/사용 | 숫자(3) |
|
case_drug_history__v, age_at_vaccination_number__v | DH_AGE_AT_USE | |
| 약물력 | 백신 접종 연령/사용 단위 | 매핑된 값 |
|
case_drug_history__v, age_at_vaccination_unit__v | DH_AGE_AT_USE_UNIT | |
| 약물력 | 제품 유형 | 매핑된 값 |
|
case_drug_history__v, product_type__v | DH_PRODUCT_TYPE | |
| 약물력 | 보고된 적응증 | 텍스트(250) |
|
D.8.r.6a, D.8.r.6b | case_drug_history__v, indication_reported__v | DH_INDICATION |
| 약물력 | 보고된 반응 | 텍스트(250) |
|
D.8.r.7a, D.8.r.7b | case_drug_history__v, reaction_reported__v | DH_REACTION |
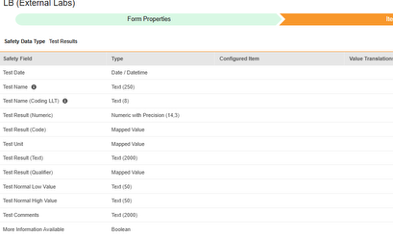
시험 결과
이 유형의 안전성 구성은 스터디의 실험실/시험 결과 폼에 적용됩니다. 정보는 Veeva Safety의 시험 결과 섹션으로 전달됩니다.
이 안전성 데이터 유형에 대한 아이템 구성 단계를 수행하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
-
매핑할 각 행에 대해 구성된 아이템 열의 셀을 사용하여 적절한 아이템 정의를 선택합니다. 예를 들어 아래 그림에 표시된 테스트 날짜(Test Date) 위치의 폼에서 LBDT 아이템을 선택합니다. 아이템 선택 시 선택 항목은 일반적으로 이전에 저장된 폼 속성 > 다음에 포함된 모든 입력의 설정에 따라 달라집니다. 일부 안전성 위치에는 반복 아이템 그룹 또는 반복되지 않는 아이템 그룹에서만 수행할 수 있거나 때로는 둘 중 하나에서 수행할 수 있음을 나타내는 특별 규칙이 있습니다. 이러한 특이값은 이 단계의 끝에 있는 표와 이 유형의 모든 안전성 위치에 대한 중요한 참고 사항을 참조하십시오.
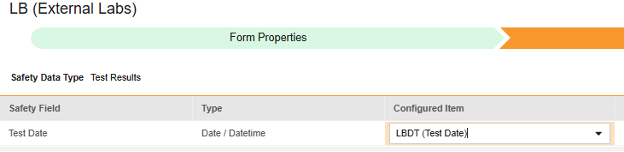
- 구성된 아이템과 안전성 필드의 데이터 유형에 따라 값 번역을 제공해야 할 수 있습니다. 지침은 위의 값 번역 섹션을 참조하십시오.
- 저장을 클릭하여 페이지에 남아 있거나, 저장 및 다음을 클릭하여 다음 탭인 포함 기준으로 이동합니다.
| EDC 안전성 데이터 유형 | EDC 필드 레이블 | 필드 데이터 유형 | 메모 | 관련 E2B(R3) 위치 | 받은 편지함/ 사례 오브젝트 및 필드 |
EDC 필드 식별자 |
|---|---|---|---|---|---|---|
| 시험 결과 | 검사 날짜 | 날짜/날짜 시간 |
|
F.r.1 | case_test_result__v, date_idate__v | LAB_DATE |
| 시험 결과 | 검사 이름 | 텍스트(250) |
|
F.r.2.1 | case_test_result__v, name_reported__v | LAB_TEST_NAME |
| 시험 결과 | 검사 이름(코딩 LLT) | 텍스트(8) |
|
F.r.2.2a, F.r.2.2b | case_test_result__v, name_meddra__v | LAB_TEST_NAME_MEDDRA |
| 시험 결과 | 검사 결과(숫자) | 정밀한 숫자(14,3) |
|
F.r.3.2 | case_test_result__v, result_value__v | LAB_RESULT_NUMERIC |
| 시험 결과 | 검사 단위 | 매핑된 값 |
|
F.r.3.3 | case_test_result__v, result_unit__v | LAB_RESULT_UNIT |
| 시험 결과 | 검사 결과(코드) | 매핑된 값 |
|
F.r.3.1 | case_test_result__v, result_code__v | LAB_TEST_RESULT_CODE |
| 시험 결과 | 검사 결과(텍스트) | 텍스트(2000) |
|
F.r.3.4 | case_test_result__v, restult_text__v | LAB_RESULT_TEXT |
| 시험 결과 | 검사 결과(한정자) | 매핑된 값 |
|
F.r.3.2 | case_test_result__v, result_qualifier__v | LAB_RESULT_QUALIFIER |
| 시험 결과 | 낮은 검사 표준 값 | 텍스트(50) |
|
F.r.4 | case_test_result__v, normal_low_value__v | LAB_LOW_VALUE |
| 시험 결과 | 높은 검사 표준 값 | 텍스트(50) |
|
F.r.5 | case_test_result__v, normal_high_value__v | LAB_HIGH_VALUE |
| 시험 결과 | 검사 코멘트 | 텍스트(2000) |
|
F.r.6 | case_test_result__v, comments__v | LAB_COMMENTS |
| 시험 결과 | 사용 가능한 추가 정보 | 불린(Boolean) |
|
F.r.7 | case_test_result__v, more_information_available__v | LAB_MORE_INFO_AVAILABLE |
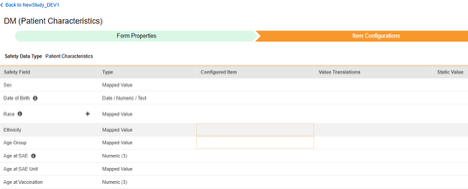
환자 특성
이 유형의 안전성 구성은 대상자에 대한 일반 정보에 적용됩니다. 정보는 Veeva Safety의 환자 섹션으로 전달됩니다.
이 안전성 데이터 유형에 대한 아이템 구성 단계를 수행하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
-
매핑할 각 행에 대해 구성된 아이템 열의 셀을 사용하여 적절한 아이템 정의를 선택합니다. 예를 들어 아래 그림에 표시된 생년월일(Date of Birth) 위치의 폼에서 DOB 아이템을 선택합니다. 아이템 선택 시 선택 항목은 일반적으로 이전에 저장된 폼 속성 > 다음에 포함된 모든 입력의 설정에 따라 달라집니다. 일부 안전성 위치에는 반복 아이템 그룹 또는 반복되지 않는 아이템 그룹에서만 수행할 수 있거나 때로는 둘 중 하나에서 수행할 수 있음을 나타내는 특별 규칙이 있습니다. 이러한 특이값은 이 단계의 끝에 있는 표와 이 유형의 모든 안전성 위치에 대한 중요한 참고 사항을 참조하십시오.
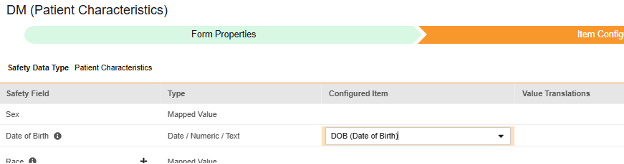
- 구성된 아이템과 안전성 필드의 데이터 유형에 따라 값 번역을 제공해야 할 수 있습니다. 지침은 위의 값 번역 섹션을 참조하십시오.
- 저장을 클릭하여 페이지에 남아 있거나, 저장 및 다음을 클릭하여 다음 탭인 포함 기준으로 이동합니다.
| EDC 안전성 데이터 유형 | EDC 필드 레이블 | 필드 데이터 유형 | 메모 | 관련 E2B(R3) 위치 | 받은 편지함/ 사례 오브젝트 및 필드 |
EDC 필드 식별자 |
|---|---|---|---|---|---|---|
| 환자 특성 | 성별 | 매핑된 값 |
|
D.5 | case_version__v, gender_value__v | |
| 환자 특성 | 생년월일 | 날짜/숫자/텍스트 |
|
D.2.1 | case_version__v, dob_idate__v | PC_DOB |
| 환자 특성 | 인종 | 매핑된 값 |
|
case_version__v, race__v | PC_RACE | |
| 환자 특성 | 민족성 | 매핑된 값 |
|
case_version__v, ethnicity__v | PC_ETHNICITY | |
| 환자 특성 | 연령 그룹 | 매핑된 값 |
|
D.2.3 | case_version__v, age_group__v | PC_AGE_GROUP |
| 환자 특성 | SAE 발생 시 연령 | 숫자(3) |
|
D.2.2a | case_version__v, age_value__v | PC_AGE_VALUE |
| 환자 특성 | SAE 발생 시 연령(단위) | 매핑된 값 |
|
D.2.2b | case_version__v, age_unit__v | PC_AGE_UNIT |
| 환자 특성 | 백신 접종 연령 | 숫자(3) |
|
case_version__v, age_at_vaccination_number__v | PC_AGE_AT_VX | |
| 환자 특성 | 백신 접종 연령(단위) | 매핑된 값 |
|
case_version__v, age_at_vaccination_unit__v | PC_AGE_AT_VX_UNIT | |
| 환자 특성 | 잉태(값) | 숫자(3) |
|
D.2.2.1a | case_version__v, gestation_value__v | PC_GESTATION |
| 환자 특성 | 잉태(단위) | 매핑된 값 |
|
D.2.2.1b | case_version__v, gestation_unit__v | PC_GESTATION_UNIT |
| 환자 특성 | 체중(kg) | 정밀한 숫자(4,4) |
|
D.3 | case_version__v, weight_normalized__kg__v | PC_WEIGHT_KG |
| 환자 특성 | 키(cm) | 정밀한 숫자(4,3) |
|
D.4 | case_version__v, height_normalized__cm__v | PC_HEIGHT_CM |
| 환자 특성 | 환자 이름 또는 이니셜 | 텍스트(60) |
|
D.1 | case_version__v, patient_id_value__v | PC_NAME_OR_INITIALS |
| 환자 특성 | GP 의료 레코드 번호 | 텍스트(20) |
|
D.1.1.1 | case_version__v, mrn_gp_value__v | PC_GPRN |
| 환자 특성 | 병원 레코드 번호 | 텍스트(20) |
|
D.1.1.3 | case_version__v, mrn_hospital_value__v | PC_HRN |
| 환자 특성 | 임상 검사 레코드 번호 | 텍스트(20) |
|
D.1.1.4 | case_version__v, mrn_investigation_value__v | PC_IRN |
| 환자 특성 | 전문가 레코드 번호 | 텍스트(20) |
|
D.1.1.2 | case_version__v, mrn_specialist__value | PC_SRN |
| 환자 특성 | 무작위 배정 번호 | 텍스트(20) |
|
case_version__v, patient_randomization_number__v | PC_RAND_NUM | |
| 환자 특성 | 마지막 생리 날짜 | 날짜 |
|
D.6 | case_version__v, last_menstrual_date | PC_LAST_MENSTRUAL_DATE |
| 환자 특성 | 임신 횟수 | 숫자(2) |
|
case_version__v, gravida_gravidity__v | ||
| 환자 특성 | 출생 횟수 | 숫자(2) |
|
case_version__v, para_parity__v | AE_PREG_INFO_PARA | |
| 환자 특성 | SAE 발생 시 임신 상태 | 불린(Boolean) |
|
case_version__v, pregnancy_case__v | PC_PREG_CASE | |
| 환자 특성 | 백신 접종 시 임신 상태 | 불린(Boolean) |
|
case_version__v, pregnant_at_vaccination__v | PC_PREG_AT_VX | |
| 환자 특성 | 임신 날짜 | 날짜 |
|
case_version__v, pregnancy_conception_date__v | AE_PREG_INFO_CON_DT | |
| 환자 특성 | 임신 예정일 | 날짜 |
|
case_version__v, pregnancy_due_date__v | AE_PREG_INFO_DUE_DT | |
| 환자 특성 | 임신 결과 | 매핑된 값 |
|
case_version__v, pregnancy_outcome__v | AE_PREG_INFO_OUTCOME | |
| 환자 특성 | 분만 방법 | 매핑된 값 |
|
case_version__v, delivery_method__v | AE_PREG_INFO_DELV_METH | |
| 환자 특성 | 임신 결과 날짜 | 날짜 |
|
case_version__v, date_of_pregnancy_outcome__v | AE_PREG_INFO_OUTCOME_DT | |
| 환자 특성 | 상위 항목 대상자 번호 | 텍스트(128) |
|
case_version__v, parent_subject_number__v | PC_PARENT_SUBNUM | |
| 환자 특성 | 일반 병력 | 텍스트(10000) |
|
D.7.2 | case_version__v, medical_history_text__v | PC_MH_TEXT |
| 환자 특성 | 대상자는 병용약물 요법이 있습니다. | 불린(Boolean) |
|
, | PC_CON_THERAPY |
사망 시
이 유형의 안전성 구성은 대상자에 대한 사망 세부 사항과 관련된 폼에 적용됩니다. 이 유형의 일부 필드는 반복되지 않아야 하며(예: 사망 날짜), 다른 필드는 반복되거나 반복되지 않을 수 있습니다(사망 원인). 정보는 Veeva Safety의 두 곳, 즉 환자 또는 사망 원인으로 전달됩니다.
이 안전성 데이터 유형에 대한 아이템 구성 단계를 수행하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
-
매핑할 각 행에 대해 구성된 아이템 열의 셀을 사용하여 적절한 아이템 정의를 선택합니다. 예를 들어 아래 그림에 표시된 사망 날짜(Date of Death) 위치의 폼에서 DTHDT 아이템을 선택합니다. 아이템 선택 시 선택 항목은 일반적으로 이전에 저장된 폼 속성 > 다음에 포함된 모든 입력의 설정에 따라 달라집니다. 일부 안전성 위치에는 반복 아이템 그룹 또는 반복되지 않는 아이템 그룹에서만 수행할 수 있거나 때로는 둘 중 하나에서 수행할 수 있음을 나타내는 특별 규칙이 있습니다. 이러한 특이값은 이 단계의 끝에 있는 표와 이 유형의 모든 안전성 위치에 대한 중요한 참고 사항을 참조하십시오.
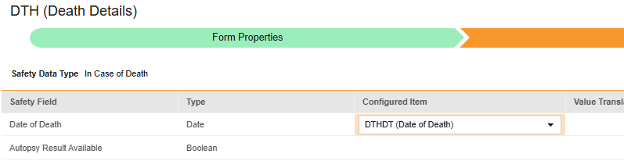
- 구성된 아이템과 안전성 필드의 데이터 유형에 따라 값 번역을 제공해야 할 수 있습니다. 지침은 위의 값 번역 섹션을 참조하십시오.
- 완료되면 저장을 클릭하거나, 저장 및 다음을 클릭하여 포함 기준 단계로 진행합니다.
| EDC 안전성 데이터 유형 | EDC 필드 레이블 | 필드 데이터 유형 | 메모 | 관련 E2B(R3) 위치 | 받은 편지함/ 사례 오브젝트 및 필드 |
EDC 필드 식별자 |
|---|---|---|---|---|---|---|
| 사망 시 | 사망일 | 날짜 |
|
D.9.1 | case_version__v, dod_idate__v | ICD_DEATH_DT |
| 사망 시 | 부검 결과 확인 가능 | 불린(Boolean) |
|
D.9.3 | case_version__v, autopsy_value__v | ICD_AUTOPSY_RES |
| 사망 시 | 부검 결과 생략 이유 | 매핑된 값 |
|
case_version__v, autopsy_reason_omitted__v | ICD_AUTOPSY_REAS_OMIT | |
| 사망 시 | 사망 원인 - 유형 | 매핑된 값 |
|
D.9.2.r, D.9.4.r | case_cause_of_death__v, type__v | ICD_CASE_TYPE |
| 사망 시 | 사망 원인 - 보고됨 | 텍스트(250) |
|
D.9.2.r, D.9.4.r | case_cause_of_death__v, name_reported__v | ICD_CAUSE_REPORTED |
| 사망 시 | 사망 원인 - 보고됨(코딩 LLT) | 텍스트(8) |
|
D.9.2.r, D.9.4.r | case_cause_of_death__v, name_meddra__v | ICD_CAUSE_LLT |
포함 기준
포함 기준은 안전성 사례 데이터 전송을 시작하는 기본 이벤트 이외에 안전성 사례에 매핑된 아이템 값을 포함할지 결정하는 데 평가됩니다.
메모/개념:
- 포함 기준은 다음과 같은 경우에만 평가됩니다.
- 폼 속성 탭에서 모든 포함 기준, 특히 키 안전성 아이템이 true로 평가됩니다.
- (AND)
- 아이템 구성 탭에서 필수 아이템의 EDC 폼에 비어 있지 않은 값이 있습니다.
- 폼 속성 탭에서 모든 포함 기준, 특히 키 안전성 아이템이 true로 평가됩니다.
- 추가 기준에는 유형의 모든 폼이 포함될 수 있으며, 사이트 사용자 작업(연결) 및/또는 날짜 비교를 기반으로 할 수 있습니다. 이러한 구성은 유형, 특정 폼 및/또는 스터디에 따라 다를 수 있습니다.
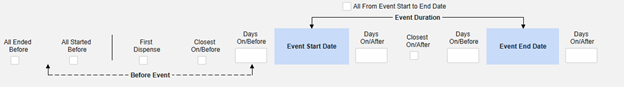
- 포함 기준 탭의 조건은 평가 시 "OR"로 간주됩니다. 즉, 일련의 적용 가능한 기준 중 하나라도 true이면 다른 기준이 false로 평가("Out")된 것과 관계없이 평가는 "In"입니다.
- 사례에 포함하기 위한 안전성 사례 시작 이벤트 종료 날짜와의 비교가 구성되었지만 데이터 입력 화면에서 날짜가 설정되지 않은 경우, 이벤트 종료 날짜는 열린 상태로 평가에 사용됩니다. 기본 이벤트(또는 관련 폼)에 종료 날짜가 입력되면 시스템은 포함 기준을 재평가하고, 적절한 경우 수정 팔로우업을 전송합니다.
- 포함 기준은 모든 관련 안전성 유형에 적용됩니다.
- 안전성 사례 시작 이벤트
- 스터디 약물
- 병용약물
- Medical History
- 약물력
- 시험 결과
데이터 유형별 옵션 요약
| 포함 기준 | 안전성 데이터 유형 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| SCIE | 스터디 약물 | Con Meds | Med Hist | Drug Hist | Test Res | Pat Chars | 사망 시 | ||
| 모두 | |||||||||
| 사이트 사용자가 연결 | |||||||||
| 시작에서 종료가 안전성 이벤트 시작에서 종료와 겹침 | |||||||||
| 안전성 이벤트 시작 X일 전에 시작과 종료가 겹침 | |||||||||
| 안전성 이벤트 시작 X일 전에 시작과 종료가 겹침 | |||||||||
| 안전성 이벤트 종료 X일 전에 시작과 종료가 겹침 | |||||||||
| 안전성 이벤트 종료 X일 후에 시작과 종료가 겹침 | |||||||||
| 첫 번째 조제 | |||||||||
| 안전성 이벤트 시작 시/시작 전 가장 가까운 시간 | |||||||||
| 안전성 이벤트 시작 시/시작 후 가장 가까운 시간 | |||||||||
| 안전성 이벤트 시/전 가장 가까운 시간(하나만 해당) | |||||||||
| 안전성 이벤트 시작 전 약물 조제 시작 | |||||||||
| 안전성 이벤트 시작 전에 종료됨 | |||||||||
| 항상 | * | * | |||||||
|
이 포함 기준을 안전성 데이터 유형에 사용할 수 있음을 나타냅니다. * 이 포함 기준을 안전성 데이터 유형에 대해 수정할 수 없음을 나타냅니다. |
|||||||||
표 헤더는 안전성 데이터 유형을 축약한 형태입니다.
- SCIE: 안전성 사례 시작 이벤트
- ConMeds: 병용약물
- Med Hist: 병력
- Drug Hist: 약물력
- Test Res: 시험 결과
- Pat Chars: 환자 특성
옵션 의미/예
아래에 모든 기준 옵션이 요약되어 있습니다. 각 날짜 기반 옵션에는 사용법을 설명하기 위해 일련의 예시가 포함되어 있습니다.
안전성 데이터 유형별
안전성 사례 시작 이벤트
안전성 사례 시작 이벤트는 안전성 사례 전송 프로세스를 시작하는 기본 이벤트입니다. 이후 다른 모든 관련 이벤트는 구성된 기준에 따라 사례로 가져옵니다. 선호도 및 스터디 디자인에 따라 시작 이벤트는 시작 폼의 다른 데이터를 포함하거나 동일한 유형의 다른 이벤트/폼과 관련될 수 있지만, 그 자체로는 자체 안전성 사례를 구성하지 않습니다(예: 시작 심각한 이벤트에 연결된 기타 심각하지 않은 사건).
일반적인 실제 예:
- 월요일에 대상자는 심각하지 않은 이상 사례 "두통"(AE 폼 #1)을 경험합니다.
- 수요일에 대상자는 심각한 이상 사례 "어지러움"(AE 폼 #2)을 경험합니다.
- 시스템은 수요일 이벤트("어지러움")에 대한 안전성 사례를 새 안전성 사례의 기본 시작 이벤트로 전송합니다. 또한 시스템은 구성된 포함 기준에 따라 월요일 이벤트의 데이터를 동일한 안전성 사례의 두 번째 이벤트로 추가합니다. 이는 당일/이전 = 2(또는 그 이상)를 사용하기 때문에 발생합니다.
이 안전성 유형에 대한 포함 기준을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
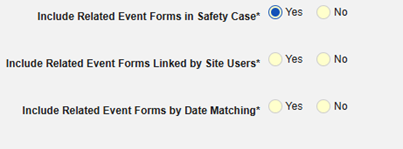
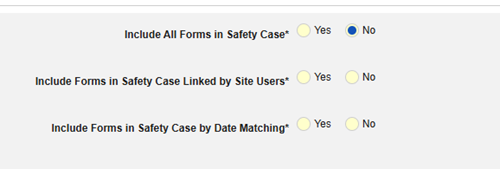
- 안전성 사례에 관련 이벤트 폼 포함:
- 사이트 사용자가 링크한 관련 이벤트 폼 포함: 사이트에서 기본 시작 이벤트에 연결한 이벤트를 사례에 포함하려면 예를 선택합니다. 경고: 예로 설정하는 경우, 폼에 폼-폼 또는 아이템-폼 연결 또한 구성되어야 합니다.
-
날짜 매칭을 통한 관련 이벤트 폼 포함: 하나 이상의 날짜 기반 기준에 따라 포함을 위해 관련 이벤트의 데이터를 평가하려면 예를 선택합니다.
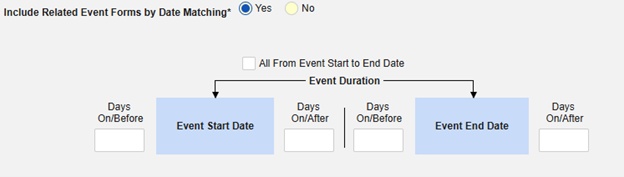
- 옵션을 선택하거나 특정 일수(Days) 값을 설정합니다. 다음 옵션 중 하나 이상을 선택/설정해야 합니다.
- 저장하고 닫기를 클릭하여 완료합니다.
각 포함 기준 옵션에 대한 자세한 내용과 예시는 위의 옵션 의미 및 예시를 참조하십시오.
스터디 약물
이러한 유형의 안전성 구성은 시작 이벤트(즉, 임상 스터디가 대상자에 대해 테스트할 때의 기준)와 관련하여 스터디 약물의 투약/조제 정보를 추적하는 데 사용됩니다. 정보는 안전성 사례의 제품/약물 섹션으로 전달됩니다.
실제 예:
- 3월 1일에 대상자는 스터디 약물 활성 대 위약(Active vs Placebo)(눈가림한 스터디 약물)의 첫 번째 조제를 받습니다.
- 3월 3일에 대상자는 또 다른 조제를 받습니다.
- 3월 5일에 대상자는 또 다른 조제를 받습니다.
- 3월 6일에 대상자는 심각한 이상 사례("어지러움")를 경험하고, 사이트에서 AE 폼에 입력합니다.
- 시스템은 "어지러움"을 기본 이벤트로 사용하여 안전성 사례를 생성하고 전송합니다.
- 스터디는 안전성 사례에 조제의 하위 세트를 포함하도록 구성됩니다. 한 가지 구성 예로 3월 1일(전체 첫 번째) 및 3월 5일(가장 가까운 날짜/이전)이 있습니다. 구성된 기준에 따라 다른 조제는 포함되지 않습니다.
이 안전성 유형에 대한 포함 기준을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
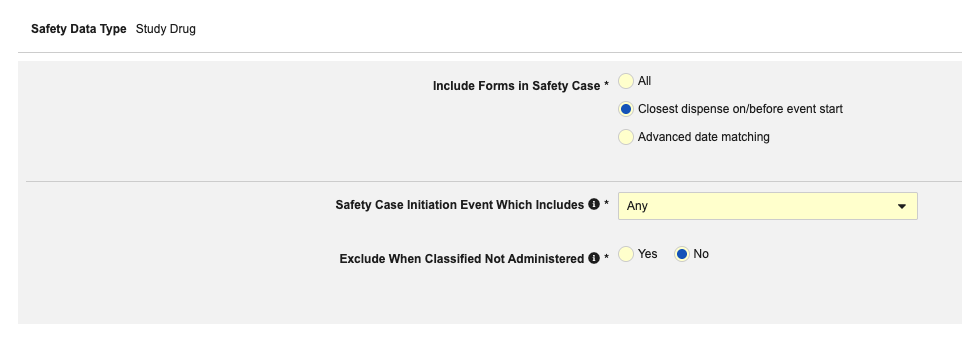
- 안전성 사례의 폼 포함:
- 약물이 투여되지 않을 때(약물 역할이 "약물 투여되지 않음"으로 설정됨) 안전성 사례에서 스터디 약물 정보를 제외하려면, 투여되지 않음 분류 시 제외(Exclude When Classified Not Administered)에 대해 이 설정을 예로 둡니다. 그렇지 않으면 아니요를 선택합니다.
- 저장하고 닫기를 클릭하여 완료합니다.
각 포함 기준 옵션에 대한 자세한 내용과 예시는 위의 옵션 의미 및 예시를 참조하십시오.
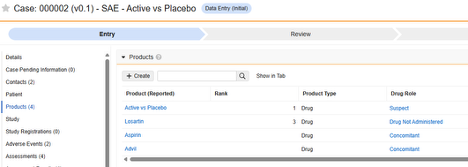
Concomitant Medications
이 유형의 안전성 구성은 스터디의 병용약물 폼에 적용됩니다. 정보는 안전성 사례의 제품/약물 섹션으로 전달됩니다.
이 유형과 함께 여러 폼을 사용할 수 있습니다.
실제 예:
- 3월 1일에 대상자는 하루에 한 번 복용하는 Veeofen을 시작하지만 3월 3일에 중단합니다.
- 3월 3일에 대상자는 하루에 한 번 복용하는 Natevba를 시작하며, 종료 날짜는 없습니다(여전히 복용 중임).
- 3월 5일에 대상자는 Deetoza를 1회 복용합니다(종료 날짜도 3월 5일).
- 3월 7일에 대상자는 심각한 이상 사례("어지러움")를 경험하고, 사이트에서 AE 폼에 입력합니다.
- 시스템은 "어지러움"을 기본 이벤트로 사용하여 안전성 사례를 생성하고 전송합니다.
- 스터디 디자인은 다음 두 가지 규칙을 사용하여 병용약물을 가져오도록 규정합니다.
- "SAE 시작 시 진행 중인 모든 항목"
- "중지되었지만 SAE 시작 후 3일 이내에 중지된 항목"
- 결과: 3월 3일 Natevba(진행 중)와 3월 5일 Deetoza(2일 전 종료됨)가 모두 사례에 포함됩니다. 다른 하나인 3월 1일 Aspirin은 사례에 포함되지 않습니다(종료된 지 3일이 넘었기 때문).
이 안전성 유형에 대한 포함 기준을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
- 다음 옵션 중에서 선택합니다.
- 안전성 사례에 모든 폼 포함(기본값은 아니요): 예를 선택하면 현재 병용약물을 모두 사례에 포함하고 다른 모든 옵션을 비활성화합니다.
- 사이트 사용자가 링크한 관련 이벤트 폼 포함: 사이트에서 기본 시작 이벤트에 연결한 병용약물을 사례에 포함하려면 예를 선택합니다. 경고: 예로 설정하는 경우, 폼에 폼-폼 또는 아이템-폼 연결 또한 구성되어야 합니다.
- 사이트 사용자가 링크한 안전성 사례에 폼 포함하기: 경고에 대해 예 또는 아니요 선택: 예로 설정하는 경우, 폼에 폼-폼 또는 아이템-폼 연결 또한 구성되어야 합니다.
-
날짜 일치를 통해 안전성 사례에 폼 포함하기에 대해 예 또는 아니요를 선택합니다. 예로 설정하면 시스템은 하나 이상의 기준을 사용하여 안전성 사례 이벤트(기본)와 관련 데이터(현재 구성 중인 폼, 시작 및 종료 범위)의 시작-종료 범위를 비교합니다.
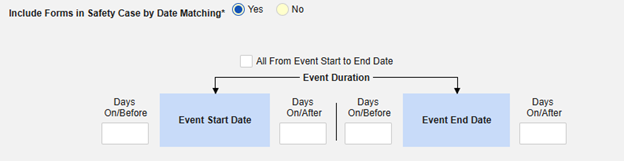
- 옵션을 선택하거나 특정 일수(Days) 값을 설정합니다. 다음 옵션 중 하나 이상을 선택/설정해야 합니다.
- 저장하고 닫기를 클릭하여 완료합니다.
각 포함 기준 옵션에 대한 자세한 내용과 예시는 위의 옵션 의미 및 예시를 참조하십시오.
Medical History
이 유형의 안전성 구성은 스터디의 병력 폼에 적용됩니다.
실제 예:
- 2024년 1월에 대상자는 처음으로 "경미한 어지러움"을 경험하기 시작했습니다. 병력은 진행 중인 것으로 간주됩니다(종료 날짜 없음).
- 두 번째 병력은 2024년 4월부터 2024년 5월까지 "등허리 통증"을 나타냅니다.
- 세 번째 병력은 2024년 6월과 2024년 11월 말의 "편두통"을 나타냅니다.
- 2025년 3월 7일에 대상자는 심각한 이상 사례("어지러움")를 경험하고, 사이트에서 AE 폼에 입력합니다.
- 시스템은 "어지러움"을 기본 이벤트로 사용하여 안전성 사례를 생성하고 전송합니다.
- 스터디 디자인은 다음 두 가지 규칙을 사용하여 병력을 가져오도록 규정합니다.
- "SAE 시작 시 진행 중인 모든 항목"
- "중지되었지만 SAE 시작 후 182일 이내에 중지된 항목"
- 결과: "경미한 어지러움"(진행 중)과 "편두통"(종료되었지만 1년 이내)이 모두 사례에 포함됩니다. 다른 하나인 "등허리 통증"은 사례에 포함되지 않습니다(종료된 지 180일이 넘었기 때문).
이 안전성 유형에 대한 포함 기준을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
- 다음 옵션 중에서 선택합니다.
- 안전성 사례에 모든 폼 포함(기본값은 아니요): 예를 선택하면 현재 병용약물을 모두 사례에 포함하고 다른 모든 옵션을 비활성화합니다.
- 사이트 사용자가 링크한 관련 이벤트 폼 포함: 사이트에서 기본 시작 이벤트에 연결한 병용약물을 사례에 포함하려면 예를 선택합니다. 경고: 예로 설정하는 경우, 폼에 폼-폼 또는 아이템-폼 연결 또한 구성되어야 합니다.
- 사이트 사용자가 링크한 안전성 사례에 폼 포함하기: 경고에 대해 예 또는 아니요 선택: 예로 설정하는 경우, 폼에 폼-폼 또는 아이템-폼 연결 또한 구성되어야 합니다.
-
날짜 일치를 통해 안전성 사례에 폼 포함하기에 대해 예 또는 아니요를 선택합니다. 예로 설정하면 시스템은 하나 이상의 기준을 사용하여 안전성 사례 이벤트(기본)와 관련 데이터(현재 구성 중인 폼, 시작 및 종료 범위)의 시작-종료 범위를 비교합니다.
- 옵션을 선택하거나 특정 일수(Days) 값을 설정합니다. 다음 옵션 중 하나 이상을 선택/설정해야 합니다.
- 저장하고 닫기를 클릭하여 완료합니다.
각 포함 기준 옵션에 대한 자세한 내용과 예시는 위의 옵션 의미 및 예시를 참조하십시오.
약물력
이 유형의 안전성 구성은 스터디의 약물력 폼에 적용됩니다. 정보는 Veeva Safety의 약물력 섹션으로 전달됩니다.
실제 예:
- 스터디 디자인은 스크리닝 방문 시 연구자가 적절하다고 간주하는 약물력 정보 및/또는 임상시험계획서에 따른 약물력 정보를 수집합니다. 이 정보는 특히 대상자가 임상 시험에 참여하기 전에 복용(및 종료)된 약물/제품입니다.
- 2025년 3월 7일에 대상자는 심각한 이상 사례("어지러움")를 경험하고, 사이트에서 AE 폼에 입력합니다.
- 시스템은 "어지러움"을 기본 이벤트로 사용하여 안전성 사례를 생성하고 전송합니다.
- 이러한 유형의 안전성 데이터에 대한 스터디 구성에 따라, 대상자가 경험하는 모든 안전성 사례에 모두 포함되어야 합니다.
- 혹은 날짜 기반 및/또는 사이트 연결 옵션을 사용할 수 있습니다.
이 안전성 유형에 대한 포함 기준을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
- 다음 옵션 중에서 선택합니다.
- 안전성 사례에 모든 폼 포함(기본값은 아니요): 예를 선택하면 현재 병용약물을 모두 사례에 포함하고 다른 모든 옵션을 비활성화합니다.
- 사이트 사용자가 링크한 관련 이벤트 폼 포함: 사이트에서 기본 시작 이벤트에 연결한 병용약물을 사례에 포함하려면 예를 선택합니다. 경고: 예로 설정하는 경우, 폼에 폼-폼 또는 아이템-폼 연결 또한 구성되어야 합니다.
- 사이트 사용자가 링크한 안전성 사례에 폼 포함하기: 경고에 대해 예 또는 아니요 선택: 예로 설정하는 경우, 폼에 폼-폼 또는 아이템-폼 연결 또한 구성되어야 합니다.
-
날짜 일치를 통해 안전성 사례에 폼 포함하기에 대해 예 또는 아니요를 선택합니다. 예로 설정하면 시스템은 하나 이상의 기준을 사용하여 안전성 사례 이벤트(기본)와 관련 데이터(현재 구성 중인 폼, 시작 및 종료 범위)의 시작-종료 범위를 비교합니다.
- 옵션을 선택하거나 특정 일수(Days) 값을 설정합니다. 다음 옵션 중 하나 이상을 선택/설정해야 합니다.
- 저장하고 닫기를 클릭하여 완료합니다.
각 포함 기준 옵션에 대한 자세한 내용과 예시는 위의 옵션 의미 및 예시를 참조하십시오.
시험 결과
이 유형의 안전성 구성은 스터디의 실험실/시험 결과 폼에 적용됩니다. 정보는 Veeva Safety의 시험 결과 섹션으로 전달됩니다.
실제 예:
- 스터디 디자인은 연구자/사이트에 필요한 경우 로그 폼에 추가 실험실/시험 결과를 수집합니다. 이는 심각한 이상 사례와 관련이 있다고 판단되는 테스트입니다.
- 2025년 3월 7일에 대상자는 심각한 이상 사례("어지러움")를 경험하고, 사이트에서 AE 폼에 입력합니다.
- 또한 사이트는 범위를 벗어난 두 개의 실험실 테스트를 추가하고 각각에 대해 AE 폼에 대한 링크를 수행합니다.
- 시스템은 "어지러움"을 기본 이벤트로 사용하여 안전성 사례를 생성하고 전송합니다.
- 스터디에는 사이트가 이벤트에 연결된 모든 것을 포함하도록 나타내는 안전성 설정이 있으므로, 두 시험 결과가 사례에 포함됩니다.
- 추가로(또는 대신) 날짜 기반 옵션을 사용할 수 있습니다.
이 안전성 유형에 대한 포함 기준을 저장하는 방법은 다음과 같습니다.
- Studio > 폼 구성에서 스터디로 이동합니다.
- 다음 옵션 중에서 선택합니다.
- 안전성 사례에 모든 폼 포함(기본값은 아니요): 예를 선택하면 현재 병용약물을 모두 사례에 포함하고 다른 모든 옵션을 비활성화합니다.
- 사이트 사용자가 링크한 관련 이벤트 폼 포함: 사이트에서 기본 시작 이벤트에 연결한 병용약물을 사례에 포함하려면 예를 선택합니다. 경고: 예로 설정하는 경우, 폼에 폼-폼 또는 아이템-폼 연결 또한 구성되어야 합니다.
- 사이트 사용자가 링크한 안전성 사례에 폼 포함하기: 경고에 대해 예 또는 아니요 선택: 예로 설정하는 경우, 폼에 폼-폼 또는 아이템-폼 연결 또한 구성되어야 합니다.
-
날짜 일치를 통해 안전성 사례에 폼 포함하기에 대해 예 또는 아니요를 선택합니다. 예로 설정하면 시스템은 하나 이상의 기준을 사용하여 안전성 사례 이벤트(기본)와 관련 데이터(현재 구성 중인 폼, 시작 및 종료 범위)의 시작-종료 범위를 비교합니다.
- 옵션을 선택하거나 특정 일수(Days) 값을 설정합니다. 다음 옵션 중 하나 이상을 선택/설정해야 합니다.
- 저장하고 닫기를 클릭하여 완료합니다.
각 포함 기준 옵션에 대한 자세한 내용과 예시는 위의 옵션 의미 및 예시를 참조하십시오.
환자 특성
이 유형의 안전성 구성은 환자에 대한 일반 정보에 적용됩니다. 이 유형에 대한 기준은 없습니다. 대신 이 유형으로 분류된 정보는 대상자의 모든 안전성 사례에 포함됩니다.
아이템 구성 탭에서 포함 기준 탭에 도달한 후 저장 및 다음을 클릭하면 폼 구성 목록으로 돌아갑니다.
사망 시
이 유형의 안전성 구성은 대상자에 대한 사망 세부 사항과 관련된 폼에 적용됩니다. 이 유형에 대한 기준은 없습니다. 대신 이 유형으로 분류된 정보는 대상자의 모든 안전성 사례에 포함됩니다.
현재 모든 사례는 이 정보를 받게 되며, 이벤트에 치명적인 결과가 없는 경우도 포함됩니다.
아이템 구성 탭에서 포함 기준 탭에 도달한 후 저장 및 다음을 클릭하면 폼 구성 목록으로 돌아갑니다.
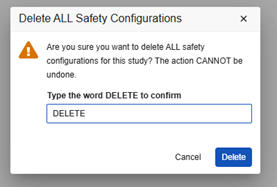
모든 안전성 구성 삭제
스터디 디자인의 모든 안전성 구성을 제거할 때는 각별히 주의하십시오. 이 작업을 수행하면 스터디가 구성이 없는 상태로 돌아가므로 다시 시작해야 합니다.
이 작업을 수행하려면 개발 스터디에 안전성 사례가 없어야 합니다. 개발 환경에서 안전성 사례를 이미 생성한 경우, 비프로덕션 테스트 데이터를 삭제하면 됩니다.
Post Go Live 삭제: 다운스트림 환경(테스트, 트레이닝, 프로덕션)에 안전성 구성 및 안전성 사례가 있는 경우 이 작업을 수행해서는 안 됩니다. 개발 스터디에서 안전성 사례를 삭제한 다음 안전성 구성을 삭제할 수 있지만, 나중에 테스트/트레이닝/프로덕션에 배포할 때 실패가 발생할 수 있습니다.
스터디의 모든 안전성 구성을 제거하는 방법은 다음과 같습니다.
사양 다운로드
스터디 디자인 사양 또는 모든 CRF PDF 내보내기를 통해 안전성 구성을 다운로드할 수 있습니다. 안전성 연동을 구성하면 안전성 설정 및 안전성 폼 구성이라는 두 개의 추가 탭이 생성됩니다.
안전성 구성 배포
스터디의 DEV 환경에서 구성이 완료되면 테스트를 위해 TST에 배포한 다음 교육 및 프로덕션 환경으로 넘어갈 수 있습니다.
안전성 구성은 연동 설정 및 연결을 제외하고 스터디의 배포 패키지에 자동으로 포함됩니다. 스터디를 배포할 때 Vault는 패키지에 현재 구성을 포함합니다.
이 구성은 스터디 배포의 일부로 관리되므로 DEV 유형 환경에서만 변경할 수 있습니다. 구성을 변경하려면 DEV 환경에서 변경한 다음 해당 변경 사항을 다른 환경에 배포합니다. 이 구성은 사례집 버전 게시의 일부로 검증됩니다. 검증이 진행되는 동안에는 편집이 비활성화됩니다. 여기에서 가능한 오류 및 경고 목록을 확인할 수 있습니다.
스터디를 배포하는 방법에 대해 알아보십시오.
커스텀 안전성 필드
Safety-EDC Connection은 매핑을 위한 표준 안전성 필드로 가장 일반적인 안전성 관련 필드인 E2B 및 비 E2B를 제공합니다. EDC에서 Veeva Safety로 정보를 전송할 때의 유연성을 높이기 위해 추가로 사용자 지정 안전성 필드를 구성할 수 있습니다. 사용자 지정 필드는 적용되는 안전성 데이터 유형의 아이템 구성 메뉴에 다른 표준 필드와 함께 표시됩니다.
- Veeva Safety에서 안전성 사례에는 이상 사례, 사망 원인, 평가 등을 포함한 여러 하위 섹션이 있습니다. 이 구조는 계층적 오브젝트 구조로 표시됩니다. 사례 오브젝트는 모든 관련 사례 섹션 오브젝트의 상위 항목이며, 사례 이상 사례, 사례 사망 원인, 사례 평가 등을 포함하여 UI의 안전성 사례 하위 섹션을 나타냅니다.
- 따라서 사례의 개별 하위 섹션은 각 사례 하위 오브젝트에 항목을 추가하여 Veeva Safety의 사용자 지정 안전성 필드로 수정할 수 있습니다. 자세한 내용은 Veeva Safety 도움말을 참조하십시오.
- Veeva Safety에서 사례 하위 오브젝트를 수정할 때 Veeva EDC의 다음 구성에 대한 가장 중요한 정보는 다음과 같습니다.
- 하위 오브젝트(예: case_medical_history__v)
- 정확한 사용자 지정 필드 이름(예: 새 사용자 지정 필드 만성 질환의 경우 필드 이름은 chronic_condition__c가 될 수 있음).
- Veeva EDC에서 사용자 지정 안전성 필드를 생성하려면 새 안전성 커넥터 필드 정의 항목을 생성해야 합니다. 매핑을 위해 안전성 데이터 유형 중 하나에서 올바른 위치를 구성하려면, 특히 그룹화 속성(즉, 아이템을 표시할 안전성 데이터 유형) 및 표시 순서가 관련이 있습니다(자세한 내용은 아래 참조).
- Veeva EDC에서 Veeva Safety로 데이터를 전송할 때는 JSON을 기반으로 합니다. 또한 Veeva Safety로 올바르게 전송할 수 있도록 하려면 새로운 안전성 커넥터 필드 정의에서 JSON 구조를 이해하고 구성해야 하며, 이때 JSON 노드 이름이 데이터 일치를 위해 Veeva Safety의 사용자 지정 필드 이름과 동일해야 합니다(자세한 내용은 아래 참조).
- 사용자 지정 안전성 필드는 Vault 수준에서 구성되며, 기존 스터디와 새 스터디 모두에 대해 매핑할 수 있습니다.
- 새로운 사용자 지정 안전성 필드는 기존 스터디에 매핑되지 않지만, 기존 사례는 영향을 받지 않으며 구성으로 인해 팔로우업 메시지가 표시되지도 않습니다.
예시 1
-
Veeva Safety에서 안전성 사례의 이상 사례 하위 섹션에는 안전성 사례의 이벤트가 포함되어 있습니다. 사례 이상 사례 오브젝트(case_adverse_event__v)는 이 하위 섹션에 표시되는 필드를 제공합니다. 이 하위 섹션에서 확인할 수 있는 데이터는 대부분 EDC 스터디의 AE/SAE 폼에서 확인할 수 있습니다. Veeva EDC에서 Veeva Safety로 전송된 필드는 안전성 사례 시작 이벤트 데이터 유형의 필드에 상응합니다. Safety 사용자 인터페이스에서는 다음과 같이 표시됩니다.
-
아래에서는 Veeva Safety 오브젝트에 두 개의 사용자 지정 안전성 필드를 추가했습니다. 이러한 필드에는 통증 점수(Pain Score)(pain_rating__c) 및 하루 발생 횟수(Occurrence per Day)(occur_per_day__c)와 같이 후행 "__c"가 있습니다.
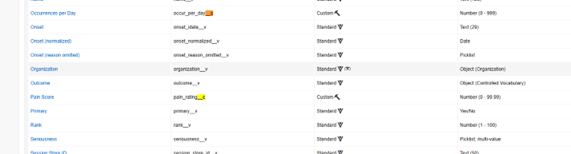
-
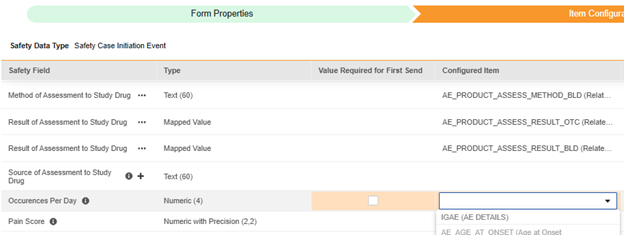
해당되는 안전성 데이터 유형에 필드가 설정되면, 매핑을 위해 표준 안전성 필드와 함께 이 필드를 사용할 수 있습니다.
예시 2
- Veeva Safety의 시험 결과 하위 섹션에는 안전성 사례의 시험 결과에 대해 구성된 모든 필드가 사례 시험 결과 오브젝트(case_test_result__v)에 표시됩니다. 이러한 레코드는 일반적으로 EDC 실험실 결과 폼에 구성되며, 시험 결과(Test Results) 데이터 형식에 매핑됩니다.
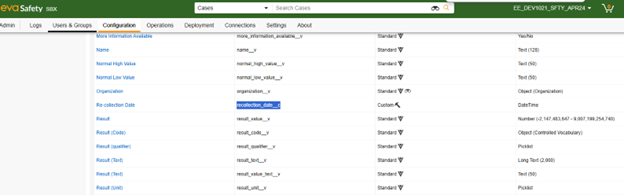
-
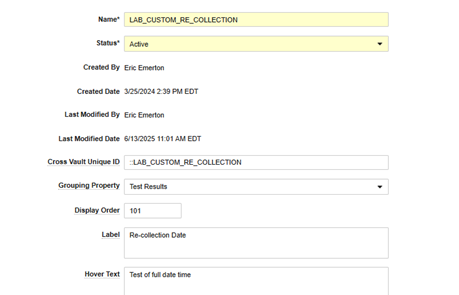
아래에서는 Veeva Safety 오브젝트인 재수집 날짜(Re-collection Date)(recollection_date__c)에 사용자 지정 필드를 추가했습니다.
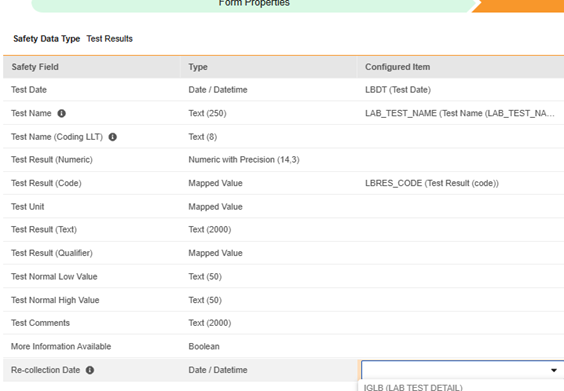
- EDC 측에서 고려되면 이 필드를 표준 안전성 필드와 함께 사용할 수 있습니다.
EDC에 사용자 지정 안전성 필드 추가
Veeva EDC의 사용자 지정 안전성 필드 구성은 Vault 수준에서 수행됩니다. 새 필드는 모든 기존 스터디 및 새로운 스터디에서 매핑에 사용할 수 있습니다.
사용자 지정 안전성 필드에 대한 중요한 고려 사항은 다음과 같습니다.
- 이 기능을 성공적으로 구성하고 최대한 활용하는 데 필요한 계획 및 단계에 대해 Veeva 담당자에게 문의하십시오.
- 사용자 지정 안전성 필드를 생성하거나 업데이트하려면 Veeva EDC와 Veeva Safety 구성 간의 신중한 조정이 필요합니다.
- 사용자 지정 안전성 필드를 잘못 구성하면 Veeva EDC에서 Veeva Safety로의 데이터 전송이 손상될 수 있습니다.
- 또한 EDC 디자인 팀, Safety 사용자, 나아가 다른 Veeva 애플리케이션을 사용하는 구성원과 관련된 프로그램 수준 결정을 고려하십시오.
- Veeva EDC의 구성 전에 Veeva Safety의 사용자 지정 안전성 필드 구성을 수행하는 것이 좋습니다.
- 구성을 위해 Veeva Safety 및 Veeva EDC 모두에서 Vault 소유자 보안 프로필이 있는 계정이 필요합니다.
- 연결의 EDC 측 구성은 개발 Vault/'컨트롤 센터'에서 한 번 수행됩니다. 구성을 개발 Vault에서 테스트, 프로덕션 또는 트레이닝으로 이동하려면 시스템 툴에서 안전성 옵션을 선택한 Vault 수준 배포를 사용하십시오.
Vault 소유자 필요: Vault 소유자 보안 프로필을 보유한 사용자가 사용자 지정 안전성 필드를 구성해야 합니다.
Veeva EDC에서 Veeva Safety에 해당하는 사용자 지정 안전성 필드를 구성하는 방법은 다음과 같습니다.
-
비즈니스 어드민(Business Admin) > 오브젝트(Objects) > 안전성 커넥터 필드 정의(Safety Connector Field Definitions)로 이동합니다.
- 새 레코드를 추가하려면 생성(Create)을 클릭합니다.
- 다음 필드 수준 정보 지침으로 새 레코드를 작성합니다.
- 저장을 클릭합니다.
| Vault 필드 | 값 | 메모 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 이름 | (텍스트) | 이름을 지정할 때, 이미 목록에 있는 안전성 데이터 유형에 따라 다른 표준/필드 이름과 일치하도록 하는 것이 좋습니다. 예를 들어 병력이 '만성 질환'인지 여부를 수집하는 필드에 MH_CHRONIC_CONDITION을 사용합니다. 앞에 붙은 'MH_' 텍스트는 다른 MH 필드를 반영한 것입니다. | ||||||||||||||||||||||||
| 교차 Vault 고유 ID | (::이름) | 앞에 두 개의 콜론을 붙여야 합니다. 앞에 '::'이 붙은 이름과 동일한 값을 사용하는 것이 좋습니다. 예를 들면 :MH_CHRONIC_CONDITION과 같습니다. | ||||||||||||||||||||||||
| 그룹화 속성 | (picklist) | 이 필드는 안전성 데이터 유형(영역)이며, Veeva Safety에서 안전성 사례의 대상 하위 섹션과 일치하는 것이 좋습니다. 예를 들어 이상 사례 섹션에 대한 정보는 안전성 사례 시작 이벤트에 있어야 합니다.
|
||||||||||||||||||||||||
| 표시 순서 | (정수 값) | 일반적으로 이 값은 해당 안전성 데이터 유형(그룹화 속성)의 다른 모든 기존 값보다 큽니다. 해당 안전성 데이터 유형에 대한 아이템 구성 목록에서 행이 나타나는 순서를 결정하는 역할을 합니다. 기존 값을 선택한 경우, 중복 항목과의 순서는 예측할 수 없습니다. | ||||||||||||||||||||||||
| 레이블 | (텍스트) | 매핑을 위해 Studio의 안전성 데이터 유형에 있는 사용자 지정 안전성 필드에 대해 표시되는 레이블(예: 재수집 날짜) | ||||||||||||||||||||||||
| 마우스오버 텍스트 | (텍스트) | 선택적으로 레이블 옆에 있는 'i' 마우스오버 아이콘에 표시할 텍스트를 표시합니다. | ||||||||||||||||||||||||
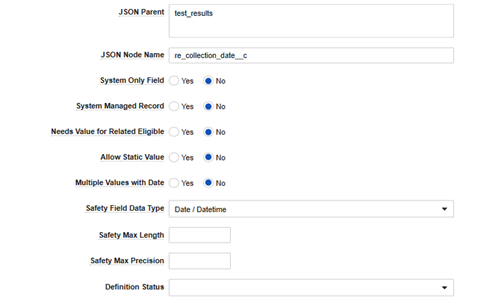
| JSON 상위 | (텍스트) | 참고: 이 필드를 구성할 때 Veeva 컨설턴트의 지원을 받는 것이 좋습니다. 잘못된 값을 삽입하면 EDC에서 Safety로의 데이터 전송이 손상됩니다. 잘못된 구성에 대한 시스템 검증 기능은 없습니다.
이 값은 두 시스템 간에 교환되는 JSON 파일에 해당합니다. 필드의 안전성 및 EDC 안전성 데이터 유형의 위치를 기반으로 한 값만 사용하십시오.
|
||||||||||||||||||||||||
| JSON 노드 이름 | (텍스트) | 이 값은 Veeva Safety의 정확한 필드 이름과 일치해야 합니다. 예를 들어 MH_CHRONIC_CONDITION 필드가 Veeva Safety case_medical_history__v.chronic_condition__c에 있다면 chronic_condition__c를 사용합니다. |
||||||||||||||||||||||||
| 시스템 전용 필드 | 항상 아니요로 설정 | 아니요만 지원됨 | ||||||||||||||||||||||||
| 시스템 관리 레코드 | 항상 아니요로 설정 | 아니요만 지원됨 | ||||||||||||||||||||||||
| 관련 적격 대상에 대한 값이 필요합니다 | 항상 아니요로 설정 | 아니요만 지원됨 | ||||||||||||||||||||||||
| 정적 값 허용 | 예 또는 아니요 | 예를 선택하면 아이템 구성 UI의 행이 안전성 시스템으로의 흐름에서 데이터 입력의 EDC 폼에 있는 아이템 구성/필드의 값 대신 정적 값을 허용합니다. | ||||||||||||||||||||||||
| 날짜가 포함된 여러 값 | 항상 아니요로 설정 | 아니요만 지원됨 | ||||||||||||||||||||||||
| 안전성 필드 데이터 유형 | 메모를 참조하십시오. | 필드 유형(예: 날짜, 숫자, 텍스트). 유형에 따라 레코드의 다른 필드에서 추가 구성이 필요합니다.
|
||||||||||||||||||||||||
| 안전성 최대 길이 | 정수 값 | 안전성에서 필드에 구성된 값을 나타냅니다. 안전성 필드 데이터 유형을 참조하십시오. | ||||||||||||||||||||||||
| 안전성 최대 정밀도 | 정수 값 | 정밀도를 허용하는 필드의 경우 여기에 해당 값을 표시합니다. 안전성 필드 데이터 유형을 참조하십시오. | ||||||||||||||||||||||||
| 정의 상태 | 항상 비워 둡니다. | 이 필드에 한해 공백이 "활성"을 의미합니다. 보관됨 상태인 경우 Studio에서 필드를 더 이상 표시하지 않습니다. | ||||||||||||||||||||||||
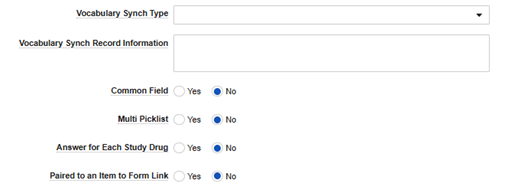
| 어휘 동기화 유형 | 메모를 참조하십시오. | 여기의 값은 안전성 필드 데이터 유형(Safety Field Data Type)이 매핑된 값(Mapped Value)인 경우에만 적용됩니다. 선택 항목에 따라, 다음 필드인 어휘 동기화 레코드 정보에 추가 정보가 필요합니다. | ||||||||||||||||||||||||
| 어휘 동기화 레코드 정보 | 메모를 참조하십시오. | 선택한 어휘 동기화 유형(Vocabulary Synch Type)에 따라 이 필드는 EDC에 해당 선택 항목을 찾을 위치를 지시합니다.
|
||||||||||||||||||||||||
| 공통 필드 | 항상 아니요로 설정 | 아니요만 지원됨 | ||||||||||||||||||||||||
| 다중 picklist | 예 또는 아니요 |
|
||||||||||||||||||||||||
| 각 스터디 약물에 대한 답변 | 항상 아니요로 설정 | 아니요만 지원됨 | ||||||||||||||||||||||||
| 폼 링크로 항목에 페어링됨 | 항상 아니요로 설정 | 아니요만 지원됨 |
이전의 예시 섹션에 있는 예시 2에서 재수집 날짜 사용자 지정 필드가 올바르게 구성되면 다음과 같이 나타납니다.
사용자 지정 필드 배포
- Veeva EDC의 사용자 지정 안전성 필드 구성은 개발 환경("컨트롤 센터")이 포함된 EDC Vault에서 한 번 수행됩니다.
- 개발 Vault에서 다른 Vault(테스트/UAT, 프로덕션, 트레이닝)으로 구성을 이동하려면 다운스트림 Vault에서 단계를 다시 수행하지 마십시오.
-
대신 툴 > 시스템 툴 에서 안전성 커넥터 정의(Safety Connector Definitions)가 선택된 상태로 Vault 배포 옵션을 사용하십시오.
- Veeva EDC의 Vault 수준 배포에 대한 자세한 내용은 시스템 툴에서 Vault 수준 구성 배포를 참조하십시오.
표준 및 사용자 지정 필드에 대한 사용자 지정 안전성 값
Veeva Safety에서 Vault picklist 또는 관리 어휘 오브젝트의 레코드는 특정 표준 및 사용자 지정 안전성 필드에 사용 가능한 값을 정의하는 데 사용됩니다(예: 약물에 대해 취한 조치에 사용 가능한 옵션). 사용 가능한 옵션은 표준 세트 이외의 추가 선택 항목으로 구성할 수 있습니다(예: 약물에 취한 조치에 "투여 중단" 추가).
Veeva EDC에서 필드가 Veeva Safety 측에서 지정된 사용 가능한 옵션이 있는 표준 또는 사용자 지정 필드에 매핑되는 경우, 아이템 구성 단계에서 값 번역이 필요합니다.
값 번역이 필요한 안전성 데이터 유형의 필드는 안전성 필드 데이터 유형이 매핑된 값으로 설정된 안전성 커넥터 필드 정의를 통해 식별할 수 있습니다. Veeva EDC에서 새로 구성되거나 업데이트된 옵션을 사용할 수 있도록 하려면 연결 안전성 스캔 작업을 다시 실행해야 합니다. EDC에서 코드 목록 또는 불린(Boolean) 유형의 아이템 정의는 일반적으로 이러한 안전성 필드에 매핑됩니다.
안전성 필드 값 업데이트는 Vault 수준에서 구성되며, 기존 스터디와 새 스터디 모두에 적용됩니다. 기존 스터디에 미치는 영향을 고려해야 합니다.
예시 1
스터디 약물에 대한 조치 행동(Action Taken with Study Drug) 필드는 안전성 사례 시작 이벤트에 대한 안전성 이벤트 및 스터디 약물에 관한 중요한 답변입니다. Veeva Safety의 선택 항목은 추가 사용자 지정 선택 항목인 약물 일시적 중단/중지(Drug Temporarily Discontinued / Interrupted)로 보완할 수 있습니다.
EDC Vault가 Veeva Safety와 동기화되면(다음 섹션), 추가 선택 항목이 스터디 디자인의 EDC 아이템 구성에서 값 번역에 선택 항목으로 표시됩니다.
예시 2
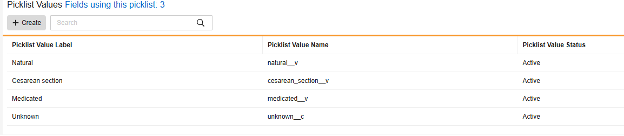
안전성 사례 시작 이벤트 및 환자 특성에 사용할 수 있는 안전성 필드인 전달 방법(Delivery Method)에는 세 가지 표준 선택 항목이 있습니다. 해당 picklist에서 알 수 없음(Unknown)에 대한 네 번째 사용자 지정 선택 항목은 Veeva Safety에서 다음과 같이 구성됩니다.
예시 1과 동일한 방식으로, EDC Vault가 Veeva Safety와 동기화되면 값 번역을 구성하기 위한 네 번째 선택 항목이 나타납니다.
EDC에 사용자 지정 안전성 값 동기화
사용자 지정 값과 관련하여 중요한 고려 사항은 다음과 같습니다.
- 사용자 지정 안전성 필드와 마찬가지로, 이 기능을 성공적으로 구성하고 최대한 활용하는 데 필요한 계획 및 단계에 대해 Veeva 담당자에게 문의하십시오.
- 기존 스터디에 미치는 영향을 고려해야 합니다.
- 동기화 안전성 필드 선택 항목이 누락되면 Veeva EDC에서 Veeva Safety로의 데이터 전송이 손상될 수 있습니다.
- 사용자 지정 안전성 필드 값을 업데이트하면, EDC에서 값 번역 없이 값이 남아 있는 경우 기존 스터디에 대한 검증 오류가 발생할 수 있습니다. EDC에서 업데이트된 값 번역으로 인해 기존 사례에 대한 팔로우업 메시지가 표시될 수 있습니다.
- 사용자 지정 필드의 경우, 안전성 필드 선택 항목의 추가 또는 조정을 신중하게 계획하려면 Veeva EDC와 Veeva Safety 구성 간의 신중한 조정이 필요합니다. 또한 EDC 디자인 팀, Safety 사용자, 나아가 다른 Veeva Vault 애플리케이션(RIM, CTMS 등)을 사용하는 구성원과 관련된 프로그램 수준 결정을 고려하십시오.
- Veeva EDC의 구성 전에 Veeva Safety의 사용자 지정 안전성 필드 구성을 수행하는 것이 좋습니다.
- Veeva Safety에서 선택 항목을 구성하려면 Vault 소유자 접근권한이 필요합니다.
- Veeva EDC에서 선택 항목은 시스템 툴 > 연결 > 안전성 위치에서 어휘 스캔 작업을 사용하여 동기화됩니다.
- 연결에서 EDC 측의 구성은 개발 유형 환경("컨트롤 센터")이 포함된 EDC Vault에서 한 번 수행됩니다. 구성을 개발 Vault에서 테스트/UAT, 프로덕션 또는 트레이닝으로 이동하려면 시스템 툴에서 안전성 옵션을 선택한 Vault 수준 배포를 사용하십시오.
Veeva Safety에서 새로 생성되거나 업데이트된 선택 항목을 Veeva EDC Studio 화면으로 동기화하는 방법은 다음과 같습니다.
- 시스템 툴 > 연결 > 안전성에서 연결로 이동합니다.
- 연결 이름 위로 마우스를 가져가면 스캔 버튼이 표시됩니다.
- Vault Safety 스캔 대화 상자에서 작업 실행을 클릭합니다.
Vault가 작업을 완료하면 이메일 알림을 받게 되며, EDC 스터디 구성의 모든 안전성 필드에 있는 값 번역 선택 항목이 페어링된 Veeva Safety의 값 번역 선택 항목을 반영합니다.
사용자 지정 값 배포
- 연결에서 사용자 지정 값에 대한 EDC 측의 구성은 개발 환경("컨트롤 센터")이 포함된 EDC Vault에서 한 번 수행됩니다.
- 개발 Vault에서 다른 Vault(테스트/UAT, 프로덕션, 트레이닝)으로 구성을 이동하려면 다운스트림 Vault에서 단계를 다시 수행하지 마십시오.
-
대신 툴 > 시스템 툴 에서 안전성 커넥터 정의(Safety Connector Definitions)가 선택된 상태로 Vault 배포 옵션을 사용하십시오.

- Veeva EDC의 Vault 수준 배포에 대한 자세한 내용은 시스템 툴에서 Vault 수준 구성 배포를 참조하십시오.
안전성 필드 참조(시스템 생성)
이 페이지에는 안전성 사례에서 Veeva Safety로 전송되는 정적 요소 및 시스템 생성 요소가 나열되어 있습니다.
| 안전성 필드 | Data Type | 원본(Source) | 설명 |
|---|---|---|---|
| 스터디 레이블 | 텍스트 | 정적 | Veeva EDC의 스터디 레이블. 안전성 설정을 사용하여 특수하게 오버라이드할 수 있습니다. |
| 스터디 번호 | 텍스트 | 정적 | Veeva EDC의 스터디 레이블. 안전성 설정을 사용하여 특수하게 오버라이드할 수 있습니다. |
| 원본에서 레포트를 처음 받은 날짜 | Datetime | 시스템 생성됨 | 이 필드는 이벤트에 대해 모든 필수 필드(아이템)가 캡처된 날짜 및 시간을 캡처합니다. |
| 이 레포트에 대한 가장 최근 정보의 날짜 | Datetime | 시스템 생성됨 | 마지막 안전성 메시지가 전송된 후 안전성 사례의 데이터와 관련하여 데이터 입력 사용자가 지정된 날짜에 수행한 첫 번째 변경 사항을 나타냅니다. 예를 들어, 같은 날짜에 사용자가 병력 폼의 데이터를 오전 8시에 처음 변경한 다음, 오전 10시에 SAE 폼의 데이터를 변경하고, 마지막으로 오전 11시에 두 개의 병용약물 치료 폼을 연결하고, 동일한 안전성 사례의 데이터에 대한 모든 변경 사항을 포함하는 경우, 값은 예약된 다음 전송에서 해당 날짜의 오전 8시가 됩니다. |
| 보고자 정보 | 텍스트 | 사이트 또는 사용자가 입력 | 보고자(안전성 설정)에 대한 스터디의 옵션에 따라 사이트의 책임 연구자가 제공합니다. Safety-EDC Connection에서는 특정 EDC 폼 아이템을 보고자 정보의 각 부분에 매핑할 수 있습니다. 작성하면, 기본 사이트/PI 정보를 오버라이드합니다. |
| 반응/이벤트가 발생한 국가 식별 | 텍스트(2) | 사이트 또는 사용자가 제공 | 사이트의 스터디 국가에 대한 2자리 국가 코드. 또는 사이트에서 오버라이드하도록 데이터 입력 폼에 매핑할 수 있습니다(예: 대상자가 해외에 있을 때 이벤트가 발생함). |