Clinical Data 应用程序概述
Veeva 的 Clinical Data 平台提供了一个统一的端到端解决方案,用于临床试验数据的收集和管理。其强大的连通性有助于合规监管、简化试验管理,并能更快地识别驱动关键决策的数据。凭借无缝集成的产品套件,各系统可自由通信,避免数据孤岛并提高效率,助力缩短新药的上市时间。
Veeva EDC
Veeva EDC 是一款现代化、灵活的电子数据捕获系统,旨在减轻研究中心和申办方的手动操作及管理负担。Veeva EDC 的模块集中收集各类临床试验数据并进行标准化处理。借助直观的、基于角色的用户界面,Veeva EDC 支持高效的研究设计、简化的数据录入以及便捷的审查和监控流程。本地化支持使申办方可根据需要定制研究和 UI 的语言。
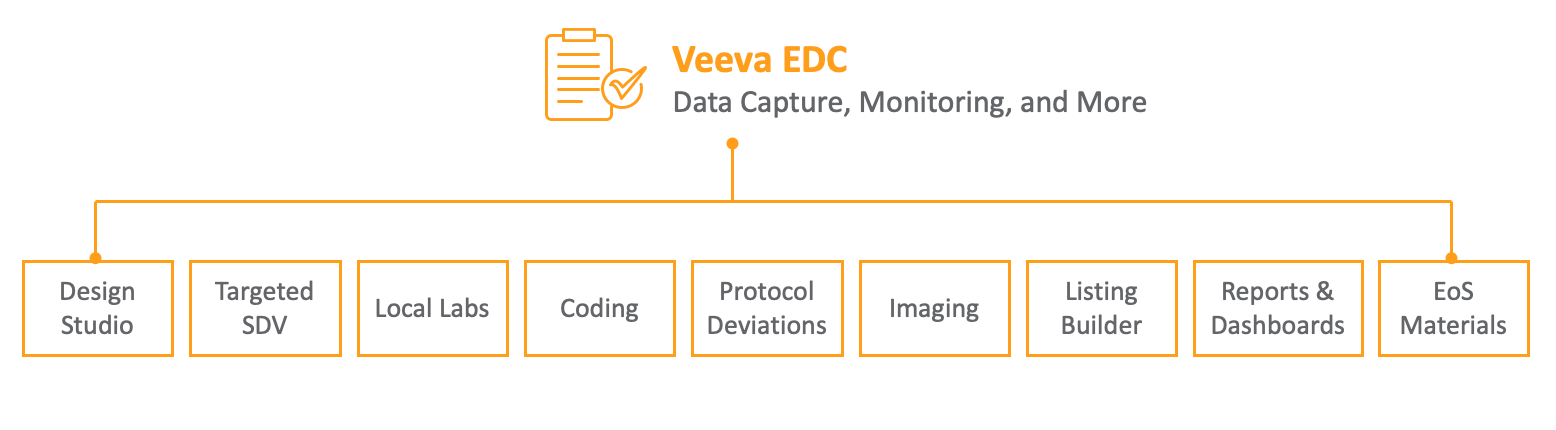
EDC 功能与模块
研究设计
Veeva EDC 通过研究设计模块“工作室”支持对任何复杂度的研究进行高效且灵活的设计。这个强大且直观的界面支持通过拖放操作轻松创建研究对象和病例报告表(CRF),从而构建研究方案设计。研究设计人员还能从库集合或以往研究中轻松复用表单。编辑检查、用户定义规则和比较规则的实施无需自定义编程,大幅缩短了研究构建时间,使没有软件编程经验的研究设计人员也能创建完整的研究。当研究在投入使用后需要修改时,Veeva EDC 支持上线后的修订,无需迁移操作。
数据录入
Veeva EDC 的数据录入界面简洁、结构化,便于研究中心人员使用。其简化的导航功能让用户能轻松查找并响应质疑。直观的布局和合理的病例手册结构简化了受试者和表单之间的切换,减少了数据录入时间。实时编辑检查和数据验证会提醒用户缺失或不一致的数据,减少转录错误并提高效率。全面的审计跟踪记录数据录入和更改情况,确保符合监管要求。
监控和审查
Veeva EDC 简化了临床试验的监控和审查流程,有助于确保临床试验数据的完整性。借助可自定义的审查计划,可对研究进行配置,仅对需要的条目执行 SDV 或 DMR,节省监查和数据管理用户的时间。Veeva EDC 提供多种标准报告和信息板,从“报告”选项卡即可查看关键研究指标的可视化数据。
Veeva EDC 模块
Veeva EDC 提供多个模块和特性,以扩展其功能并支持特定的临床试验需求。
- 本地实验室:提供对集中实验室位置、正常范围和分析物库的便捷访问,并与 Veeva EDC 无缝集成。
- Veeva EDC 成像:支持在所有 CDMS 模块之间共享研究过程中收集的成像数据。
- 数据加载程序:无需进行大规模检测结果的手动数据录入,可导入数据并自动填入已配置的表单及数据收集条目。
- 研究等级:根据研究对最佳实践的遵守情况对研究进行审查和评级。
- Veeva Coder:一款对临床试验中使用的术语进行医疗编码的工具,可实时传输病例手册数据和编码质疑,无需进行数据核对。
- 医学评估:支持对相关病例手册数据进行补充评估和审查,为试验数据决策提供支持。
- 临床报告:临床报告提供对 Vault EDC 应用程序中捕获的 EDC 临床数据的基本报告访问权限。
- 访视方法:可用于指定事件可按什么访视类型进行分类:现场访视、线上访视、居家访视、备用设施访视或电话访谈。
- Veeva EDC API:基于 Vault 平台 API 构建,支持与外部系统的安全集成。
Veeva CDB
在现代临床试验中,临床数据管理员需要从 EDC 之外的多种来源收集数据。Veeva 临床数据库(CDB)聚合、清理和转换来自多个来源(包括第三方 EDC)的临床数据。
通过 CDB,数据管理员可以访问最新的试验数据、评估数据状态并跟踪审查进度。他们可以通过手动质疑或自动检查在任何来源记录数据问题,无需在 EDC、跟踪器和邮件之间切换即可与数据提供者沟通。
程序员可以使用专为临床数据设计的 Veeva 临床质疑语言(CQL)访问、检索和转换数据,供 Veeva CDB 或下游的审查者使用。
Veeva CDB 功能
CDB 研究主干
CDB 通过将不同的数据源与统一的研究主干对齐,简化了不同来源数据的比较和核对流程。临床质疑语言(CQL)能理解临床主干,可处理所有数据类型及相关元数据。
列表生成器
Veeva 列表生成器是一款拖放工具,数据管理员无需编写 CQL 质疑或代码即可构建列表、检查或视图。这个直观的界面帮助用户快速构建和修改列表,同时从多个表单、访视和数据源中提取数据。列表生成器会根据界面中的选择自动生成 CQL 代码,降低使用门槛,并将临床试验数据转化为有意义的信息。
患者清理跟踪器
使用患者清理跟踪器,数据管理员可以跟踪受试者的清理状态,并对数据管理清理活动直接采取操作。该内置报告按受试者(患者)汇总所有收集的数据,支持深入查看患者和质疑数据。该功能简化了跨来源和跨患者的数据管理,无需在来源系统之间切换或依赖外部电子表格。
自动检查和质疑自动化、集中式质疑管理
当新数据和传入数据从内部或第三方来源加载到系统中时,Veeva CDB 会自动检查。如果发现错误,系统会自动创建质疑,减少手动审查工作。质疑的解决也能被自动识别并关闭。借助直观的、类电子表格的数据工作台,用户可从中央位置访问所有研究数据。所有列表和质疑都可以直接在数据工作台中查看,无需登录 EDC 或参考外部跟踪表。
Veeva CQL
Veeva CQL 是 Veeva 构建的临床质疑语言,减少了数据清理和转换所需的工作量和技术专业知识。临床程序员可以轻松计算派生值并构建复杂列表。该功能提供全面的预构建函数,只需几行代码就能完成通常需要数百行代码的任务。
Veeva eCOA
Veeva eCOA(电子临床结局评估)通过应用程序或网页直接从临床试验患者(ePRO)、临床医生(eClinRO)或患者护理者(eObsRO)收集问卷回答。
申办方可通过专用界面管理 eCOA。借助一个中央库,他们可以在所有研究中保留和重复使用 eCOA。Veeva 还为针对讲不同语言的用户的调查提供本地化支持。
研究中心可以管理其受试者,并通过易于使用的访问点审查 eCOA 数据和依从性。
患者和护理者通过 MyVeeva for Patients (原生应用程序或网页)完成问卷,还可在其中访问其他活动,如知情同意或虚拟访视。数据完成后会自动回流到申办方的环境中。
Veeva eCOA 是一个统一的系统,能够在整个 eCOA 流程中无缝连接申办方、研究中心和患者。从 Veeva eCOA 收集的数据可流入 Veeva CDB,从而提供更深入的洞察。
Veeva eCOA 功能
交互式设计流程、加速研究构建
利益相关者可在设计阶段早期及整个研究构建过程中,通过所有设备类型和可用语言的 eCOA 预览参与协作。eCOA 支持来自 Veeva 和申办方库的可复用和已验证工具库,以及自动生成用于研究中心审查和 IRB/伦理文件包的截图文档,从而加速研究设计。
自助管理工具、版本控制
申办方可跟踪研究进度,在研究中期快速更改并按需导出数据,无需额外成本或延迟。Veeva eCOA 提供对工具、翻译和修订的完整跟踪和审计跟踪,支持研究各环节的合规性。
患者和研究中心通知、研究中心引导式导航
Veeva eCOA 会通知患者需要完成的 ePRO,并在未完成或遗漏时提醒研究中心。在研究中心 UI 中,指示器清楚地引导研究中心完成患者访视期间需要进行的活动。
增强登录选项,专为 BYOD 优化
Veeva eCOA 提供简单安全的访问方式。用户可以使用用户名和密码、PIN 码登录,或选择激活生物识别身份验证(指纹和面部识别)。患者可以使用自己的设备(包括 Android、iOS 或通过网页浏览器)访问 eCOA。
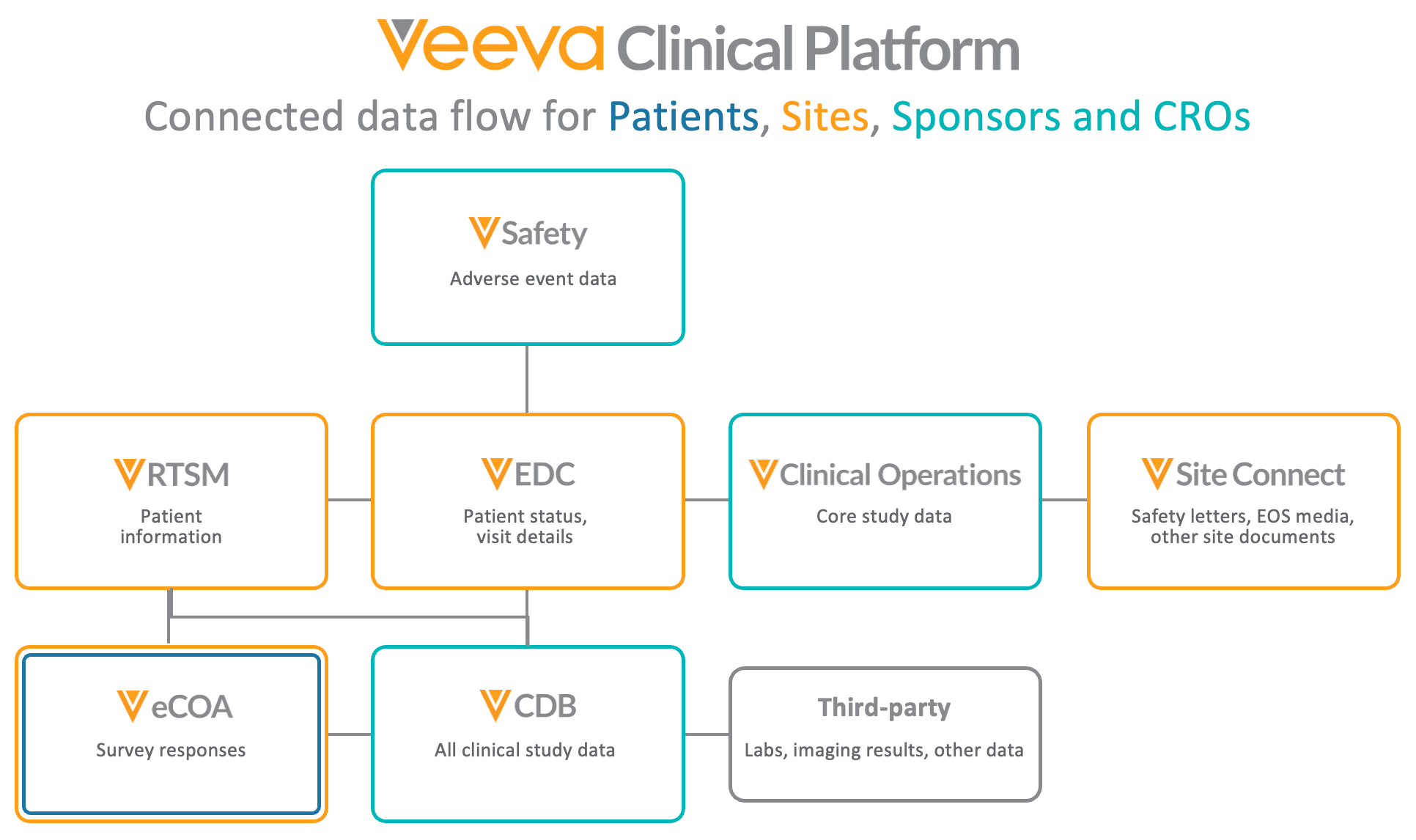
Veeva EDC 和 CDB 连接
Veeva EDC、CDB 和 eCOA 均属于更广泛的 Veeva 临床平台,并提供产品化连接,构建强大的统一架构,使数据能够在 Clinical Operations Vault、Clinical Data Vault 和 Safety Vault 之间流动。
Veeva Clinical 应用程序建立在共享的 Vault Platform 上,实现临床数据和运营之间的无缝连接。这种共享基础设施减少了手动核对,提供端到端可见性,使团队能减少数据录入时间,更多地提取推动生命科学行业发展的可操作见解。
Safety-EDC 连接
Veeva Safety 是个体病例安全报告(ICSR)管理系统,用于管理临床和上市后产品不良事件的接收、处理和提交,简化不良事件管理。Veeva Safety 通过药物安全链接与 EDC 集成,自动传输与安全相关的病例数据。这种连接确保准确、及时的 SAE 报告,同时减轻研究中心负担并减少手动转录错误。
通过 Safety-EDC 连接,Veeva EDC 和 Veeva Safety 之间的数据同步通过映射的数据字段进行管理和维护。组织可以轻松添加、修改或禁用默认字段,简化设置和配置。
Clinical Operations-EDC 连接
Veeva CTMS 是 Clinical Operations 平台的一部分,为内包和外包试验提供端到端研究管理和监查能力。Veeva CTMS 与 Veeva EDC 的连接支持监查和付款(通过 Veeva Payments),并提供研究统计数据(如入组状态)的实时可见性。研究中心工作人员可以从 Veeva CTMS 直接导航到 EDC 中的病例手册,无需单独登录。
Clinical Operations-EDC 连接通过 Veeva Vault 平台,以快速、简化的方式自动交换新记录和现有记录的更新,实现信息的无缝流动。字段映射弥合了 EDC 和 CTMS 之间的术语差异(如受试者事件和受试者访视)。
Veeva RTSM
Veeva RTSM 是一款可靠且用户友好的随机化和试验供应管理解决方案,旨在简化复杂流程并加快临床试验进度。通过与 Veeva EDC 安全、一致、可重复连接,在 Veeva RTSM 系统中录入的数据通过 REST API 实时发送到 Veeva EDC,并在 EDC 中自动创建受试者和事件,减少研究中心人员的重复数据录入需求,提高效率。