导出数据
可以将数据列表组合在一起,以便从 EDC“临床报告”的导出(Export)区域导出为导出定义。对于每个导出定义,他们可以从研究中添加一个或多个数据列表。生成导出数据包时,可以选择以 CSV 或 SAS(sas7bdat)格式生成。请注意,CSV 和 SAS 文件采用 UTF-8 编码。建议在 Excel™ 之类的程序中查看这些文件时将编码设置为 UTF-8。
在你选择所需的格式后,“临床报告”会生成一组文件,每个导出列表对应一个文件。生成导出数据包后,你或任何其他有权访问研究 的“临床报告”用户可以下载导出数据包(一个包含列表文件集合的 ZIP 文件(CSV 或 sas7bdat),以及描述数据包内容的清单“manifest.json”)。然后,你可以与研究利益相关者(例如监管机构、医疗监察员和统计学家)共享。你还可以将数据集从 EDC 工具(EDC Tools)中的研究数据提取作业发送到“临床报告”
先决条件
你可以根据系统生成的“核心列表”导出数据,但如果要从自定义列表格式导出数据,则必须首先创建列表。
默认情况下,具有标准 CDMS Lead Data Manager(CDMS 首席数据管理员)和 CDMS Data Manager(CDMS 数据管理员)研究角色的用户能够执行下述操作。如果你的组织使用自定义角色,则你的角色必须授予以下权限:
| 类型 | 权限标签 | 控制 |
|---|---|---|
| 功能权限 | ||
| 功能权限 | 查看病例手册 | 能够查看关于和来自受试者病例手册(Casebooks)的信息(针对报告、信息板和 CDB) |
| 功能权限 | 查看导出 | 能够访问“导出”页面 |
| 功能权限 | 创建导出定义 | 能够创建和复制“导出定义” |
| 功能权限 | 生成导出数据包 | 能够生成 CSV 或 SAS 导出数据包 |
| 功能权限 | 删除导出定义 | 能够删除“导出定义” |
| 功能权限 | 查看导出数据包 | 能够访问“导出>数据包”以查看生成的导出数据包 |
如果你的“研究”包含受限数据,你必须具有“受限数据访问”权限才能查看该数据。
了解有关“研究角色”的更多信息。
访问导出
可以从 EDC“临床报告”的导出区域访问导出定义。可以从导航抽屉(Navigation Drawer)或研究(Study)菜单导航到导出区域。
|
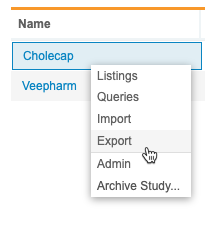
|
查看导出
导出页面有两个选项卡: 定义(Definitions)和 数据包(Packages)。从导出> 定义中,可以查看、创建和编辑研究 的导出定义。从导出> 数据包中,可以查看所有生成的导出数据包,并查看错误日志中是否有任何失败。
定义
“临床报告”在导出 > 定义中列出了研究的所有导出定义。下表详细介绍了导出定义 列表的每一列:
| 列 | 描述 |
|---|---|
| 名称 | 导出定义的标题,在定义创建期间定义。如果此定义设置了计划导出,“临床报告”会在此列中显示时钟图标()。将鼠标悬停在图标上以显示计划。 |
| 状态 | 导出定义可以处于以下两种状态之一:草稿 和已发布。 |
| 列表 | 导出定义 中的数据列表数。 |
| 类型 | 导出定义 的类型。有关详细信息,请参见下面的导出类型。 |
| 创建日期 | 导出定义创建的日期和时间以及创建该定义的用户的名称。 |
| 上次修改时间 | 上次修改导出定义 的日期和时间以及进行更改的用户的名称。 |
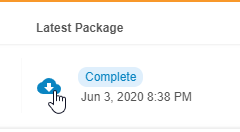
| 最新数据包 | 导出数据包的状态以及生成数据包的日期和时间。单击下载(Download)()下载数据包。 |
可以按最新数据包(Latest Package)、修改者(Modified By)、修改日期(Modified Date) 或名称(Name)对此列表进行排序。从排序依据(Sort By)菜单中选择排序列和顺序。
单击排序方式(Sort By)菜单中的重置(Reset)以返回到默认排序顺序(降序(Descending)、修改日期。
数据包
“临床报告”在导出(Export)> 数据包中列出了为研究 生成的所有数据包。下表列出了数据包列表每列的详细信息:
| 列 | 描述 |
|---|---|
| 名称 | 此列中列出了用于生成数据包的导出定义 的标题、生成数据包的日期 和时间 以及数据包中包含的列表数量。如果此数据包设置了计划导出,“临床报告”会在此列中显示时钟图标()。将鼠标悬停在图标上以显示运行的计划。 |
| 类型 | 此列中列出了用于生成数据包的导出定义 的类型。 |
| 处理者 | 启动数据包生成的用户的名称以及他们执行此操作的日期 和时间。 |
| 状态 | 此列中列出了数据包的状态:进行中、完成 或错误。完成 后,单击下载()下载数据包。 |
对数据包进行排序
可以按名称、处理者(Processed By)、处理日期(Process Date)和处理状态(Process Status)对此列表进行排序。从排序依据(Sort By)菜单中选择排序列和顺序。
单击排序方式(Sort By)菜单中的重置以返回到默认排序顺序(降序(Descending)、处理日期(Process Date))。
错误
如果数据包生成失败,可以从导出> 数据包中查看错误列表。
要查看错误,请执行以下操作:
- 导航到研究 的导出> 数据包。
- 在列表中找到失败的数据包。
- “临床报告”将打开问题(Issues)面板。这将列出在数据包生成过程中发生的每个错误。
- 可选:单击下载()下载问题日志。
- 单击关闭(Close)()关闭问题面板。
导出类型
“临床报告”支持两种导出类型:自定义和原始(在 25R1 版本中,SDTM 已弃用)。默认值为自定义(Custom),该类型允许创建自己的导出定义,而没有原始类型中包含的定义约定。
自定义
创建导出定义 时,通过选择自定义作为类型(Type),可以选择不使用原始(Raw)或 SDTM 格式。如果你不使用定义的格式,CDB 只会包含你在配置定义时定义的列表和数据。
原始
创建导出定义 时,可以选择使用“原始”格式(通过选择原始 作为类型)。原始导出数据包具有以下特征:
- 该数据包中包含研究中每个核心列表的导出列表,即使表单没有数据也是如此。
- 任何日期和日期时间条目都会同时显示默认格式和 RawDate() 格式。有关
RawDate()格式日期的示例,请参见下面的表。 - 带有单位的条目包括已转换名称和单位值的列。有关单位列的示例,请参见下面的表。
- 该数据包中包含用于上下文标题信息的其他系统列表。请参见下面的详细列表。
导出表单列表
除了表单 上的每个条目 的列外,原始导出中的每个表单列表还将包括以下列:
- Study.Name
- Site.Number
- Subject.Name
- EventGroup.Name
- EventGroup.SeqNbr
- Event.Name
- Event.Date
- Event.VisitMethod
- Event.Status
- Form.Name
- Form.DataSource
- Form.SeqNbr
- Form.LastModifiedDate
- ItemGroup.SeqNbr
系统列表
默认情况下,原始导出类型包括以下系统列表。这些列表为研究提供操作元数据。对于自定义(Custom)导出类型,默认不包括系统列表,但可以根据需要添加。
下表列出了每个系统列表 中包含的列。
| 系统列表 | CQL | 列 |
|---|---|---|
| Sys_Sites | CALL Sys_Sites |
|
| Sys_Subjects | CALL Sys_Subjects |
|
| Sys_Events | CALL Sys_Events |
* 只有启用了增量摄取的研究才提供该属性。如果没有为研究配置覆盖标签,则 CQL 将返回事件组标签和序列号。 |
| Sys_Forms | CALL Sys_Forms |
* 只有启用了增量摄取的研究才提供该属性。如果没有为研究配置覆盖标签,则 CQL 将返回事件组标签和序列号。 |
| Sys_ILB | CALL Sys_ILB |
* 只有启用了增量摄取的研究才提供该属性。如果没有为研究配置覆盖标签,则 CQL 将返回事件组标签和序列号。 |
| Sys_Links | CALL Sys_Links |
|
| Sys_PD | CALL Sys_PD |
* 只有启用了增量摄取的研究才提供该属性。如果没有为研究配置覆盖标签,则 CQL 将返回事件组标签和序列号。 |
核心列表
以下各列包含在配置了实验室或临床编码的核心列表中。
WHODrug 词典列的编码:
- 编码状态
- 词典版本
- 药物 CD
- 药物名称
- 首选 CD
- 首选名称
- ATC4CD
- ATC4
- ATC3CD
- ATC3
- ATC2CD
- ATC2
- ATC1CD
- ATC1
- 上次编码者
- 上次编码日期
MedDRA 词典列的编码:
- 编码状态
- 词典版本
- LLTCD
- LLT
- PTCD
- PT
- HLTCD
- HLT
- HLGTCD
- HLGT
- SOCCD
- SOC
- 主路径
- 上次编码者
- 上次编码日期
本地实验室列:
| 列 | 说明 |
|---|---|
| LBDTC | 收集日期时间 |
| LBDTC_RAW | 收集日期时间的原始值 |
| LBAGE | 实验室年龄 |
| LBAGE_UOM | 实验室年龄单位 |
| LBAGE_TRANSLATED | 实验室年龄已转换的值 |
| LBAGE_UOM_TRANSLATED | 实验室年龄换算单位 |
| LBTEST | 实验室测试 |
| LABMODIFIER | 实验室修改器 |
| LBORRES | 实验室结果 |
| DECODE_LBORRES | 实验室结果单位/代码列表 |
| TRANSLATED_LBORRES | 实验结果已转换的值 |
| UOMTRANSLATED_LBORRES | 实验结果换算单位 |
| LBORNRLO | 正常范围下限 |
| UOM_LBORNRLO | 正常范围下限单位 |
| TRANSLATED_LBORNRLO | 正常范围下限已转换的值 |
| UOMTRANSLATED_LBORNRLO | 正常范围下限换算单位 |
| LBORNRHI | 正常范围上限 |
| UOM_LBORNRHI | 正常范围上限单位 |
| TRANSLATED_LBORNRHI | 正常范围上限已转换的值 |
| UOMTRANSLATED_LBORNRHI | 正常范围上限换算单位 |
| LBOVRDNRLO | 正常范围覆盖下限 |
| UOM_LBOVRDNRLO | 正常范围覆盖下限单位 |
| TRANSLATED_LBOVRDNRLO | 正常范围覆盖下限单位已转换的值 |
| UOMTRANSLATED_LBOVRDNRLO | 正常范围覆盖下限换算单位 |
| LBOVRDNRHI | 正常范围覆盖上限 |
| UOM_LBOVRDNRHI | 正常范围覆盖上限已转换的值 |
| TRANSLATED_LBOVRDNRHI | 正常范围覆盖上限已转换的值 |
| UOMTRANSLATED_LBOVRDNRHI | 正常范围覆盖上限换算单位 |
| LBSTNRC | 代码列表/文本值的正常值 |
| DECODE_LBSTNRC | 代码列表/文本值解码的正常值 |
| LBOVRDNRC | 代码列表/文本值的正常值覆盖 |
| DECODE_LBOVRDNRC | 代码列表/文本值解码的正常值覆盖 |
| LBNRIND | 正常范围指示符 |
| LBCLSIG | 临床意义 |
原始日期格式
对于日期和日期时间条目,“临床报告”包括日期的默认日期格式和 RawDate() 格式。RawDate() 格式会不经任何修改显示部分日期和时间。
| 记录的日期或日期时间 | 原始格式 | |
|---|---|---|
| 1 | 27-10-2020 | 27-10-2020 |
| 2 | ?-10-2020 | UN-10-2020 |
| 3 | ?-?-2020 | UN-UNK-2020 |
| 4 | 27-10-2020 10:40 | 27-10-2020 10:40 |
| 5 | 27-10-2020 ? | 27-10-2020 UN:UN |
| 6 | ?-10-2020 ? | UN-10-2020 UN:UN |
| 7 | ?-?-2020 ? | UN-UNK-2020 UN:UN |
具有单位列的条目
对于单位类型的条目,“临床报告”包括已转换的名称和单位值的附加列。下表显示了“重量”条目包含的列,以千克为收集单位。
| 体重 | 重量_UOM | 重量_已转换 | 重量_UOM_已转换 |
|---|---|---|---|
| 65 | 千克 | 143.3 | 磅 |
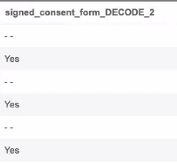
编码列表解码
原始导出定义包括编码列表条目的解码值。这些值显示在原始条目列之后的新列中,条目名称后附加”_DECODE“。如果列标题重复,名称后跟数字,如 2、3 或 4。
例如,“signed_consent_form_DECODE_2”:
仅为新的导出定义和修改的现有定义添加 DECODE。DECODE 列与 itemtype 属性一起包含在清单文件中。
重复列处理
“临床报告”允许重复列,并将在 UI 中显示它们。
系统生成的列(例如附加了“_RAW”或“_UOM”的列)会自动附加“_2”,以防止在某些情况下发生重复列冲突。在导出列表 导出为 CSV 或 SAS 之前的导出转换期间,会发生这种情况。
对于用户定义的条目名称,“临床报告”尝试通过在前面附加条目组 的名称 来保留原始名称。生成 CSV 或 SAS 文件时,会发生这种情况。
SDTM(已弃用)
创建导出定义 时,可以选择使用“SDTM”格式(通过选择 SDTM 作为类型)。SDTM 导出数据包具有以下特征:
- 每个列表 CSV 都包含一个域(列表的短标题)列。
- 列表 CSV 文件使用短标题(“short_title.csv”)命名。
- 所有日期、日期时间和时间条目都使用 ISO8601 格式。
- 未知日期和时间的格式如下表所示。
- 数据条目的列根据导出定义创建期间的选择,使用 EDC 定义的 SDTM 名称 或 外部 ID。
| 记录的日期或日期时间 | 不确定性区间 | 标称日期/时间(--DTC) | |
|---|---|---|---|
| 1 | 2020 年 3 月 15 日 13:14:17 | 完成日期 | 2020-03-14T13:14:17 |
| 2 | 2020 年 3 月 15 日 13:14 | 未知秒数 | 2020-03-15T13:14 |
| 3 | 2020 年 3 月 15 日 13 | 未知分钟数 | 2020-03-15T13 |
| 4 | 2020 年 3 月 15 日 | 未知时间 | 2020-03-15 |
| 5 | 2020 年 3 月 | 未知日 | 2020-03 |
| 6 | 2020 | 未知月份 | 2020 |
导出数据包中的受限(设盲)数据
“临床报告”根据导出定义 的设盲(Blinded)属性确定在导出数据包中包含受限(设盲)数据。
如果选中未设盲(Unblinded)复选框,并且一个或多个导出列表 包含受限数据,则“临床报告”仅允许具有受限数据访问 权限的用户下载生成的导出数据包。
如果导出列表包含受限(设盲)数据,则只有在研究角色 授予受限数据访问 权限的情况下,“临床报告”才会导出受限数据。默认情况下,此权限分配给具有标准 CDMS Lead Data Manager(CDMS 首席数据管理员)研究角色的用户。
下面的列表描述了“临床报告”在为未设盲导出定义生成数据包时如何处理受限数据:
- 源级限制:如果整个源 受到限制(仅适用于第三方数据),则设盲导出数据包将不包含来自此源的任何数据。如果列表仅包含来自受限源的数据,则“临床报告”不会将该列表信息包含在导出数据包中。
- 表单级别限制:如果表单 受到限制,则设盲的导出数据包将不包含该表单 中的任何数据。如果列表仅包含来自受限表单 的数据,则“临床报告”不会将该列表信息包含在导出数据包中。“临床报告”将不包括表单 的任何 @HDR、@Form 或 @ItemGroup 信息,并且表单 中的任何条目 也被排除在导出之外。
- 条目级限制:如果条目 受到限制,则设盲导出数据包将不包含此条目。“临床报告”不会在任何列表中包含该条目 的任何列。如果列表在列表定义 中使用此条目 来派生另一列的值,则该列也将被排除。
创建导出定义
要创建导出定义,请执行以下操作:
- 导航到导出> 定义。
- 输入导出定义 的标题(Title)。这将显示在导出定义 列表的名称列中。
- 选择原始(Raw)或 SDTM 作为类型(Type)以创建该类型的导出定义。否则,请将此项保留设置为无(None)。
- 如果选择 SDTM,则可以选择 使用 EDC 外部名称自动生成列标签(Auto generate column labels with EDC External name),以将 外部 ID 用于列标签。否则,请将此项保留设置为使用 EDC SDTM 名称自动生成列标签(Auto generate column labels with EDC SDTM name)以使用 SDTM 名称。
- 可选:输入描述(Description)。
- 单击下一步(Next)。
- 可选:单击展开或折叠以展开和折叠列表类别和导出定义。“临床报告”在可用列表(Available Listings)中按类别(Category)对列表进行分组,在导出定义中按导出定义 对列表进行分组。
-
将列表(Listing)或列表类别(Listing Category)从可用列表拖放到已选择列表(Selected Listings)。还可以将导出定义拖放到已选择列表,以自动添加该定义中的每个列表。

- 继续将列表拖放到已选择列表中,直到已选择列表包含导出定义 中所需的所有内容。
-
要从定义中移除列表,请单击移除(Remove)()。虽然在创建导出定义 时无法移除原始类型导出的系统列表,但可以稍后使用修改列表操作将其移除。

- 完成后,单击下一步(Next)。
- 可选:输入导出列表的短标题(Short Title)。“临床报告”使用短标题 作为导出数据包中列表的文件名,并在 SDTM 导出中填充域 列。
- 可选:编辑导出列表的标题。
- 点击 Save(保存)。
现在可以生成并下载此导出定义 的导出数据包。
导出商品创建:将列表添加到导出定义会该列表的副本创建为导出列表。对导出列表执行的任何操作仅适用于该商品,而不适用于原始核心列表或自定义列表。
导出定义工作流
所有导出定义都以草稿 状态开始。定义中的每个列表也从草稿 开始。将所有列表标记为就绪 后,导出定义 将进入已发布 状态。如果在任何时候列表变得无效,则导出定义 将进入草稿 状态。要返回到已发布,必须移除或更新无效列表。如果任何列表返回到草稿 状态,则导出定义 也会返回到草稿 状态。
可以为处于草稿 或已发布 状态的导出定义 生成导出数据包。
查看状态标志以识别导出列表 或导出定义 的状态。状态标志显示在定义列表、定义中的列表以及列表页面上。
如何将列表标记为就绪
要将导出列表 标记为就绪:
通过单击状态切换开关中的草稿(Draft)将列表返回到草稿 状态。
导出更改检测
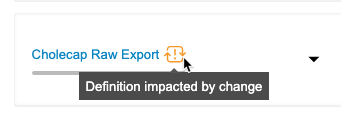
创建导出定义 时,它由导出列表 组成。这些导出列表是作为其创建来源的列表的快照。“父列表”是指用作创建导出列表来源的列表。当父列表的语法在上游更新时,在某些情况下,导出列表的列表定义 可能会与父列表的定义不同步。这可能导致导出数据包中的列表结构过时。例如,如果更新了公共自定义列表 的列表定义 语句,则从该父列表创建的任何导出列表 仍将反映创建导出列表 时使用的原始语句。
“临床报告”会在特定触发点检查导出定义的导出列表 的父列表是否有更改。当你或其他用户修改父列表时,临床报告会在导出定义 上显示更改指示符。然后,你可以选择查看列表定义 更改,并选择将导出列表 与父级同步。
必须是导出定义 的所有者或具有 Vault 所有者 安全配置文件才能将导出列表 与父级同步。
检测到的更改
“临床报告”仅检测同一环境中的更改,而不检测不同研究中的更改。
“临床报告”可检测以下更改:
- 列表定义 的更新
- 对研究设计的更改(例如,应用于原始或 SDTM 类型导出定义中使用的核心列表 的新条目 或条目组)
- 当子列表用作导出列表 时,对父列表的列表定义 的更新
仅当核心列表 在具有原始 类型的导出定义中使用时,“临床报告”才会考虑应用于该列表的研究设计更改。
“临床报告”不会将对列表名称 或其他属性的更新视为更改。
“临床报告”会检查以下事件的更改:
- 交换(成功导入后新数据可用时):“临床报告”会检查所有导出定义 中的更改。
- 已保存对公共自定义列表 或视图 的列表定义 的更改:“临床报告”会检查包含已修改列表或视图的导出定义 中的更改。
查看列表定义更改
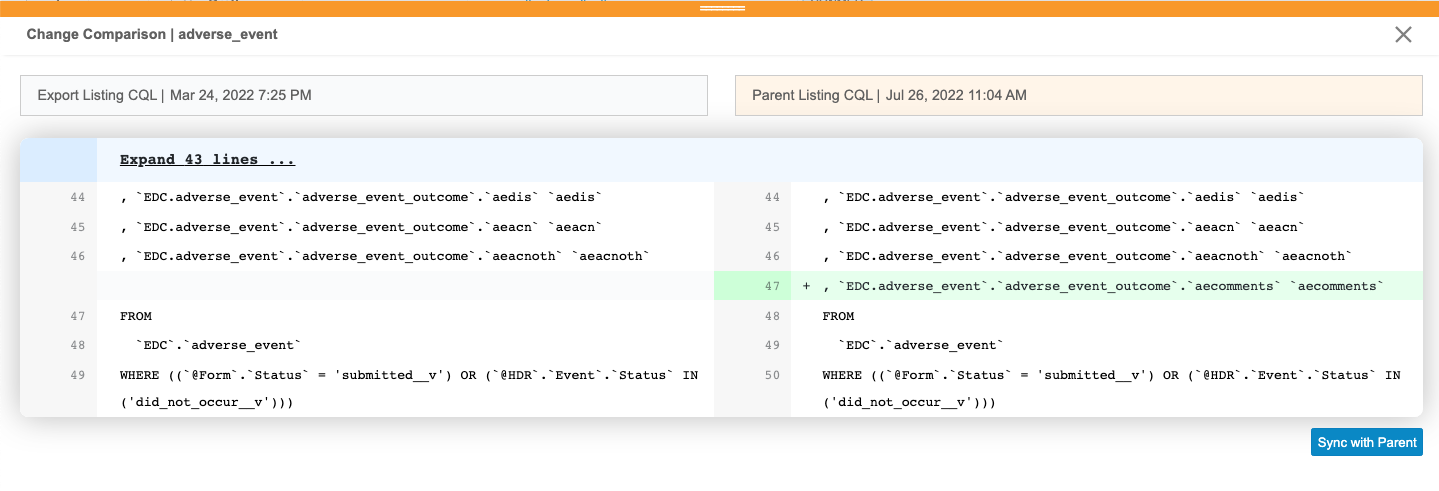
要查看更改,请执行以下操作:
- 导航到导出> 定义。
- 单击受影响(Impacted)筛选导出定义 列表,以仅显示受更改影响的定义。
- 单击以打开包含更改的导出定义(Export Definition)。
- 查看更改。
- 完成审查后,如果不想与父级同步,请单击关闭()关闭面板。
查看更改后,可以将列表与父级同步。
与父级同步
要将导出列表 与父级同步:
- 导航到受影响的导出定义。
- 单击受影响(Impacted)筛选导出列表 列表,以仅显示与其父级不同步的列表。
- 对于要同步的列表,请单击比较。
- 在更改比较面板中,单击与父级同步(Sync with Parent)。
- 在确认对话框中,单击确认(Confirm)。
要将多个导出列表 与其父级同步,请执行以下操作:
- 导航到受影响的导出定义。
- 单击受影响(Impacted)筛选导出列表 列表,以仅显示与其父级不同步的列表。
- 选中要同步的每个列表的导出列表(Export Listing)复选框。
- 可选:选中全选(Select All)复选框以选择当前页面上的所有列表。
- 在确认对话框中,单击确认(Confirm)。
编辑导出定义
创建导出定义 后,可以稍后返回并修改包含哪些列表、编辑定义的属性以及重命名列表。
请注意,只能保存对已创建定义的更改。要更改其他人的列表,可以创建该列表的副本以进行更改。
如何重命名列表
可以在导出定义 中轻松重命名导出列表。在此处重命名列表仅会重命名导出列表,而不会重命名原始数据列表。
要重命名列表,请执行以下操作:
如何修改包含的列表
可以在导出定义 中添加和移除列表。
要修改包含的列表,请执行以下操作:
- 导航到导出> 定义。
- 单击以打开导出定义。
- 可选:单击展开或折叠以展开和折叠列表类别和导出定义。“临床报告”在可用列表(Available Listings)中按类别(Category)对列表进行分组,在导出定义中按导出定义 对列表进行分组。
-
将列表(Listing)或列表类别(Listing Category)从可用列表拖放到已选择列表(Selected Listings)。还可以将导出定义拖放到已选择列表,以自动添加该定义中的每个列表。

- 继续将列表拖放到已选择列表中,直到已选择列表包含导出定义 中所需的所有内容。
- 单击下一步(Next)。
- 可选:输入导出列表的短标题(Short Title)。“临床报告”使用短标题 作为导出数据包中列表的文件名。
- 可选:编辑导出列表的标题。
- 点击 Save(保存)。
如何编辑导出定义属性
要编辑导出定义 的属性,请执行以下操作:
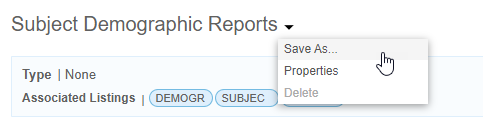
复制导出定义
可以使用另存为 复制导出定义。
要复制导出定义,请执行以下操作:
- 导航到导出> 定义。
- 单击以打开导出定义。
- 可选:输入新导出定义的标题。默认情况下,标题 是原始定义的标题,并附加一个“2”。
- 可选:输入描述(Description)。
- 点击 Save(保存)。
删除导出定义
请注意,只能删除已创建的导出定义。
要删除导出定义,请执行以下操作:
- 导航到导出> 定义。
- 在列表中找到导出定义。
- 从导出()菜单中,选择删除(Delete)。
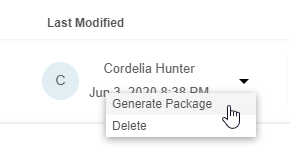
生成 & 下载导出数据包
可以从任何现有导出定义 生成和下载导出数据包,作为一组 CSV 或 SAS 文件和一个清单文件。
导出数据包过期:导出数据包生成后,在三十(30)天内可供下载。30 天后,该数据包将过期,用户必须重新生成它才能下载。如果修改了导出数据包,则 30 天期限将重新开始。
示例清单文件
清单文件由系统生成的列表和一个核心列表组成,每个列表包含以下信息:
- 用于创建文件的 CQL 的描述
- 列及其描述列表
- 对于条目,包含“名称”、“类型”、“条目类型”、“条目标签”、“源”和“表单”等属性
- 对于编码列表条目,包含“编码”和“解码”
有关示例清单文件,请参见下文。
受限数据:如果导出数据包设盲,则清单文件将指示每个设盲条目的设盲属性。
计划定期导出
可以计划每天、每周或每月导出,并选择用户以便在导出数据包可用时发送通知。计划导出完成数据包的生成后,可以从导出> 定义下载数据包,或通过 FTP 将其传送到选择的位置。
要计划定期导出,请执行以下操作:
- 导航到导出> 定义。
- 单击以打开导出定义。
- 从导出定义()菜单中,选择属性(Properties)。
- 单击编辑。
- 如果已存在计划导出,请单击 添加计划(Add Schedule)。每个导出定义最多可以有五(5)个计划导出。“临床报告”不允许重复计划(匹配日期、时间、间隔和格式)。
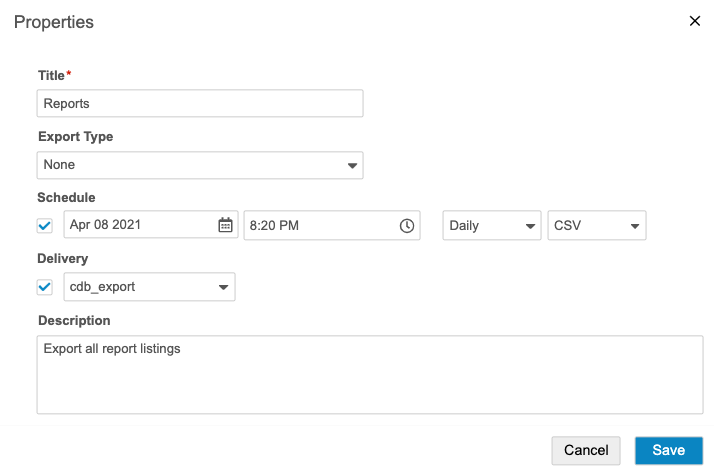
- 选中计划(Schedule)复选框。
- 选择日期日期(Date)和时间(Time)(UTC)。这是第一次导出的日期。然后,“临床报告”将在所选间隔(步骤 8)过去后生成未来的导出数据包。例如,如果选择“每周”和“2020 年 12 月 7 日凌晨 12:00”,则临床报告将在此时生成导出数据包,然后下一次导出将在“2020 年 12 月 14 日凌晨 12:00”(UTC)发生。
- 选择每天(Daily)、每周(Weekly)或每月(Monthly)作为间隔(Interval)。
- 选择 CSV 或 SAS 作为格式(Format)。这决定了“临床报告”为导出数据包生成的文件类型。
- 可选:选中传送(Delivery)复选框,然后选择 FTP 传送位置。有关创建传送目标的详细信息,请参见“创建 FTP 目标”。
- 点击 Save(保存)。
如何编辑计划导出
要编辑计划导出,请执行以下操作:
- 导航到导出> 定义。
- 单击以打开导出定义。
- 从导出定义()菜单中,选择属性(Properties)。
- 单击编辑。
- 根据需要对导出计划和传送进行更改。
- 点击 Save(保存)。
如何停止计划导出
可以随时停止计划导出。在再次开始导出之前,导出不会再次发生。
要停止计划导出,请执行以下操作:
- 导航到导出> 定义。
- 单击以打开导出定义。
- 从导出定义()菜单中,选择属性(Properties)。
- 单击编辑。
- 清除计划复选框。
- 点击 Save(保存)。
创建 FTP 连接
“临床报告”支持使用提供的 Vault FTP 服务器和第三方 FTP 服务器。如果计划使用所提供的 Vault FTP 服务器以外的位置,则必须已设置该服务器。
具有 Vault 所有者安全配置文件的用户可以从工具(Tools)> EDC 工具(EDC Tools)> FTP(FTPs)设置计划导出的目标。
如果 Vault 使用自定义研究角色,则你的角色必须具有以下权限:
| 类型 | 权限标签 | 权限 |
|---|---|---|
| “标准(Standard)”选项卡 | “EDC 工具”选项卡 | 能够访问 EDC 工具选项卡。 |
| 功能权限 | 管理 FTP | 能够在 EDC 工具中创建和编辑 FTP 连接。 |
要设置 FTP 连接,请执行以下操作:
- 在工具(Tools)> EDC 工具> FTP(FTPs)中导航到研究。
- 单击 + 新建 FTP(+ New FTP)。
-
输入 FTP 名称(FTP Name)。此名称将显示在导出定义的传送下拉菜单中(位于 EDC“临床报告”的“导出”部分)。
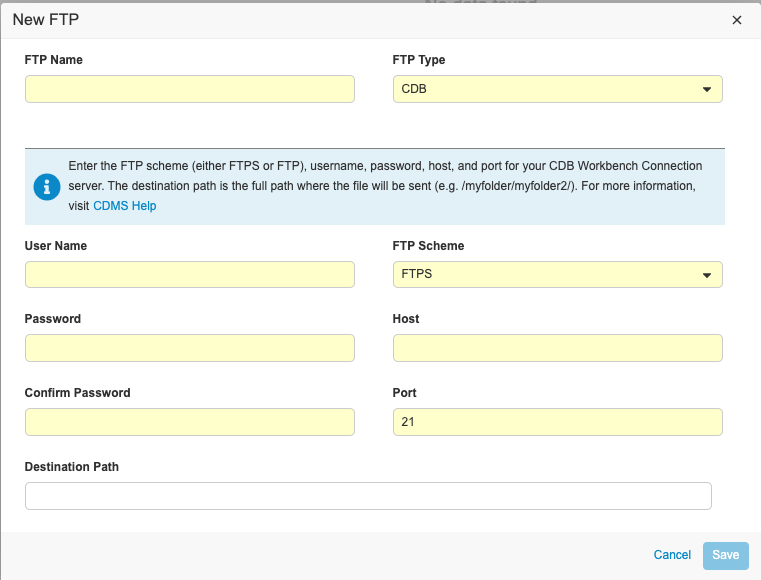
- 选择 CDB 作为类型,即使正在创建连接以将导出从“临床报告”发送到 Vault FTP 也一样。
- 输入用户名(User Name)。对于 Vault FTP 服务器,这是用于登录 Vault 的用户名,包括域名,主机在前面。例如,“verteopharma.veevavault.com+cordelia.hunter@verteopharma.com”。
- 输入密码(Password)。
- 确认密码。
- 选择 FTP 方案(FTP Scheme)。如果要将导出从“临床报告”发送到 Vault FTP 服务器,请选择 FTPS。
- 输入主机(Host)。对于 Vault FTP 服务器,这是 Vault 的 URL:{DNS}.veevavault.com。例如:“veepharm”是 veepharm.veevavault.com 中的 DNS。
- 输入端口(Port)。
- 输入要将数据包传送到的目标路径(Destination Path)。如有必要,可以在 FTP 服务器中创建目标路径,然后再输入到此处。要在 Vault FTP 服务器中创建目标路径,用户需要 API 访问权限。
- 点击保存。
有关连接字段详细信息以及如何编辑 FTP 记录的更多信息,请参见“从 EDC 工具连接到 FTP 服务器”。
订阅数据包通知
“临床报告”可以在导出数据包进入给定状态时发送电子邮件通知。与组织的用户管理员合作进行订阅。
临床报告 - 导出
上次更新时间:24R1
本能视频演示如何从 EDC“临床报告”导出报告。