データのエクスポート
EDC の臨床報告のエクスポート領域から、エクスポート定義として、エクスポート用にデータリストをグループ化することができます。各エクスポート定義に、複数の試験のデータリストを追加することができます。エクスポートパッケージを生成する際に、CSV または SAS (sas7bdat) フォーマットの生成を選択することができます。CSV ファイルと SAS ファイルのエンコーディングは UTF-8 です。Excel™ などのプログラムでこれらのファイルを表示する場合は、エンコードを UTF-8 に設定することが推奨されます。
希望する形式を選択すると、臨床報告はエクスポートリストごとにファイル一式を生成します。エクスポートパッケージを生成すると、お客様またはお客様の試験にアクセスできる他の臨床報告ユーザは、エクスポートパッケージ (CSV または sas7bdat のいずれかのリストファイルのコレクション、およびパッケージ内容を説明するマニフェストファイル「manifest.json」を含む ZIP ファイル) をダウンロードすることができます。次いでそれを規制当局、メディカルモニター、統計専門家などのスタディステークホルダーと共有することができます。EDC ツールの試験データ抽出ジョブから臨床報告にデータセットを送信することも可能です。
前提条件
システムが生成したコアリストに基づいてデータをエクスポートすることはできますが、カスタムリストフォーマットからデータのエクスポートをしたい場合は、リストを最初に作成する必要があります。
デフォルトでは、標準の CDMS リードデータマネージャおよび CDMS データマネージャのスタディロールを持つユーザは、以下に説明されているアクションを実行できます。組織がカスタムロールを使用する場合、そのロールには以下の権限を付与することが必要です:
| タイプ | 権限ラベル | 制御 |
|---|---|---|
| 機能権限 | ||
| 機能権限 | ケースブックの表示 | 対象ケースブックに関する情報および対象ケースブックからの情報を表示する権限 (レポート、ダッシュボード、および CDB 用) |
| 機能権限 | エクスポートの表示 | エクスポートページにアクセスする権限 |
| 機能権限 | エクスポート定義の作成 | エクスポート定義を作成およびコピーする権限 |
| 機能権限 | エクスポートパッケージの生成 | CSV または SAS のエクスポートパッケージを生成する権限 |
| 機能権限 | エクスポート定義の削除 | エクスポート定義を削除する権限 |
| 機能権限 | エクスポートパッケージの表示 | エクスポート > パッケージにアクセスし、生成されたエクスポートパッケージを表示する権限 |
治験に制限付きデータが含まれている場合、それを閲覧するには制限ありデータアクセス権限が必要です。
試験の役割について詳しくご確認ください。
エクスポートへのアクセス
EDC 臨床報告のエクスポート領域から、エクスポート定義にアクセスすることができます。エクスポート領域へは、ナビゲーションドロワーまたはスタディメニューから移動できます。
|
|
エクスポートの表示
エクスポートページには、定義およびパッケージの 2 つのタブがあります。エクスポート>定義から、 スタディのエクスポート定義の表示、作成、および編集ができます。エクスポート>パッケージから、生成済みのすべてのエクスポートパッケージを表示し、失敗した場合にはエラーログを確認することができます。
定義
臨床報告では、試験に関するすべてのエクスポート定義をエクスポート>定義に一覧表示しています。以下のテーブルは、エクスポート定義のリストの各列の詳細を示します:
| 列 | 説明 |
|---|---|
| 名前 | エクスポート定義のタイトルで、作成中に定義されます。臨床報告では、この定義にスケジュールされたエクスポートが設定されている場合、この列に時計アイコン () が表示されます。アイコンにカーソルを合わせると、スケジュールが表示されます。 |
| ステータス | エクスポート定義は、は、以下の 2 つのうちのいずれかである可能性があります: 下書き および公開済み。 |
| リスト | エクスポート定義内のデータリストの数。 |
| タイプ | エクスポート定義のタイプ。詳しくは、以下のエクスポートタイプを参照してください。 |
| 作成日 | エクスポート定義の作成日時および作成者の名前。 |
| 最終更新 | エクスポート定義および変更を追加したユーザの名前に対する最終更新の日付と時刻 |
| 最新パッケージ | エクスポートパッケージのステータス、およびパッケージが生成された日付と時刻。ダウンロード () をクリックして、パッケージをダウンロードします。 |
このリストは、最新パッケージ、変更者、変更日、または名前で並べ替えることができます。並べ替えメニューから、並べ替える列および順序を選択します。
並べ替えメニューにあるリセットをクリックして、デフォルトの並べ替え順に戻します (降順、変更日)。
パッケージ
臨床報告のエクスポート > パッケージに、試験用に生成されたすべてのパッケージが一覧表示されます。以下のテーブルは、パッケージ一覧の各列の詳細を一覧表示します:
| 列 | 説明 |
|---|---|
| 名前 | この列には、パッケージの生成に使用されたエクスポート定義のタイトル、パッケージが作成された日付と時刻、およびパッケージに含まれるリストの数が表示されます。臨床報告では、このパッケージにスケジュールされたエクスポートが設定されている場合、この列に時計アイコン () が表示されます。アイコンにカーソルを合わせると、実行したスケジュールが表示されます。 |
| タイプ | この列には、パッケージの生成に使用されたエクスポート定義のタイプが一覧表示されます。 |
| 処理者 | パッケージの生成を開始したユーザの名前、およびその生成が開始された日付と時刻。 |
| ステータス | この列には、パッケージのステータス (進行中、完了、またはエラー) が一覧表示されます。完了したら、ダウンロード () をクリックして、パッケージをダウンロードします。 |
パッケージの並べ替え
このリストは、名前、処理者、処理日、処理ステータスによって並べ替えることができます。並べ替えメニューから、並べ替える列および順序を選択します。
並べ替えメニューにあるリセットをクリックして、デフォルトの並べ替え順に戻します (降順、処理日)。
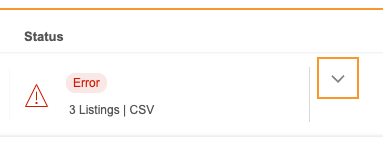
エラー
パッケージの生成に失敗した場合、エクスポート >パッケージからエラーを一覧表示することができます。
エラーを表示するには:
- 試験のエクスポート > パッケージに進みます。
- リスト内で失敗したパッケージを特定します。
- 臨床報告で問題パネルが開きます。 パッケージ生成中に発生した各エラーが一覧表示されます。
- オプション: ダウンロード () をクリックすると、問題ログがダウンロードできます。
- 閉じる () をクリックして問題パネルを閉じます。
エクスポートタイプ
臨床報告では以下の 2 種類のエクスポートをサポートしています: カスタムおよび Raw (SDTM は 25R1 リリースで廃止済み)。デフォルトはカスタムで、Raw タイプのエクスポートに含まれる定義された規約なしに、独自のエクスポート定義を作成できます。
カスタム
エクスポート定義の作成の際、タイプでカスタムを選択することにより、Raw または SDTM フォーマットを使用しないことを選択することができます。定義済みのフォーマットを使用しない場合、CDB は定義の設定時に定義したリストとデータのみを含めます。
Raw
エクスポート定義を作成する際に、Raw 形式を選択することができます (タイプで Raw を選択することにより)。Raw エクスポートパッケージには、次のような特徴があります:
- パッケージには、フォームにデータがない場合でも、スタディ内の各コアリストのエクスポートリストが含まれます。
- 日付および日時の項目には、デフォルトと RawDate() 形式の両方が表示されます。
RawDate()形式の日付の例については、以下のテーブルを参照してください。 - 単位のある項目には、翻訳された名前および単位値の列が含まれる。単位列の例については、以下のテーブルを参照してください。
- パッケージには、コンテキストに応じたヘッダー情報のための追加のシステムリストが含まれています。以下の詳細なリストを参照してください。
フォームのエクスポートリスト
Raw エクスポートにおける各フォームのリストには、フォーム上の各項目の列に加えて、以下の列が含まれます:
- Study.Name
- Site.Number
- Subject.Name
- EventGroup.Name
- EventGroup.SeqNbr
- Event.Name
- Event.Date
- Event.VisitMethod
- Event.Status
- Form.Name
- Form.DataSource
- Form.SeqNbr
- Form.LastModifiedDate
- ItemGroup.SeqNbr
システムリスト
Raw エクスポートタイプはデフォルトで以下の System Listings を含みます。これらのリストは、スタディ用の運用メタデータを提供します。カスタムのエクスポートタイプ、システムリストはデフォルトでは含まれませんが、必要に応じて追加できます。
以下のテーブルは、各システムリストに含まれる列の一覧です。
| システムリスト | CQL | 列 |
|---|---|---|
| Sys_Sites | CALL Sys_Sites |
|
| Sys_Subjects | CALL Sys_Subjects |
|
| Sys_Events | CALL Sys_Events |
* このプロパティは、増分インジェストが有効化されているスタディでのみ利用可能です。ラベル上書きがスタディに設定されていない場合、CQL は事象グループラベルとシーケンス番号を返します。 |
| Sys_Forms | CALL Sys_Forms |
* このプロパティは、増分インジェストが有効化されているスタディでのみ利用可能です。ラベル上書きがスタディに設定されていない場合、CQL は事象グループラベルとシーケンス番号を返します。 |
| Sys_ILB | CALL Sys_ILB |
* このプロパティは、増分インジェストが有効化されているスタディでのみ利用可能です。ラベル上書きがスタディに設定されていない場合、CQL は事象グループラベルとシーケンス番号を返します。 |
| Sys_Links | CALL Sys_Links |
|
| Sys_PD | CALL Sys_PD |
* このプロパティは、増分インジェストが有効化されているスタディでのみ利用可能です。ラベル上書きがスタディに設定されていない場合、CQL は事象グループラベルとシーケンス番号を返します。 |
主要リスト
以下の列は、Labs または Clinical Coding で設定された Core Listings に含まれます。
Coding for WHODrug Dictionary Columns:
- コーディングステータス
- DictionaryRelease
- DrugCD
- DrugName
- PreferredCD
- PreferredName
- ATC4CD
- ATC4
- ATC3CD
- ATC3
- ATC2CD
- ATC2
- ATC1CD
- ATC1
- LastCodedBy
- LastCodedDate
MedDRA 辞書列のコーディング:
- コーディングステータス
- DictionaryRelease
- LLTCD
- LLT
- PTCD
- PT
- HLTCD
- HLT
- HLGTCD
- HLGT
- SOCCD
- SOC
- PrimaryPath
- LastCodedBy
- LastCodedDate
ローカルラボ列:
| 列 | 説明 |
|---|---|
| LBDTC | コレクション日時 |
| LBDTC_RAW | コレクション日時の Raw 値 |
| LBAGE | Lab Age |
| LBAGE_UOM | ラボ年齢単位 |
| LBAGE_TRANSLATED | ラボ年齢換算値 |
| LBAGE_UOM_TRANSLATED | ラボ年齢換算単位 |
| LBTEST | LAB テスト |
| LABMODIFIER | ラボ修飾子 |
| LBORRES | LAB 結果 |
| DECODE_LBORRES | ラボ結果単位/コードリスト |
| TRANSLATED_LBORRES | ラボ結果換算値 |
| UOMTRANSLATED_LBORRES | ラボ結果換算単位 |
| LBORNRLO | 正常範囲の下限値 |
| UOM_LBORNRLO | 正常範囲の下限値単位 |
| TRANSLATED_LBORNRLO | 正常範囲下限換算値 |
| UOMTRANSLATED_LBORNRLO | 正常範囲の下限換算値単位 |
| LBORNRHI | 正常範囲の上限値 |
| UOM_LBORNRHI | 正常範囲の上限値単位 |
| TRANSLATED_LBORNRHI | 正常範囲の上限換算値 |
| UOMTRANSLATED_LBORNRHI | 正常範囲の上限換算値単位 |
| LBOVRDNRLO | 正常範囲が下限値をオーバーライドする |
| UOM_LBOVRDNRLO | 正常範囲が下限値単位をオーバーライドする |
| TRANSLATED_LBOVRDNRLO | 正常範囲が下限換算値をオーバーライドする |
| UOMTRANSLATED_LBOVRDNRLO | 正常範囲が下限換算値単位をオーバーライドする |
| LBOVRDNRHI | 正常範囲が上限値をオーバーライドする |
| UOM_LBOVRDNRHI | 正常範囲が上限換算値をオーバーライドする |
| TRANSLATED_LBOVRDNRHI | 正常範囲が上限換算値をオーバーライドする |
| UOMTRANSLATED_LBOVRDNRHI | 正常範囲が上限換算値単位をオーバーライドする |
| LBSTNRC | コードリスト/テキスト値の正常値 |
| DECODE_LBSTNRC | コードリスト/テキスト値の正常値デコード |
| LBOVRDNRC | 正常値がコードリスト/テキスト値の正常値をオーバーライドする |
| DECODE_LBOVRDNRC | 正常値がコードリスト/テキスト値の正常値をオーバーライドするデコード |
| LBNRIND | 正常範囲インジケータ |
| LBCLSIG | 臨床的意義 |
Raw 日付フォーマット
日付および日時の項目に対して、臨床報告にはデフォルトの日付フォーマットと RawDate() フォーマットが含まれています。RawDate() フォーマットでは、日付と時刻の一部が変更なしで表示されます。
| 記録された日付または日時 | 未加工フォーマット | |
|---|---|---|
| 1 | 27-Oct-2020 | 27-Oct-2020 |
| 2 | ?-Oct-2020 | UN-Oct-2020 |
| 3 | ?-?-2020 | UN-UNK-2020 |
| 4 | 27-Oct-2020 10:40 | 27-Oct-2020 10:40 |
| 5 | 27-Oct-2020 ? | 27-Oct-2020 UN:UN |
| 6 | ?-Oct-2020 ? | UN-Oct-2020 UN:UN |
| 7 | ?-?-2020 ? | UN-UNK-2020 UN:UN |
単位の列を持つ項目
ユニットタイプの項目では、臨床報告は翻訳された名前と単位値のための追加の列を含めます。以下のテーブルは、キログラム単位で収集される「体重」項目に対して、含まれる列を示しています。
| 体重 | Weight_UOM | Weight_TRANSLATED | Weight_UOM_TRANSLATED |
|---|---|---|---|
| 65 | kgs | 143.3 | lbs |
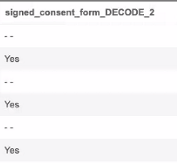
コードリストのデコード
Raw エクスポートの定義には、コードリスト項目のデコード値が含まれます。これらの値は、元のアイテム列の後に、アイテム名に _DECODE が追加された新しい列に表示されます。列ヘッダーが重複している場合は、名前の後に 2、3、4 などの数字が付きます。
例: 「signed_consent_form_DECODE_2」:
DECODE は、新しい輸出定義と変更された既存の定義にのみ追加されます。DECODE 列はitemtype属性と一緒にマニフェストファイルに含まれます。
重複列の処理
臨床報告は重複した列を許容し、それらを UI に表示します。
例えば、「_RAW」や「_UOM」が付加された列など、システムが生成した列には、特定のシナリオで重複列の衝突を防ぐために、自動的に「_2」が付加されます。これは、エクスポートリストが CSV または SAS にエクスポートされる前の、エクスポート変換時に発生します。
ユーザ定義の項目名に対して、臨床報告は項目グループの名前を前に付けて元の名前を保持しようとするためです。これは、 CSV または SAS ファイルが生成されるときに発生します。
SDTM (廃止予定)
エクスポート定義を作成する際に、SDTM 形式を選択することができます (タイプで SDTM を選択することにより)。SDTM エクスポートパッケージには、次のような特徴があります:
- すべてのリスト CSV には、ドメイン (リストの短いタイトル) の列があります。
- リスト CSV ファイルには、短いタイトル (「short_title.csv」) を使用して名前が付けられます。
- 日付、日時、および時刻の項目には、すべて ISO8601 形式が使用されます。
- 不明な日時は以下のテーブルに示すような書式になります。
- データ項目の列には、エクスポート定義作成時の選択に基づいて、その EDC 定義の SDTM 名または外部 ID が使用されます。
| 記録された日付または日時 | 不確実性の範囲 | 公称日付/時刻 (--DTC) | |
|---|---|---|---|
| 1 | 2020年3月15日 13:14:17 | 完全な日付け | 2020-03-14T13:14:17 |
| 2 | 2020年3月15日 13:14 | 秒が不明 | 2020-03-15T13:14 |
| 3 | March 15, 2020 13 | 分が不明 | 2020-03-15T13 |
| 4 | 2020 年 3 月 15 日 | 時刻が不明 | 2020-03-15 |
| 5 | March, 2020 | 日が不明 | 2020-03 |
| 6 | 2020 | 月が不明 | 2020 |
エクスポートパッケージにおける制限付き (盲検化) データ
臨床報告は、エクスポート定義の盲検化されたプロパティに基づいて、エクスポートパッケージに制限された (盲検化された) データを含めるかどうかを決定します。
盲検化を解除チェックボックスが選択され、1 つまたは複数のエクスポートリストが制限付きデータを含む場合、臨床報告は制限付きデータアクセス権限を持つユーザにのみ、結果のエクスポートパッケージをダウンロードすることを許可します。
エクスポートリストに制限付き (盲検化) データが含まれる場合、試験ロールが制限付きデータアクセス権限を付与している場合にのみ、臨床報告は制限付きデータをエクスポートします。デフォルトでは、この権限は標準的な CDMS リードデータマネージャの試験ロールを持つユーザに割り当てられています。
以下のリストでは、非盲検化エクスポート定義のパッケージを生成する際に、臨床報告が制限付きデータをどのように扱うかが説明されています:
- ソースレベルの制限: ソース全体に制限がある場合 (サードパーティデータにのみ可能)、盲検化済みのエクスポートパッケージにはこのソースからのデータが含まれません。リストが制限付きソースからのデータのみを持つ場合、臨床報告はそのリストをエクスポートパッケージに含めません。
- フォームレベルの制限: フォームが制限付きの場合、盲検化済みのエクスポートパッケージには、そのフォームからのデータは含められません。リストが制限付きフォームからのデータのみを持つ場合、臨床報告はそのリストをエクスポートパッケージに含めません。臨床報告はそのフォームの @HDR、@Form、および @ItemGroup の情報を含めず、フォームのすべての項目もエクスポートから除外されます。
- 項目レベルの制限: 項目が制限付きの場合、盲検化済みのエクスポートパッケージはこの項目を含めません。臨床報告は、リストにこの項目の列を含めません。リストがこの項目をリスト定義で使用して別の列の値を導き出す場合、その列も除外されます。
エクスポート定義の作成
エクスポート定義を作成するには:
- エクスポート > 定義に進みます。
- エクスポート定義にタイトルを入力します。これは、エクスポート定義リストの名前の列に表示されます。
- タイプでRaw または SDTM を選択します。それ以外の場合は、None のままに設定します。
- SDTM を選択した場合、外部名で列ラベルを自動生成を選択すると、列ラベルに外部 ID を使用することができます。それ以外の場合は、EDC SDTM 名で列ラベルを自動生成のままに設定し、SDTM 名を使用します。
- 任意の作業: 説明を入力します。
- 次へをクリックします。
- オプション: 展開または折りたたみをクリックして、リストカテゴリおよびエクスポート定義を展開、または折りたたむことができます。臨床報告は、エクスポート定義で、カテゴリ別に利用可能なリストとエクスポート定義によりリストをグループ化します。
-
利用可能なリストから、リストまたはリストカテゴリを選択済みリストにドラッグアンドドロップします。また、エクスポート定義を選択済みリストにドラッグアンドドロップすると、その定義に含まれるすべてのリストを自動的に追加することができます。

- エクスポート定義に必要なリストがすべて含まれるようになるまで、選択済みリストにリストのドラッグアンドドロップを続けます。
-
定義からリストを削除するには、削除 () をクリックします。エクスポート定義の作成時に Raw タイプエクスポートのシステムリストを削除することはできませんが、後でリストの修正アクションで削除することができます。

- 終了したら、次へをクリックします。
- 任意の作業: エクスポートリストに短いタイトルを入力します。臨床報告では、この短いタイトルをエクスポートパッケージ内のリストのファイル名として、SDTM エクスポート のドメイン列に入力するために使用します。
- 任意の作業: エクスポートリストのタイトルを編集します。
- 保存をクリックします。
このエクスポート定義のエクスポートパッケージを生成してダウンロードすることができるようになります。
エクスポートリストの作成: エクスポート定義にリストを追加すると、そのリストのコピーがエクスポートリストとして作成されます。エクスポートリスト上で行うアクションは、そのリストのみに適用され、元のコアまたはカスタムリストには適用されません。
エクスポート定義ワークフロー
すべてのエクスポート定義は、下書きステータスで開始します。定義内の各リストも下書きで開始します。すべてのリストが準備完了としてマークされると、エクスポート定義は公開済みステータスに移行します。リストが無効になった場合、エクスポート定義は下書きステータスに移行します。公開済みに戻すには、無効なリストを削除または更新する必要があります。リストが下書きに戻った場合、エクスポート定義も下書きステータスに戻ります。
下書きまたは公開済みステータスにあるエクスポート定義に対して、エクスポートパッケージを生成することができます。
エクスポートリストまたはエクスポート定義のステータスを確認するには、ステータスバッジを参照してください。ステータスバッジは、定義リスト、定義内リストのリスト、およびリストページに表示されます。
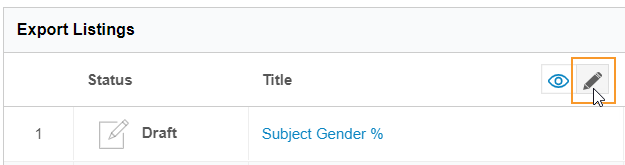
リストを準備完了とマークする方法
エクスポートリストを準備完了とマークするには:
ステータストグルの下書きをクリックしてリストを下書きステータスに戻すことができます。
エクスポート変更検知
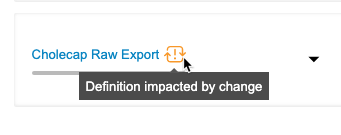
エクスポート定義を作成すると、エクスポートリストで構成されます。これらのエクスポートリストは、エクスポートリストの作成元となったリストのスナップショットです。「親リスト」とは、エクスポートリストを作成するためのソースとして使用されたリストを指します。親リストの構文がアップストリームで更新されると、場合によってはエクスポートリストのリスト定義が親リストの構文と同期しなくなることがあります。これにより、エクスポートパッケージのリスト構造が古くなる場合があります。例えば、公開カスタムリストのリスト定義文が更新された場合、その親リストから作成されたエクスポートリストには、エクスポートリストが作成された元の文が引き続き反映されます。
臨床報告は、特定のトリガーポイントで、エクスポート定義のエクスポートリストの親リストに変更がないかどうかをチェックします。ユーザが親リストを変更すると、臨床報告はエクスポート定義に変更のインジケータを表示します。次に、任意の作業としてリスト定義の変更をレビューし、エクスポートリストを親と同期させるかどうかを選択できます。
エクスポートリストを親と同期させるには、エクスポート定義の所有者であるか、Vault オーナーセキュリティプロファイルを有している必要があります。
検出された変更
臨床報告は同じ環境内での変更のみを検出し、異なる試験間での変更は検出しません。
臨床報告では、次の変更が検出されます:
- リスト定義の更新
- Raw または SDTM タイプのエクスポート定義で使用されるコアリストに適用される、新規項目または項目グループなどの試験デザインへの変更
- 子リストがエクスポートリストとして使用される親リストのリスト定義の更新
臨床報告は、Raw タイプを使用したエクスポート定義でコアリストが使用されている場合、そのリストに適用される試験デザインの変更のみを考慮します。
臨床報告は、リストの名前またはその他のプロパティの更新を変更として考慮しません。
臨床報告は、以下のイベントについて変更をチェックします:
- スワップ (インポートが正常に行われた後、新しいデータが利用可能になった場合): 臨床報告はエクスポート定義全体にわたって変更をチェックします。
- 公開カスタムリストまたはビューに対するリスト定義の保存済みの変更: 臨床報告 は、変更が加えられたリストまたはビューを含むエクスポート定義に変更があるかどうかをチェックします。
リスト定義の変更のレビュー
変更をレビューするには:
- エクスポート > 定義に進みます。
- 影響をクリックして変更によって影響を受ける物だけを表示するようエクスポート定義のリストをフィルタリングします。
- クリックして変更を含むエクスポート定義を開きます。
- 変更内容の確認
- レビューの終了後、親と同期させたくない場合は、閉じる () をクリックしてパネルを閉じます。
変更をレビューしたら、リストを親と同期させることができます。
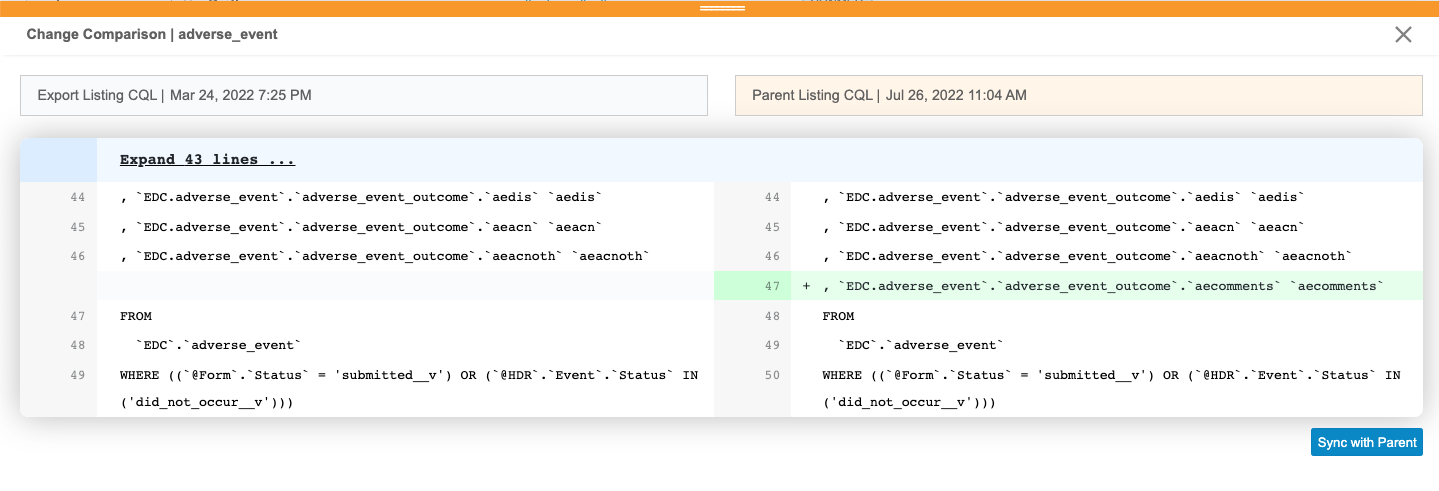
親との同期
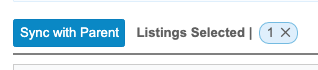
エクスポートリストを親と同期させるには:
- 影響を受けるエクスポート定義に移動します。
- 影響をクリックしてエクスポート定義のリストで親と同期していないものだけを表示するようフィルタリングします。
- 同期するリストの比較をクリックします。
- 変更比較パネルで、親と同期をクリックします。
- 確認ダイアログで、確認をクリックします。
複数のエクスポートリストを親と同期させるには:
- 影響を受けるエクスポート定義に移動します。
- 影響をクリックしてエクスポート定義のリストで親と同期していないものだけを表示するようフィルタリングします。
- 同期させる各リストのエクスポートリストチェックボックスを選択します。
- 任意の作業: すべて選択チェックボックスを選択して、現在のページのリストのすべてを選択します。
- 確認ダイアログで、確認をクリックします。
エクスポート定義の編集
エクスポート定義の作成後、後で戻って含めるリストの変更、定義のプロパティの編集、およびリストの名前の変更を行うことができます。
定義を保存できるのはその定義の作成者のみです。別の人のリストに変更を加えるには、そのリストのコピーを作成して、それに変更を加えることができます。
リストの名前を変更する方法
エクスポート定義では、エクスポートリストの名前を簡単に変更できます。ここでリストの名前を変更すると、エクスポートリストの名前のみが変更されます。元のデータリストの名前は変更されません。
リストの名前を変更するには:
含められたリストを修正する方法
エクスポート定義からリストを追加および削除することができます。
含められたリストを修正するには:
- エクスポート > 定義に進みます。
- エクスポート定義をクリックして開きます。
- オプション: 展開または折りたたみをクリックして、リストカテゴリおよびエクスポート定義を展開、または折りたたむことができます。臨床報告は、エクスポート定義で、カテゴリ別に利用可能なリストとエクスポート定義によりリストをグループ化します。
-
利用可能なリストから、リストまたはリストカテゴリを選択済みリストにドラッグアンドドロップします。また、エクスポート定義を選択済みリストにドラッグアンドドロップすると、その定義に含まれるすべてのリストを自動的に追加することができます。

- エクスポート定義に必要なリストがすべて含まれるようになるまで、選択済みリストにリストのドラッグアンドドロップを続けます。
- 次へをクリックします。
- 任意の作業: エクスポートリストに短いタイトルを入力します。臨床報告は、この短いタイトルをエクスポートパッケージのリストのファイル名として使用します。
- 任意の作業: エクスポートリストのタイトルを編集します。
- 保存をクリックします。
エクスポート定義プロパティを編集する方法
エクスポート定義のプロパティを編集するには:
- エクスポート > 定義に進みます。
- エクスポート定義をクリックして開きます。
- 保存をクリックします。
エクスポート定義のコピー
名前を付けて保存を使用してエクスポート定義をコピーすることができます。
エクスポート定義をコピーするには:
- エクスポート > 定義に進みます。
- エクスポート定義をクリックして開きます。
- 任意の作業: 新規のエクスポート定義にタイトルを入力します。デフォルトでは、タイトルは元の定義タイトルに「2」が付加されたものになります。
- 任意の作業: 説明を入力します。
- 保存をクリックします。
エクスポート定義の削除
エクスポート定義を削除できるのはその定義の作成者のみです。
エクスポート定義を削除するには:
- エクスポート > 定義に進みます。
- リストの中でエクスポート定義特定します。
- エクスポート () メニューから、削除を選択します。
エクスポートパッケージの生成 & ダウンロード
既存のエクスポート定義から、CSV または SAS ファイルとマニフェストファイルのセットとしてエクスポートパッケージを生成してダウンロードすることができます。
- エクスポート > 定義に進みます。
- リストの中でエクスポート定義特定します。
- エクスポートの形式として、CSV または SAS を選択します。
- 臨床報告でパッケージを生成したら、ダウンロード () をクリックしてエクスポートパッケージ (ZIP) をダウンロードします。
エクスポートパッケージの失効: エクスポートパッケージのが生成後、最大で 30 日間ダウンロードすることが可能です。30 日後にパッケージは失効し、ユーザはダウンロードするためにパッケージを再度生成する必要があります。エクスポートパッケージが変更された場合、その時点から 30 日間の有効期限が再度開始されます。
マニフェストファイル例
マニフェストファイルは、システムによって生成されたリストと 1 つのコアリストで構成され、それぞれに次の内容が記載されます:
- ファイルの作成に使用された CQL の説明
- 列のリストおよびその説明
- 項目、名前、タイプ、項目タイプ、項目ラベル、ソース、フォームなどの属性の場合
- コードリスト項目、コード、およびデコードの場合
マニフェストファイル例については以下を参照してください。
制限付きデータ: エクスポートパッケージが盲検化されている場合、マニフェストファイルには、各盲検化項目の盲検化属性が示されます。
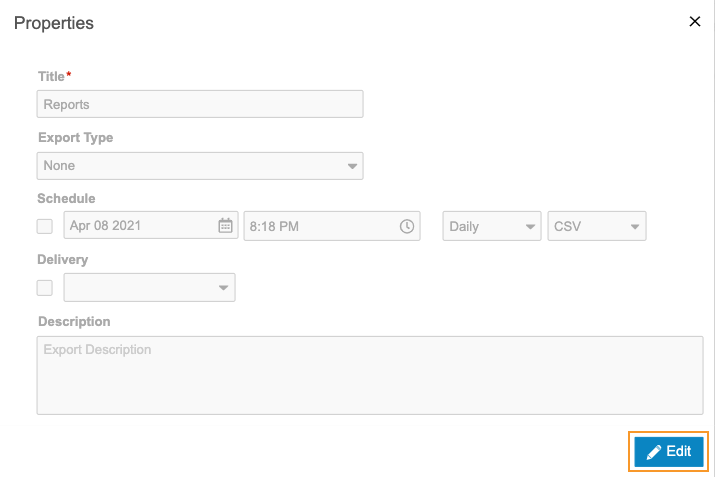
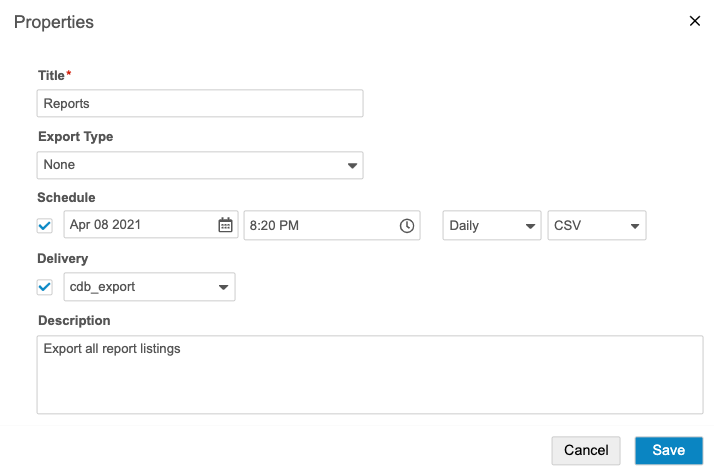
定期的なエクスポートのスケジュール
日次、週次、または月次のエクスポートをスケジュールし、エクスポートパッケージが利用可能になったことを通知するユーザを選択することができます。スケジュールされたエクスポートがパッケージの生成の終了後、エクスポート > 定義からダウンロードするか、FTPで任意の場所に配信することができます。
定期的なエクスポートをスケジュールするには:
- エクスポート > 定義に進みます。
- エクスポート定義をクリックして開きます。
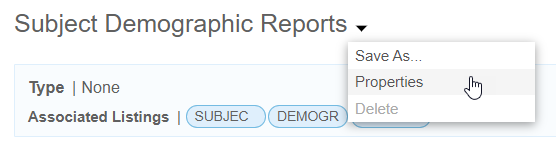
- エクスポート 定義() メニューから、プロパティを選択します。
- 編集をクリックします。
- スケジュール済みのエクスポートが既に存在する場合は、スケジュールの追加をクリックします。エクスポート定義 1 つに対して、最大 5 つまでスケジュール済みエクスポートを持つことができます。臨床報告は、スケジュール (日付、時間、間隔、および形式が一致する) の重複を許可しません。
- スケジュールチェックボックスを選択します。
- 日付および時刻 (UTC) を選択します。これが最初のエクスポートの日付です。選択したインターバル (ステップ 8) が経過した後、臨床報告は将来のエクスポートパッケージを生成します。例えば、「週ごと」および「2020 年 12 月 7 日、午前 12:00」を選択すると、臨床報告はその時間にエクスポートパッケージを生成し、次のエクスポートは「2020 年 12 月 14 日、午前 12:00 (UTC)」に実行されることになります。
- 日次、週次、または月次をインターバルとして選択します。
- 形式として、CSV または SAS を選択します。これにより、臨床報告がエクスポートパッケージ用に生成するファイルのタイプが決定されます。
- 任意の作業: 配信チェックボックスを選択し、FTP 配信先を選択します。配信先の作成について詳しくは、FTP 配信先を参照してください。
- 保存をクリックします。
スケジュール済みエクスポートの編集方法
スケジュール済みエクスポートを編集するには:
- エクスポート > 定義に進みます。
- エクスポート定義をクリックして開きます。
- エクスポート 定義() メニューから、プロパティを選択します。
- 編集をクリックします。
- 必要に応じて、エクスポートスケジュールと配信に変更を加えます。
- 保存をクリックします。
スケジュール済みエクスポートの停止方法
スケジュール済みのエクスポートをいつでも停止させることができます。再開するまでエクスポートは行われなくなります。
スケジュール済みエクスポートを停止させるには:
- エクスポート > 定義に進みます。
- エクスポート定義をクリックして開きます。
- エクスポート 定義() メニューから、プロパティを選択します。
- 編集をクリックします。
- スケジュールチェックボックスをクリアします。
- 保存をクリックします。
FTP 接続の作成
臨床報告は、付属する Vault FTP サーバおよびサードパーティの FTP サーバの両方の使用をサポートしています。付属の Vault FTP サーバ以外の場所を使用する予定の場合、そのサーバを既に設定しておく必要があります。
Vault 所有者セキュリティプロファイルを有するユーザは、ツール > EDC ツール > FTP から、スケジュール済みエクスポートのデスティネーションを設定できます。
Vault がカスタムスタディロールを使用する場合、そのロールには以下の権限が必要です:
| タイプ | 権限ラベル | 権限 |
|---|---|---|
| 標準タブ | EDC ツールタブ | EDC ツールタブへにアクセスする権限. |
| 機能権限 | FTP の管理 | EDC ツールで FTP接続を作成および編集する権限. |
FTP 接続をセットアップするには:
- スタディでツール > EDC ツール > FTP に進みます。
- + New FTP をクリックします。
-
FTP 名を入力します。この名前は、EDC 臨床報告のエクスポートセクションのエクスポート定義の配信ドロップダウンメニューに表示されます。
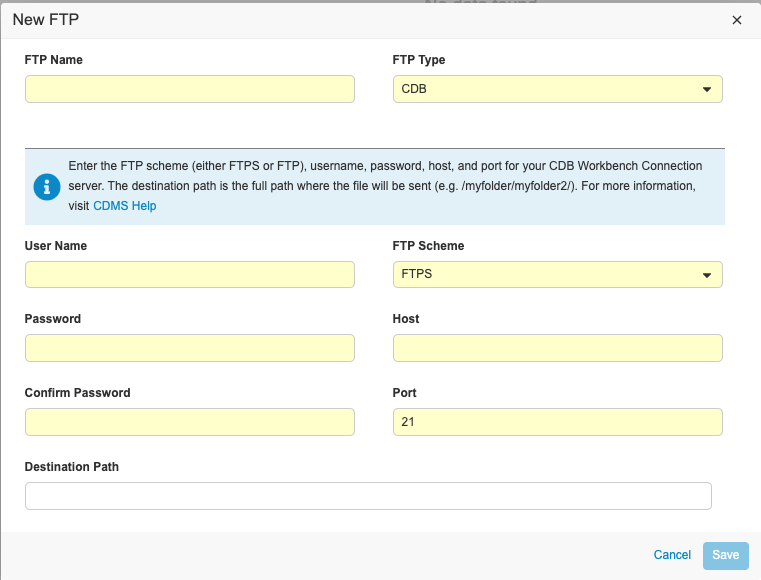
- 臨床報告から Vault FTP にエクスポートを送信するための接続を作成する場合でも、タイプに CDB を選択します。
- ユーザ名を入力します。これは、 Vault FTP サーバの場合、Vault にログインする際に使用するユーザ名で、ドメインも含め、その前にホスト名が付加されます。例: “verteopharma.veevavault.com+cordelia.hunter@verteopharma.com”
- パスワードを入力します。
- パスワードを確認します。
- FTP スキームを選択します。臨床報告から Vault の FTP サーバにエクスポートを送信する場合、FTPS を選択します。
- ホストを入力します。Vault FTPサーバーの場合、これが以下のような Vault の URL となります: {DNS}.veevavault.com例: “veepharm” は veepharm.veevavault.com の DNS です。
- ポートを入力します。
- パッケージを配信する場所の配信先パスを入力します。ここに入力する前に、必要に応じて FTP サーバで配信先パスを作成することができます。Vault の FTP サーバで配信先を作成するには、ユーザは API アクセス権限を持つ必要があります。
- 保存をクリックします。
接続フィールドの詳細および FTP レコードの編集方法について詳しくは、EDC ツールから FTP サーバへの接続を参照してください。
パッケージ通知の購読
臨床報告では、エクスポートパッケージが所定のステータスになったときに、メールによる通知を送信することができます。組織のユーザ管理者と連携して、購読を登録してください。
臨床報告- エクスポート
最終更新: 24R1
この動画では、EDC 臨床報告からレポートをエクスポートする方法について説明しています。


![[名前を付けて保存] アクション](/ja/gr/img/workbench/export/save-as-action.png)