25R3 新增功能
预发布日期:2025 年 11 月 10 日 | 发布日期:2025 年 11 月 21 日 和 2025 年 12 月 5 日我们很高兴为您带来 Veeva Clinical Data 的 25R3 版本。请阅读下文了解新功能。有关新功能启用的信息,请参阅 25R3 功能启用详细信息。有关开发人员功能(REST API)的信息,请参阅开发者门户。
临床数据
本部分中的功能是对 Veeva EDC 和 CDB 所有应用领域都适用的更改。
提升了多 Vault 用户体验
用例
当客户使用多个 Vault 时,用户经常需要在不同 Vault 之间频繁切换。例如,CRA 通常需要在 Veeva EDC Vault 与 Veeva CTMS Vault 之间切换操作。
在 25R3 版本之前,如果用户已在浏览器的两个标签页或窗口中均登录 Vault A,随后通过 Vault 选择器切换至 Vault B,则另一标签页或窗口中的 Vault A 会话将自动登出。
现在,Vault 用户可以使用 Vault 选择器切换 Vault 应用,且不会导致其他浏览器标签页或窗口中已登录的 Veeva 应用会话被强制登出。
说明
当用户在不同浏览器标签页或窗口中操作多个 Vault 时,如果通过某一标签页或窗口内的 Vault 选择器切换 Vault,其他标签页或窗口中已登录的 Vault 会话将保持活动状态。
启用和配置
此功能已面向所有 Vault 自动启用。
权限与安全更新
用例
本次更新为 CDB 用户提供了更便捷的访问权限。
说明
此版本对以下标准角色进行了权限更新:
- 新增权限上传第三方数据包(Upload 3rd Party Data Packages)已添加到 CDMS 首席数据管理员、CDMS 数据管理员、CDB 数据提供者和 CDMS 超级用户角色。此权限需启用 API 访问权限。
- “查看试验方案偏离”权限已添加到 CDMS CDB 只读角色。
启用和配置
对于已启用 CDB 的客户,上述权限更新将自动生效。
了解详情
数据录入
本部分中的功能是对数据录入(Data Entry)选项卡的变更,该选项卡是研究者和临床研究协调员输入研究执行数据的工作区域。
未配置签名定义时禁用批量签名
用例
“批量签名病例簿(Bulk Sign Casebooks)”按钮和菜单项的行为已更新,以便为研究中心用户提供说明,减少混淆并避免批量签署病例簿时出现问题。
说明
在数据录入界面中,如果研究未配置“病例簿签名定义(Casebook Signature Definition)”,则受试者网格视图右上角的“批量签署病例簿”按钮将处于禁用状态。当研究中心用户将鼠标悬停在该禁用按钮上时,将显示提示信息:“由于研究未配置签名定义,此操作无法执行(This action cannot be performed because there is no signature definition for the study)”。同样,在研究中心网格中,该菜单选项将显示为灰色不可用状态,悬停时也会显示相同提示信息。
启用和配置
此功能自动可用。
改进了自动保存期间网格视图 UI
用例
针对设计有大量项及项组重复的网格视图研究,用户界面已优化以减少操作混淆,并更好地支持数据录入。此前,自动保存功能可能导致研究中心用户在快速切换至下一个项录入数据时,误以为已输入的值被清除。优化后的 UI 将更清晰地向研究中心用户展示网格视图中的数值正在自动保存。
说明
当研究中心用户在网格视图中快速录入数据并切换项时,能够更直观地看到输入值的自动保存过程。用户在网格视图中添加或修改项时,输入的值在自动保存时会显示为灰色(不可编辑)。
启用和配置
此功能自动可用。
与表单同时创建的项组和项
用例
此前,当将表单(Form)添加到计划中时,系统会在管理区域中生成表单的占位记录(虚拟记录)。而该表单上的项记录仅在首次触发自动保存时生成表单(例如,在项(Item)中录入数据、打开手动查询、记录试验方案偏离、冻结/锁定表单等)。通过本功能改进,系统将在创建表单时同步生成项和项组(Item Group)记录,从而更准确地反映表单、项和项组的创建时间与更改原因。
说明
创建表单时,管理区域中该表单所属的项组与项记录将与表单同步生成。在审计跟踪中,表单上项组与项记录的创建时间将与表单的创建时间基本一致。表单与项的创建更改将标注为“代表 {用户} 的系统”,对于包含默认数据的项,更改原因将记录为“提交前更改”。表单创建可能由以下操作触发,并反映执行该操作的用户:
- 输入事件日期(研究中心用户或 API)
- 添加非计划事件
- 动态规则
- 追溯性修订
- 配置了最小表单重复次数的重复表单
启用和配置
此功能适用于早期采用者。请联系 Veeva 服务以了解更多信息。
基于正常范围单位的预填充实验结果单位
用例
在此版本发布之前,当系统未找到实验室检查项的正常范围时,会默认使用实验室单位定义中的标准单位预填充分析物结果单位字段。此功能可降低研究中心用户输入错误单位的风险。
说明
对于单位数据类型的实验室分析物,系统将根据以下条件预设置实验结果和实验室正常覆盖(若已配置)的单位:
- 如果此分析物配置了正常范围值及单位,则实验结果单位和实验室正常覆盖单位将预填充为正常范围中的同一单位。
- 如果此单位定义下仅配置了一个单位项,则实验结果单位和实验室正常覆盖单位将预填充为此单位项。
- 如果此分析物未配置正常范围值及单位,则实验结果单位和实验室正常覆盖单位将留空,用户需从可用选项中手动选择单位。
启用和配置
自动启用。
防止在未启用录入时自动保存临床意义值
用例
此前,当实验室正常范围指标更新后,即使“临床意义(Clinical Significance)”字段已不再适用,研究中心用户仍可输入值。本功能改进后,系统将阻止此类无效行为。
说明
当实验室检查项的正常范围标记为空值(null)、不确定(Inconclusive)或不适用(Not Applicable)时,系统将禁止自动保存“临床意义”字段的输入。
启用和配置
此功能在已启用“实验室临床意义”字段的研究中立即生效。
在空白事件的确认值查询中显示“标记事件为‘未发生’(Mark Event as Did Not Occur)”选项
用例
此功能优化了带有快速查询的事件操作按钮。对于逾期或重置的特殊事件场景,用户将看到更直观的选项组合。例如,当某事件被重置后,其手动查询仍会保留在事件中。此时,向研究中心显示的选项包括输入事件详细信息、回复查询,或将事件标记为“没有发生(Did Not Occur)”,从而更轻松高效地管理和解决事件查询。
说明
在空白事件上显示的确认值快速查询(例如,在查询开启后事件被重置的情况下),现在会向研究中心显示将事件标记为“没有发生’”的选项,而非仅显示“确认值”。
启用和配置
版本发布时,此功能将自动可用。
数据审查
本部分中的功能包括对审查(Review)选项卡(临床研究监查员和数据管理员的工作区域)或数据录入选项卡中审查功能的更改。
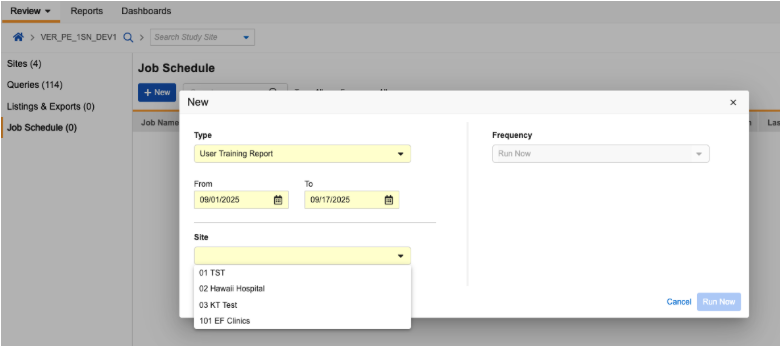
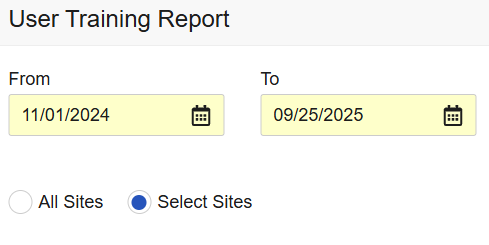
为审查用户提供研究中心用户培训报告
用例
本次更新将研究中心用户培训信息的访问权限扩展至 CRA 及其他数据审查用户。
说明
用户培训报告(User Training Report)现已在“审查”标签页的列表与导出(Listings and Exports)模块中提供。具有标准 CDMS 临床研究助理、CDMS 数据管理员角色,或具有“审查”标签页访问权限和“管理作业”权限的自定义角色用户现在可以运行报告。
报告每次仅针对单个研究中心生成,用户需从其权限范围内的研究中心中选择目标研究中心。报告内容显示所选研究中心的研究中心用户培训信息。
启用和配置
这些更新立即可用。
了解详情
临床编码
以下是 Veeva Coder 的新功能(Veeva Coder 的临床编码区域)。
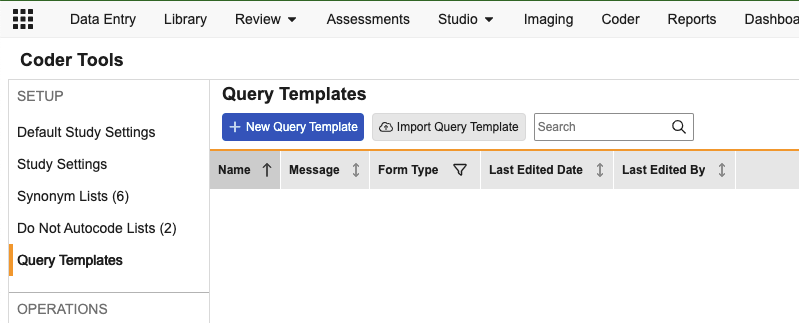
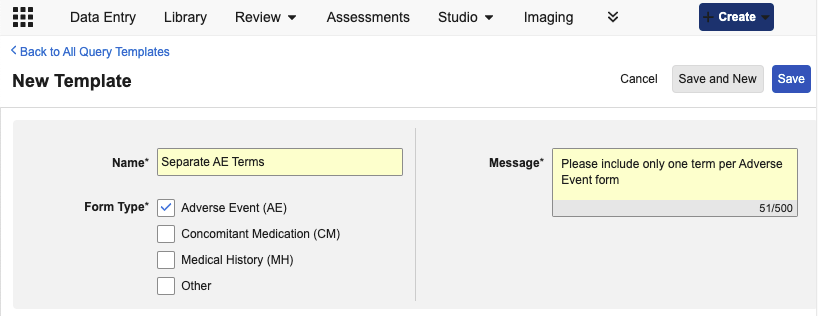
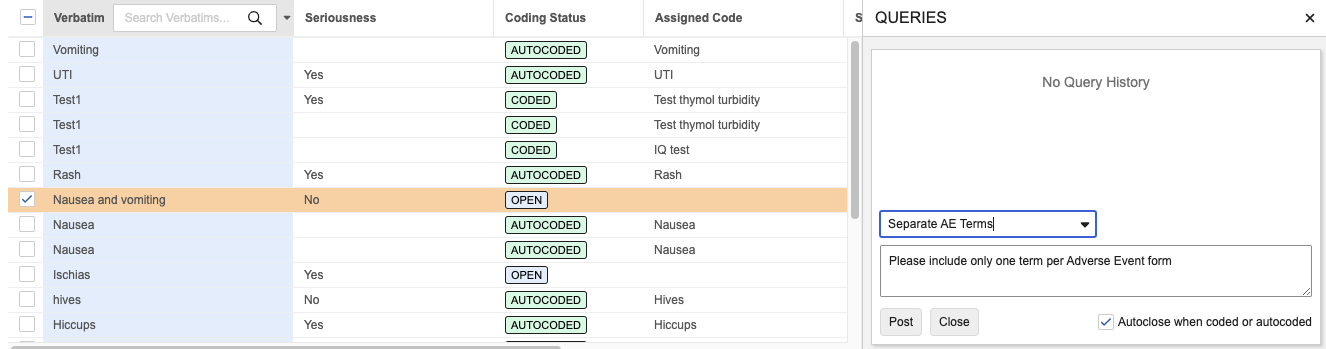
编码器:查询模板
用例
此功能为编码人员提供了一种更快、规范化的方式,用于针对常见问题创建查询。
说明
在新的编码器工具(Coder Tools) > 查询模板(Query Templates)子标签页中,编码器管理员可添加新的查询模板、指定模板名称、选择适用的编码表单类型以及标准查询文本。
在逐字记录发布查询时,编码员可以使用可搜索的下拉菜单从该表单类型的可用模板中选择适用模板。
模板的默认查询文本将自动填入,但编码员可以在发布查询之前根据需要进行自定义修改。查询模板可以从一个 Vault 导出,然后导入到另一个 Vault 中。每种编码表单类型最多允许设置 20 个模板。
启用和配置
常规版本发布后,此功能将自动可用。
编码管理
以下是编码器工具的新功能(Veeva Coder 的管理区域)。
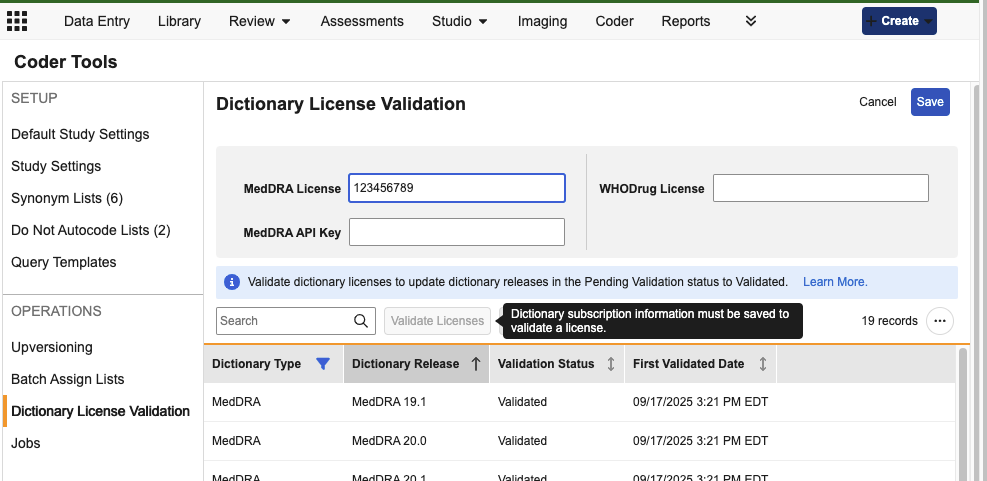
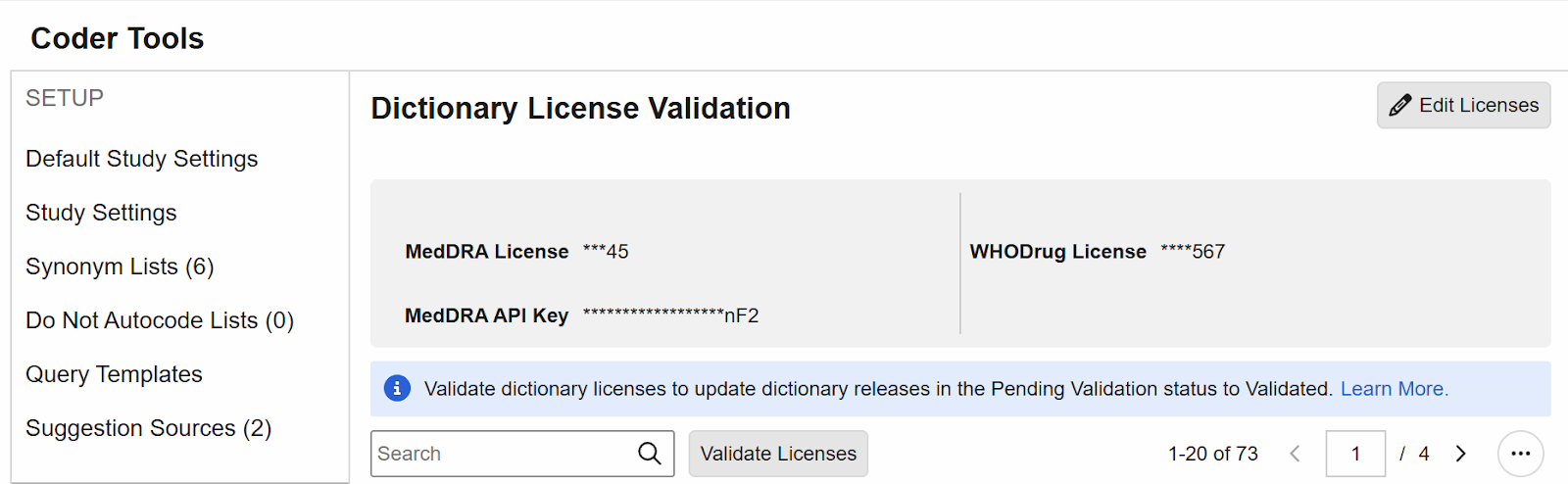
验证编码词典许可证
用例
此功能简化了确保客户针对其研究中使用的编码词典获得合法授权许可的流程。
说明
在编码器工具中新增了“词典许可证验证(Dictionary License Validation)”子标签页。编码管理员以及具备管理编码器研究设置(Manage Coder Study Settings)权限的自定义角色用户,有权编辑许可证和 API 密钥的值,并随后对输入的信息进行验证。
在 25R3 版本发布时,当前正在使用或以前使用过的 MedDRA 和 WHODrug 版本将自动标记为“已验证(Validated)”状态。从未使用过的版本以及未来新增的版本将显示为“待验证(Pending Validation)”状态,且在将这些版本分配至编码表单或同义词列表(Synonym List),或用于版本更改操作之前,必须完成许可证验证。
在输入适用的许可证信息并保存后,用户即可对许可证进行验证。对于后续发布的词典版本,用户需返回至编码器工具 > 词典许可证验证界面,重新输入或编辑许可证信息并完成验证,然后才能使用该新词典版本。
在非编辑模式下,所有已保存的许可证值将对所有用户显示为部分隐藏状态。
请注意,此许可证验证功能不适用于 JDrug 词典,这些字典不会显示在此网格中,且默认自动可用。
启用和配置
常规版本发布后,此功能将自动可用。
成像
以下是 Veeva EDC 的成像检查模块“Veeva EDC 成像”的新功能。
成像:Dicom 像素遮罩
说明
在上传图像之前,具备“上传检查(Upload Exam)”权限的研究中心用户可在图像审查和验证阶段,使用新增的影像工具选择和遮罩图像中包含受 PHI/PII 的像素区域。应用遮罩时,同一 DICOM 系列中尺寸和分辨率完全相同的图像,系统会自动将遮罩区域同步至相同位置。若同一系列中的图像分辨率尺寸存在差异,系统将要求用户对每张图像单独应用遮罩操作,除非用户删除这些分辨率不同的图像。这一自动化功能减轻研究中心用户的工作负担,因为只需标记一次遮罩区域即可,无需对同一系列中的每张图像单独进行遮罩操作。遮罩区域可根据实际需求调整大小和位置。在应用和调整像素遮罩的过程中,系统会通过提示信息和交互对话框引导用户完成操作。
检查图像上传后,遮罩区域会以纯黑色块显示,彻底覆盖底层像素数据。这些被遮罩的像素数据将从 EDC 系统的所有环节(包括数据录入、审查、评估、图像查看及 Vault 格式副本服务(VRS))中移除。此外,当用户使用平移或缩放功能查看图像时,遮罩效果仍会完整保留。
研究中心级图像修订设置
在 EDC 工具中,新建研究机构(New Study Site)和编辑研究机构(Edit Study Site)对话框现已新增禁用图像修订(Disable Image Redaction)设置项。该设置默认设置为否(No),并允许研究中心在将图像上传到“数据录入”模块之前,利用 DICOM 像素遮罩功能对图像中的个人数据(PHI/PII)进行修订处理。
该设置还支持通过“研究中心”网格视图批量应用到各研究中心。新增的“禁用图像修订”列将显示各研究中心的当前修订状态,同时新增筛选器禁用图像修订,可按“全部”、“已禁用”、“已启用”条件过滤网格记录。
如需批量禁用或启用图像修订功能,选中一个或多个研究中心后,系统将显示禁用图像修订按钮。点击按钮并在警告对话框中确认后,所有选中研究中心的图像修订功能将被禁用;选择启用影像修订(Enable Image Redaction)选项并确认警告对话框,则所有选中研究中心的图像修订功能将被启用。
已锁定研究中心无法被选中以启用或禁用图像修订功能。此外,禁用图像修订设置项支持通过研究中心导入文件配置,允许值为是(Yes)和否(No)。
启用和配置
此更新自动适用于使用 Veeva EDC 成像的早期采用者。
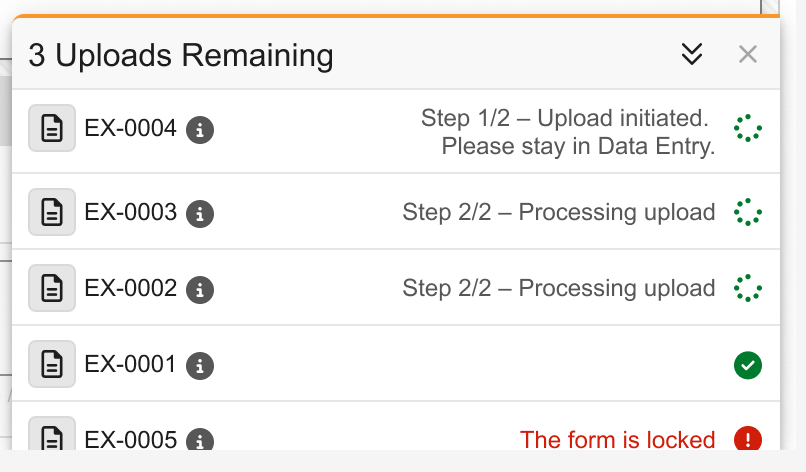
成像:异步检查上传工作流
用例
在检查上传过程中,用户可能需要执行其他任务或退出系统。通过异步处理检查上传,即使用户离开上传界面,上传仍可在后台继续完成。这提升了研究中心用户的操作体验,并支持数据录入与检查上传的并行处理,从而提高整体工作效率。
说明
在数据录入模块中,当用户在成像检查项组(Imaging Exam Item Group)中启动检查上传并点击验证和上传(Verify and Upload)后,系统将自动在后台异步处理该上传任务。此时,用户可自由切换至其他表单、刷新浏览器或退出 Veeva EDC 系统,而不会中断上传进程。
为进一步支持异步处理流程,当上传尚未启动或已开始向 Veeva EDC 系统传输时,上传面板将显示以下提示信息:
- 步骤 1/2 – 上传已启动。请停留在“数据录入”状态。
- 步骤 2/2 – 正在处理上传
如果用户在上传仍处于步骤 1(未开始处理)时尝试离开数据录入表单、刷新浏览器或退出系统,系统将弹出警告提示。此外,用户可在后台已有异步上传任务的情况下,同时启动新的检查上传。
重新登录系统时,上传面板会自动展开并显示所有未完成的上传任务。
系统还会通过邮件通知用户检查上传成功或失败的结果。
启用和配置
此更新自动适用于使用 Veeva EDC 成像的早期采用者。
评估
以下是 Veeva EDC 评估区域的新功能。
评估的存档选项
用例
此更新使工作室中配置评估(Assessments)时的选项管理功能与应用程序内其他功能保持一致,避免重复选项,并解决因 DEV 中删除配置导致跨环境部署的问题。
说明
在工作室中配置评估时,已保存的问题(Questions)选择项目定义(Choice Item Definitions)将无法直接删除。研究设计人员可将其归档以隐藏不再使用的选项。当单选按钮或选项列表选项未保存时,用户才会看到删除(Remove)按钮()。原非活动(Inactive)复选框现更名为归档(Archive)。并新增显示已归档选项(Show Archived Choices)筛选器,支持查看历史选项。选择项目定义名称在保存后将变为只读状态。
此外,研究设计规范(SDS)的评估标签页中,以下列标题已更新以匹配对应的评估配置区域:
- “选择项名称(Selection Name)”已更新为“选项名称(Choice Name)”
- “选择项标签(Selection Label)”已更新为“选项标签(Choice Label)”
- “选择项非活动(Selection Inactive)”已更新为“选项已归档(Choice Archived)”
启用和配置
版本发布时,此功能将在工作室中自动可用。
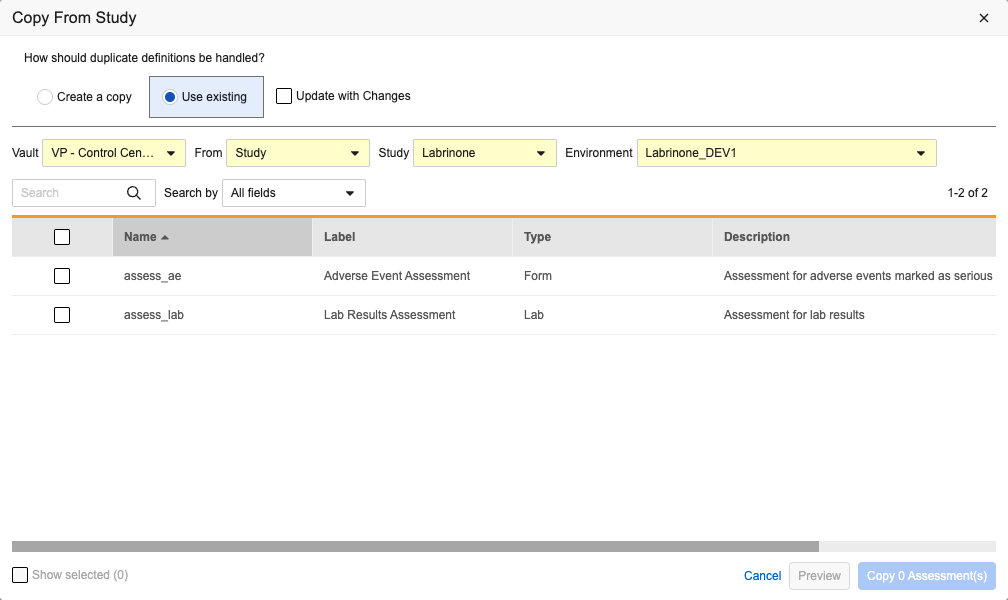
复制评估配置
用例
复制评估配置功能进一步扩展了工作室的复制能力,支持研究设计人员复用已有研究设计,减少创建相似评估时的工作量,提升跨研究配置效率。
说明
研究设计人员可通过从其他研究复制评估配置,更轻松地在工作室中完成评估设置。工作室的评估(Assessments)网格视图中已新增从研究复制(Copy From Study)按钮。点击该按钮将弹出从研究复制对话框,研究设计人员可在其中选择源数据所在的 Vault、研究或库及环境。设计人员既可从当前 Vault 内复制特定评估配置,也可从其有权限访问的其他 Vault 及领域中复制配置。
与其他设计复制功能类似,该对话框内置搜索栏,并提供以下重复项处理选项:
- 创建副本
- 使用现有项和更新更改复选框
研究设计人员可通过点击预览(Preview)按钮,在不实际导入配置的情况下查看选择结果。
点击预览和复制评估(Copy Assessments)按钮后,系统将执行后台任务,并在任务完成时通过邮件通知用户。邮件中会确认任务成功/失败状态,并提供可下载的 .xlsx 格式输出文件链接。
复制评估作业会处理源研究与目标研究评估间的补充数据不匹配问题(如字段是否存在、是否隐藏等),并在输出文件中提供警告及状态说明。
启用和配置
版本发布时,此功能将在工作室中自动可用。
研究设计和配置
此区域中的功能适用于工作室,即 Veeva EDC 的研究设计和配置区域。
重置包含外部数据和重复项组的表单
用例
重置表单时,重复项组中的外部数据将不再被删除。此功能使研究中心可在表单重置后修改可录入数据,减少数据核对工作量,并避免第三方供应商重新发送数据的需求。
说明
研究中心用户重置表单时,通过 API 加载至重复项组内的外部数据将保留在表单中。外部数据在对表单进行任何编辑之前以原始状态显示。
启用和配置
常规版本发布后,此功能将自动可用。
了解详情
跨表单派生更新编码请求
用例
此更新允许研究设计人员通过跨表单派生,为编码配置(Coding Configuration)生成所需值。例如,可将“适应症(Indication)”从关联的“不良事件(Adverse Event)”表单或“病史(Medical History)”表单派生至“合并用药(Concomitant Medication)”表单。
说明
在此版本中,如果跨表单派生规则更新了编码配置中包含的项值,系统将自动更新对应的编码请求(Code Request),无需重新提交表单。请注意,如果编码表单处于未提交状态时派生项值发生变化,编码请求将在表单提交后才会更新。
在此版本之前,编码表单中的跨表单派生项无法有效纳入编码配置,因为编码请求仅在表单提交时更新。因此,若跨表单派生项在编码表单未提交时被更新,更新后的信息不会反映在编码请求中。
启用和配置
此功能立即可用。
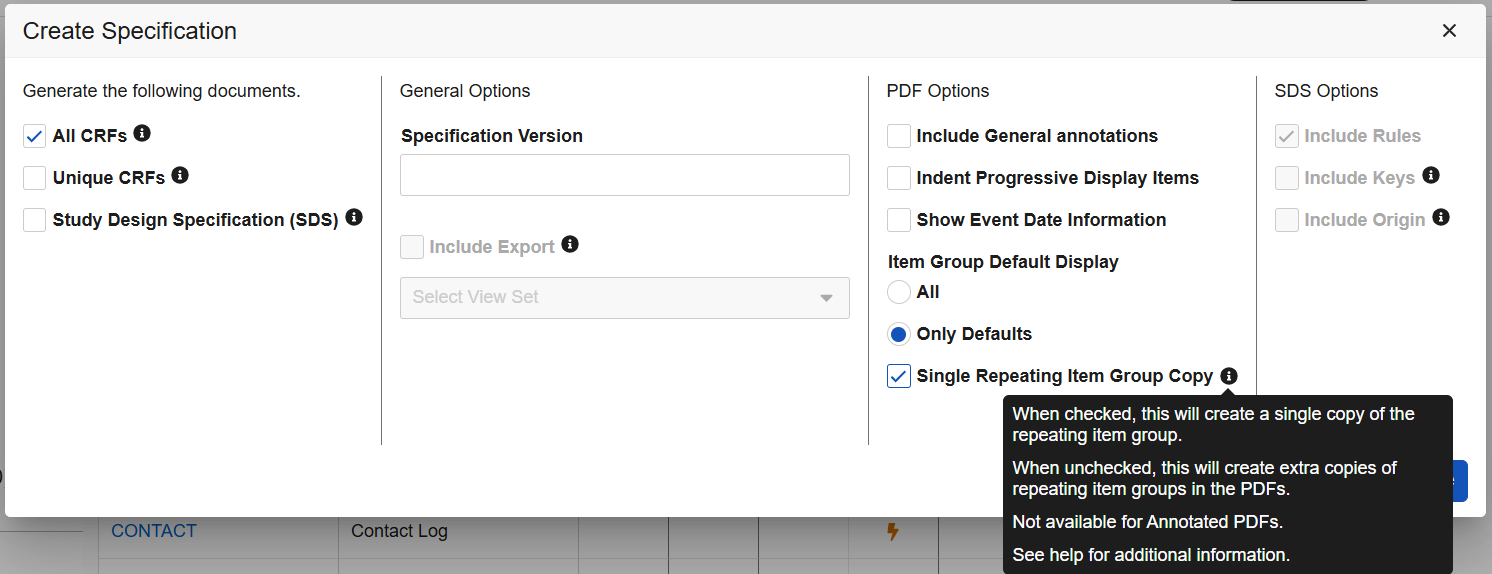
工作室:在空白 PDF 中显示默认数据的新选项
用例
工作室生成的“空白 PDF(Blank PDF)”新增选项,可优化 PDF 中含默认数据及可见性条件的表单指定方式。
说明
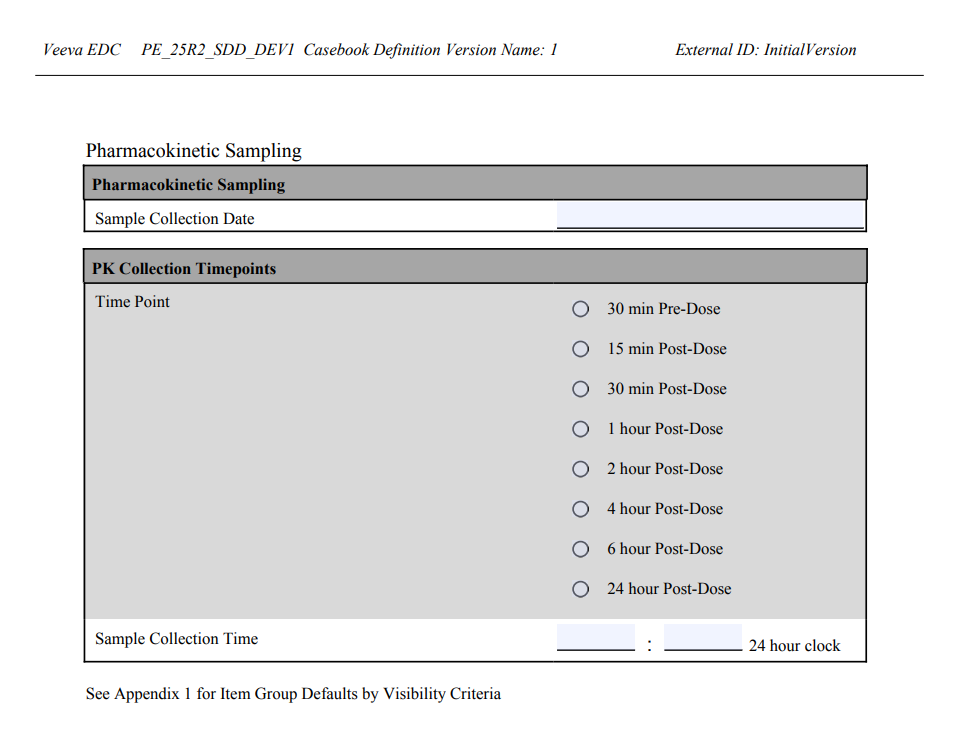
在工作室中创建规范并选择全部 CRF(All CRFs)或唯一 CRF(Unique CRFs)选项时,PDF 选项(PDF Options)区域内将显示新勾选框单个重复项组副本(Single Repeating Item Group Copy)。该新设置包含一个带悬停文本的信息图标。
当勾选单个重复项组副本时,输出空白 PDF 中将仅包含一个重复项组副本,并列出所有默认值集合。
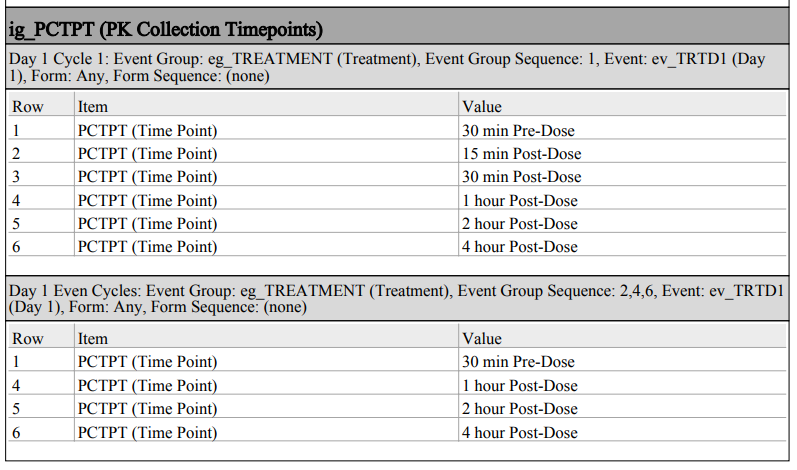
PDF 附录部分会进一步说明该项组的默认值及可见性条件规范。
未选中时,PDF 将按重复项组的独立实例分别显示配置的默认值及可见性条件。
启用和配置
这些更改在工作室中自动可用。
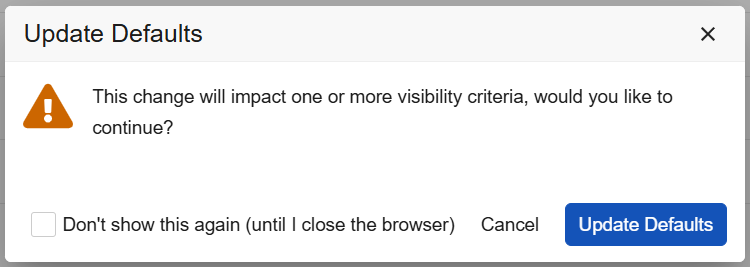
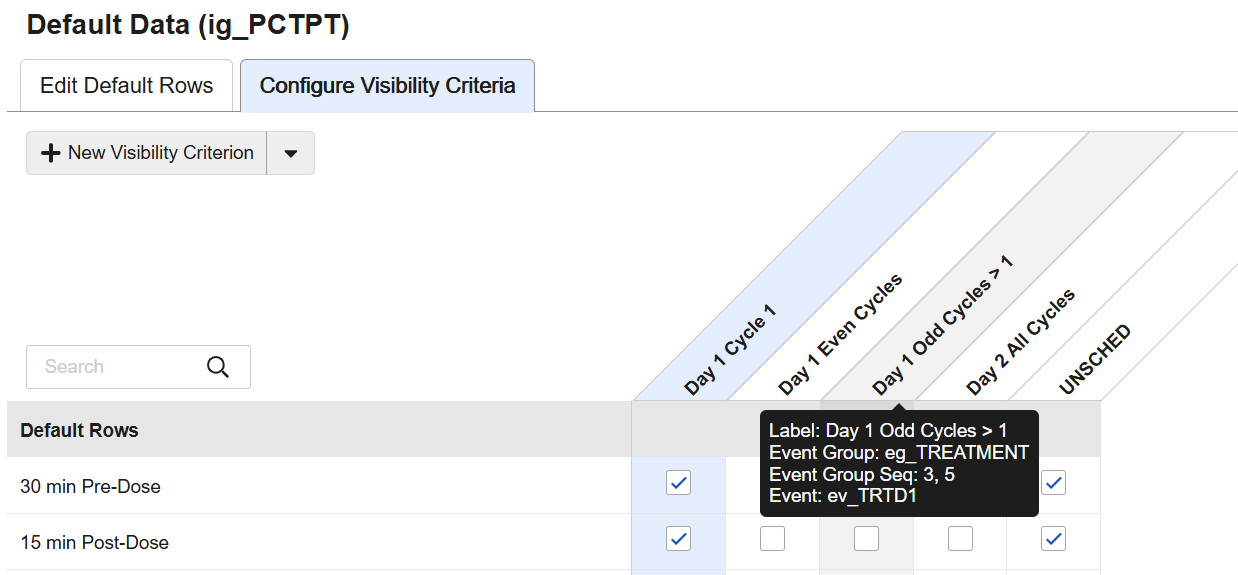
工作室:默认数据和可见性条件的配置改进
用例
在此版本中,工作室通过界面改进、新增警告提示及排序优化,显著提升了工作室中默认数据与可见性条件的操作便捷性。
说明
当研究设计人员修改项组的默认值且该更改影响现有可见性条件时,工作室将在以下情况下触发警告:
- 在已配置可见性条件记录的行前插入新行
- 在表单顶部或任意行前添加新行(包括:新增行、上方插入 1 行、下方插入 1 行)
- 将行拖拽至含可见性条件的行前
- 删除含可见性条件的行之前的行
- 更改行值
(注意:在表单末尾添加新行不受影响,将保留原有可见性选择。)
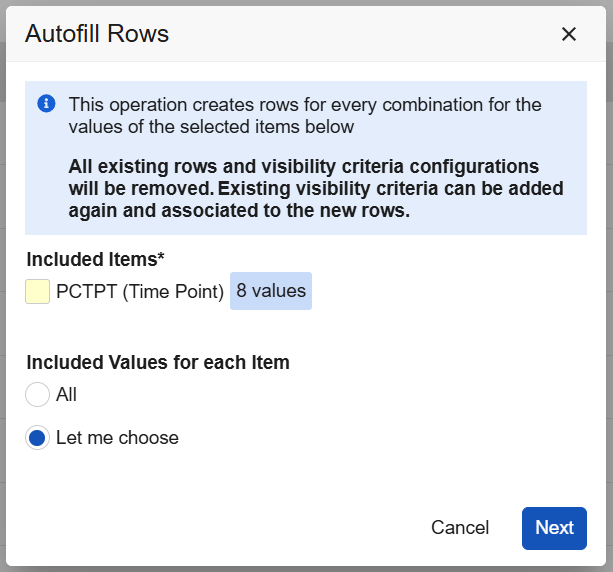
自动填充行(Autofill Rows)对话框内也将显示文本警告。
配置可见性条件时,重新加载页面后,条件将在网格中按字母顺序自动排序。鼠标悬停在可见性条件上时,网格内直接显示配置详情提示。
启用和配置
这些更改在工作室中自动可用。
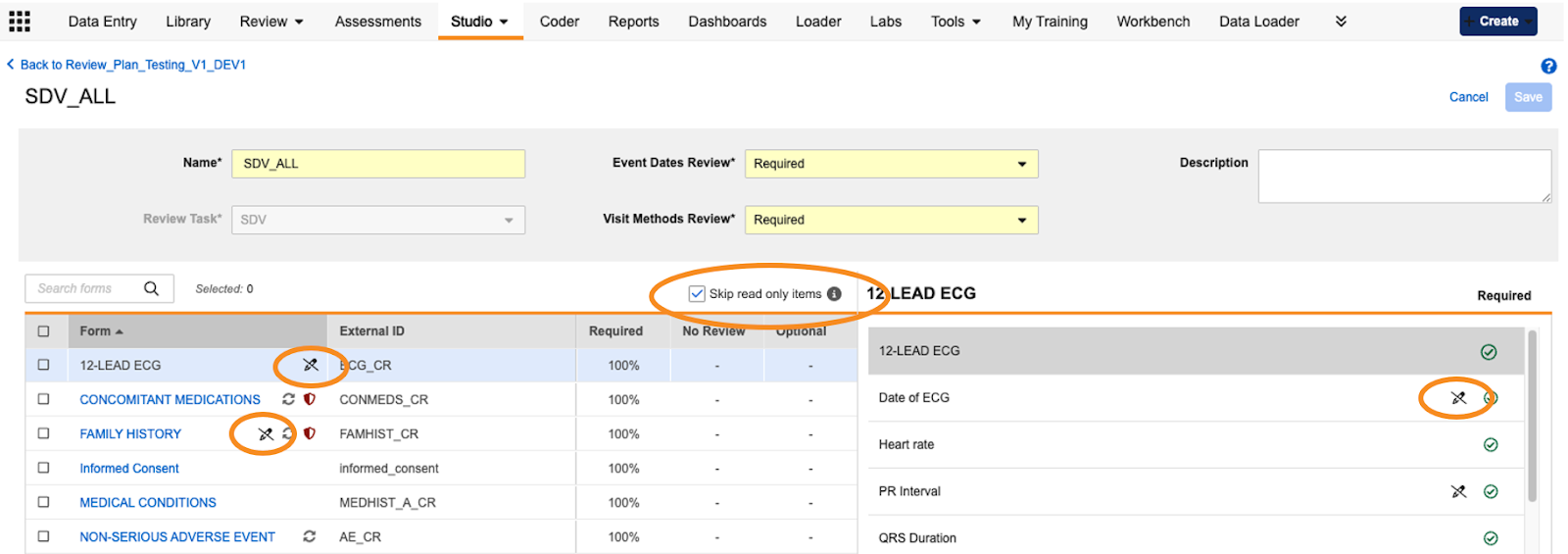
只读项默认为无审查
用例
通过提供选项并设置处理只读项的默认处理状态,研究团队可在工作室的审查计划配置中灵活选择是否将只读项计入 SDV 或 DMR 的百分比统计。
说明
在工作室中配置审查计划时,新计划默认将只读项设置为“无审查”状态。新增的“跳过只读项目”勾选框允许研究设计人员在使用批量操作修改审查计划时排除只读项的更新。系统默认选中了此复选框。表单与项旁将显示只读图标及悬停文本,直观标识只读项 及包含只读项的表单。
启用和配置
常规版本发布后,此功能在工作室中将自动可用。在 25R3 版本之后的配置中,只读项将设置为“无审查”状态。现有计划不受影响。对于在 25R3 版本之后配置的新计划以及现有计划,将显示该图标。修改现有研究的审查计划需通过无版本部署实现,或包含在新病例报告表版本中。
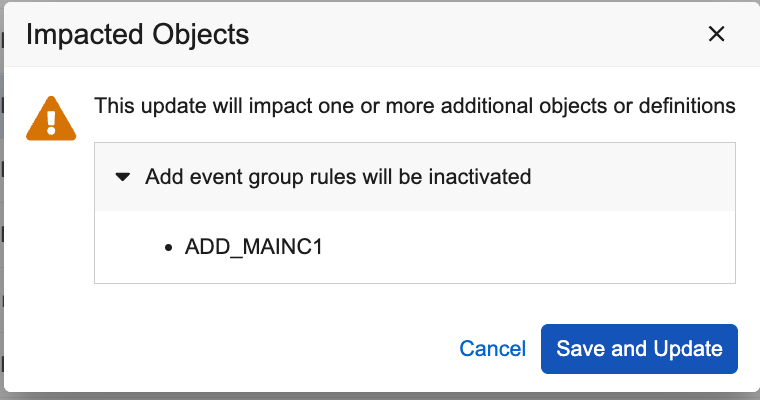
当事件组变更为非动态状态时,自动停用相关规则
用例
研究设计人员有时需要更改事件组的属性,将其从动态事件组切换到非计划事件组,或将事件组调整为日程中的首个事件。通过在修改事件组动态设置时自动停用关联规则并发出警告,此功能可确保研究设计的修改更加完整准确。
说明
当您将事件组属性从“动态”切换为“非动态”时,工作室将自动将所有关联的添加事件组(Add Event Group)规则设置为“停用”状态。系统将弹出警告提示,告知研究设计人员其拟执行的操作,并列出所有受影响的规则。
启用和配置
在工作室中将事件组属性从“动态”修改为“非动态”时,该功能将自动可用。
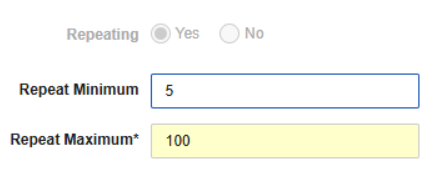
重复表单的最小数量
用例
设置重复表单的最小数量后,系统将自动在研究计划中添加相应次数的表单重复项,帮助研究中心用户按时填写表单。通过此功能,CRA 和数据管理员还可针对缺失表单发起查询。此增强功能还针对 AE 或 CM 等重复表单,在表单缺失或不完整时提供更清晰的可见性及更完善的报告指标。
说明
在重复表单的表单属性中,现已新增重复最小值(Repeat Minimum)字段。输入最小值(1-9999)后,系统将在数据录入界面的计划中自动创建指定数量的表单实例,用户无需手动点击添加表单(Add Form)按钮。如果位置需要单独设置不同的表单重复最小值时,可通过覆盖值进行配置。在工作室的表单界面中,新增的重复最小值列将显示所有表单的设计配置,方便用户快速查看列表中的表单设置。
研究中心用户
在数据录入界面中,如果重复表单包含重复表单项组,其顶部将显示展开重复项(Expand Repeating Items)切换开关。
研究设计者
在 SDS 的计划树(Schedule Tree)标签页中,已输入的最小重复数将显示于 Rmin 列,同时该数值也会呈现在通过工作室生成的带注释 PDF 文档中。运行工作室差异报告时,系统将对配置的最小重复数进行更改评估,并将更改结果记录在报告的计划(Schedule)和详细信息(Detail)标签页中。
从库或其他研究中复制设计时,重复最小值将随表单属性一起包含在内。
配置了最小重复数的动态表单仍会遵循动态规则,仅当规则逻辑判断为真时方可使用。
设计人员可修改适用于新受试者的最小重复数,且现有表单不会被标记删除。在追溯性修订中增加最小重复数时,系统将在计划中自动生成对应的新表单实例。
数据提取和报告
以下列已添加到 25R3 研究数据提取(SDE)版本中:
- 表单定义文件
- 重复最小值
- 病例簿时间表文件
- 事件组重复最大值
- 表单重复最小值
- 表单覆盖重复最小值
- 表单重复最大值
- 表单覆盖重复最大值
- 项组重复最大值
基于重复最小值判定的缺失及未完成表单,将纳入以下标准模板:详细缺失表单报告(V3)、表单进度列表和受试者进度列表。
启用和配置
可在工作室配置中立即启用。数据录入界面的展开重复项选项将自动显示,但现有研究的默认状态为关闭,新研究则默认开启。
将动态规则标记为废弃
用例
用户在修订动态规则的规则操作或操作范围后,如果未重新执行运行规则作业,可能导致病例簿中仍显示动态表单、事件或事件组,或根据之前的规则配置导致这些内容被删除或标记为删除。新增后端状态有助于确保在修订动态规则后获得预期结果。
说明
在管理区域中,规则结果现在将包含废弃状态,用于跟踪动态规则的历史执行记录,以及因规则配置修订导致的后续规则重新评估。该功能尤其适用于处理以下动态规则场景:当动态操作范围或规则操作(如添加表单、添加事件、添加事件组)发生更改时。在新增废弃状态下,EDC 系统将更准确地跟踪和清理规则结果记录,以确保动态表单、事件和事件组的处理符合预期。
在运行规则作业输出文件(含预览文件)中,如果某对象因对应规则结果被标记为“已废弃”而被移除或标记为待移除,则操作详情(Action Details)列将显示“已废弃规则结果处理”。在规则处理过程中,如果某生效规则的运算结果为真,则该结果将保持为真,因其被认定为有效且未被标记为“已废弃”。此功能可避免终端用户需重复执行运行规则作业。
启用和配置
使用运行规则作业时,此功能将在 EDC 工具中自动可用。
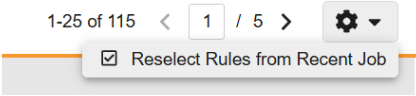
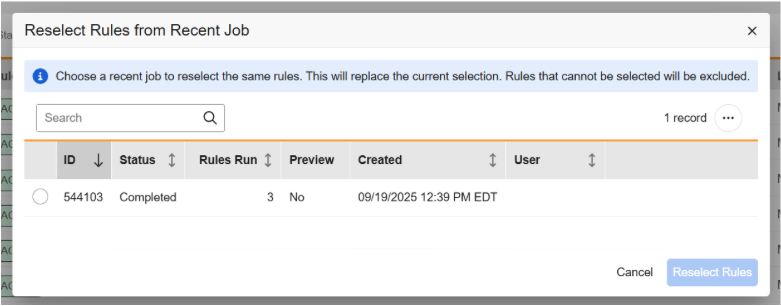
从近期规则作业中重新选择规则
用例
此功能新增菜单选项,支持用户选择历史规则作业以复用同一套规则配置,节省操作时间与精力。
说明
在规则网格视图中新增了操作菜单选项,用户可以从近期作业中重新选择规则。
选择此选项后,将弹出新对话框,用户可通过搜索功能选择目标作业,实现规则的自动化配置。最近作业中的规则将突出显示,用户可在运行新规则作业前取消选择已有规则或选择其他规则。已禁用的规则将不会包含在当前作业的选择范围内。
启用和配置
此功能自动启用。
了解详情
更新受试者状态规则的规则执行顺序
用例
在逻辑中包含引用 @Casebook.subject_status__v 的规则(例如“覆盖审查计划规则”)可能会在“受试者状态”规则之前执行,从而无法获取最新分配的受试者状态。该功能确保受试者状态规则优先于其他规则执行,以保障获取最新更新的受试者状态。
说明
基于表单提交或执行运行规则作业触发的规则,将按以下优先级执行:将设置受试者状态规则的优先级置于审查计划覆盖和查询规则等其他规则之前。
- 数据派生
- 添加事件组
- Add Event(添加事件)
- Add Form(添加表单)
- 设置受试者状态
- 其他规则类型
启用和配置
此功能在保存数据时或运行规则作业和规则进程时自动可用。
工作室复制改进
用例
工作室复制功能增强,支持跨研究和 Vault 的更高效复用,新增图像表单复制功能、研究设计人员预览功能(确保复制选择结果准确),以及复制日志的优化。
说明
复制预览
复制事件组、事件、表单、规则和代码列表/单位时,复制对话框中新增预览按钮。点击该按钮后,系统将启动预览作业,作业完成后用户会收到包含复制日志下载链接的邮件通知,日志文件名添加“_P”后缀以说明此为预览结果。
复制预览生成的日志与实际复制操作一致,但不会在目标环境中保存定义内容。此功能帮助用户确认最适合的复制选项,了解特定定义在目标环境中的处理方式。
选择复制预览后,复制窗口将保持打开状态,并保留用户选择,用户查看预览复制日志后无需重新选择。
复制成像表单
对于使用成像功能的 Vault 和研究,现在支持在同一 Vault 内跨研究复制这些表单。当源研究和目标研究均启用成像功能时,可通过表单选择字段复制成像表单。在复制过程中,系统提供的成像项组、项和预期模态不会重复生成。成像表单复制功能还会保留其他表单差异,并沿用”使用现有“或”创建副本“及”包括规则“选项的既有功能。跳过的成像检查项组和项以及差异说明将记录在复制日志中。
启用和配置
这些复制增强功能在工作室中自动可用。
工作室复制:规则标识符匹配
用例
复制用户定义的规则时,规则标识符会与工作室配置的对象名称匹配并更新,从而更高效地完成规则复制,减少研究设计人员的工作量。
说明
复制规则时,系统会使用一组系统密钥来唯一标识研究定义。这是因为定义名称可能与其首次出现的研究版本不同,导致在复制时无法明确判断某些定义或规则未被成功复制的原因。
复制规则时,系统会尝试通过目标研究/库中已存在的事件组、事件、表单及项的名称,修复此前显示为“空值”的规则标识符部分内容。当研究/库之间存在匹配名称时,系统将用定义对象的名称替换原“空值”。加载规则时,系统将首先尝试对标识符指向对象的系统密钥进行精确匹配。如果密钥不匹配,则系统将尝试通过对象的配置名称进行匹配。如果在研究或库之间未找到匹配项,则标识符的对应部分将显示为“空值”,且复制规则的状态将标记为无效。
在以下场景中复制规则时,如果系统密钥不匹配,将显示对象名称:
- 如果目标中存在与源研究定义同名但系统密钥不同的同类定义。
- 如果在复制到目标环境后(通过复制操作或手动添加)新增了定义,且该定义名称与规则表达式中的名称匹配。
在以下场景中复制规则时,如果系统密钥不匹配,将显示空值:
- 当名称和密钥均与目标中该类型的定义不匹配时。
此更改不适用于在“规则详细信息”面板中选择的表单或事件组,也不适用于规则操作标识符。如果这些对象的密钥不匹配,这些值仍将显示为“空值”。上述元素在复制操作中的名称匹配功能将作为后续优化项评估。
在生成的日志文件中,无法匹配名称的规则将在日志中被标记为“规则已复制但标记无效 - 缺少目标研究引用”。
名称匹配的规则不会在工作室比较报告(“差异”报告)中显示为已修改状态。
研究设计规范(SDS)也将与更新后的规则表达式保持一致,记录更新名称后的规则标识符。
启用和配置
此功能在工作室中自动可用。
工作室差异报告中新增“比较规则 V1”列
用例
工作室比较(差异)报告新增列有助于在更改或存档 V1 比较规则时澄清报告记录。当事件组、事件、表单、项组、项运算符及比较值字段为空时,“规则名称”列将标识被更新的规则。
说明
工作室比较(差异)报告的比较规则标签页新增“规则名称”列。新增列将显示存在研究环境差异的规则名称,并特别针对源研究标记为不存在而目标研究标记为存在的情况提供差异说明。规则名称可帮助明确以下场景中的修改位置:
- 源研究中已归档而目标研究中未归档的比较规则
- 仅存在于目标研究中而不存在于源研究中的比较规则
- 源研究和目标研究均存在但源研究已修改的比较规则(系统将分两行显示差异)
启用和配置
此功能在工作室中自动可用,适用于使用比较规则 V1 的研究。使用比较规则 V2 的研究项目不适用此更改。
工作室 - 为新研究启用配置设置
用例
现在,新建研究时将自动启用特定研究设置,减少研究设计人员的工作量。默认设置及功能应用可帮助研究中心和 CRA 提高管理查询的效率,并确保研究按指定语言运行。
说明
新建研究将默认启用强制实施研究语言(Enforce Study Language)、启用团队质疑限制(Enable Team Query Restrictions)和启用快速查询(Enable Quick Queries)设置。研究设计人员仍可根据需要取消选择这些设置。建议用户采用默认设置,以充分发挥快速查询和团队查询限制功能优势,并确保研究语言一致性。
系统查询的查询团队(Query Team for System Queries)、研究语言(Study Language)和研究区域设置(Study Locale)的设置将保持空白。用户需在研究设置中手动填写这些设置项。
启用和配置
常规版本发布后,此功能在所有新建研究中将自动可用。请注意,复制研究时将沿用源研究的设置。
研究等级更新
用例
此功能通过改进研究等级评估体系及在报告中新增辅助信息,帮助用户优化设计并加速审查流程,使设计人员能够在 TST 环境部署前预审报告结果。
说明
用户可通过工作室操作菜单中的创建研究等级报告(Create Study Grade Report)选项,在 DEV 环境中按需生成报告。报告完成后,系统将向用户发送含报告链接的邮件通知。
自动部署至 TST 环境的研究等级报告将包含系统数据标准(SDS)。
针对以下情况,已更新 codelist_display 检查:
- 阈值下限范围已更新为 4
- 重复项组与可编辑网格视图将纳入更优结果记录
- 只读项与派生项不再参与评估
对象名称列新增辅助信息,帮助用户定位并修正异常。
异常日志(Exception Log)标签页新增表单列,其中包括与以下检查相关的受影响表单的名称:
- form_unnecessary_copy
- codelist_consistency
- codelist_display
- rule_blank_checks
- rule_scope
- rule_dynamic_results
- rule_complexity
- rule_qualified_identifiers
- 表单顺序(新增)
启用和配置
拥有查看研究等级(View Study Grade)权限的用户可在工作室中自动使用本功能。
了解详情
研究语言功能优化 - 研究中心收尾详细信息和研究中心收尾活动详细信息
用例
为提升使用“研究语言”功能的研究项目的一致性,系统已对“收尾活动(Closeout Activity)”界面中的特定文本进行优化。
说明
当研究设置中的强制实施研究语言设置为“是”时,收尾活动(Closeout Activity)界面(位于 EDC 工具 > 研究中心“收尾状态(Closeout Status)”列信息图标内)将显示研究选定语言版本的事件信息。
启用和配置
新增的收尾活动事件将自动适配强制实施研究语言的研究项目。未启用该功能的研究项目将继续以用户语言显示收尾活动内容。
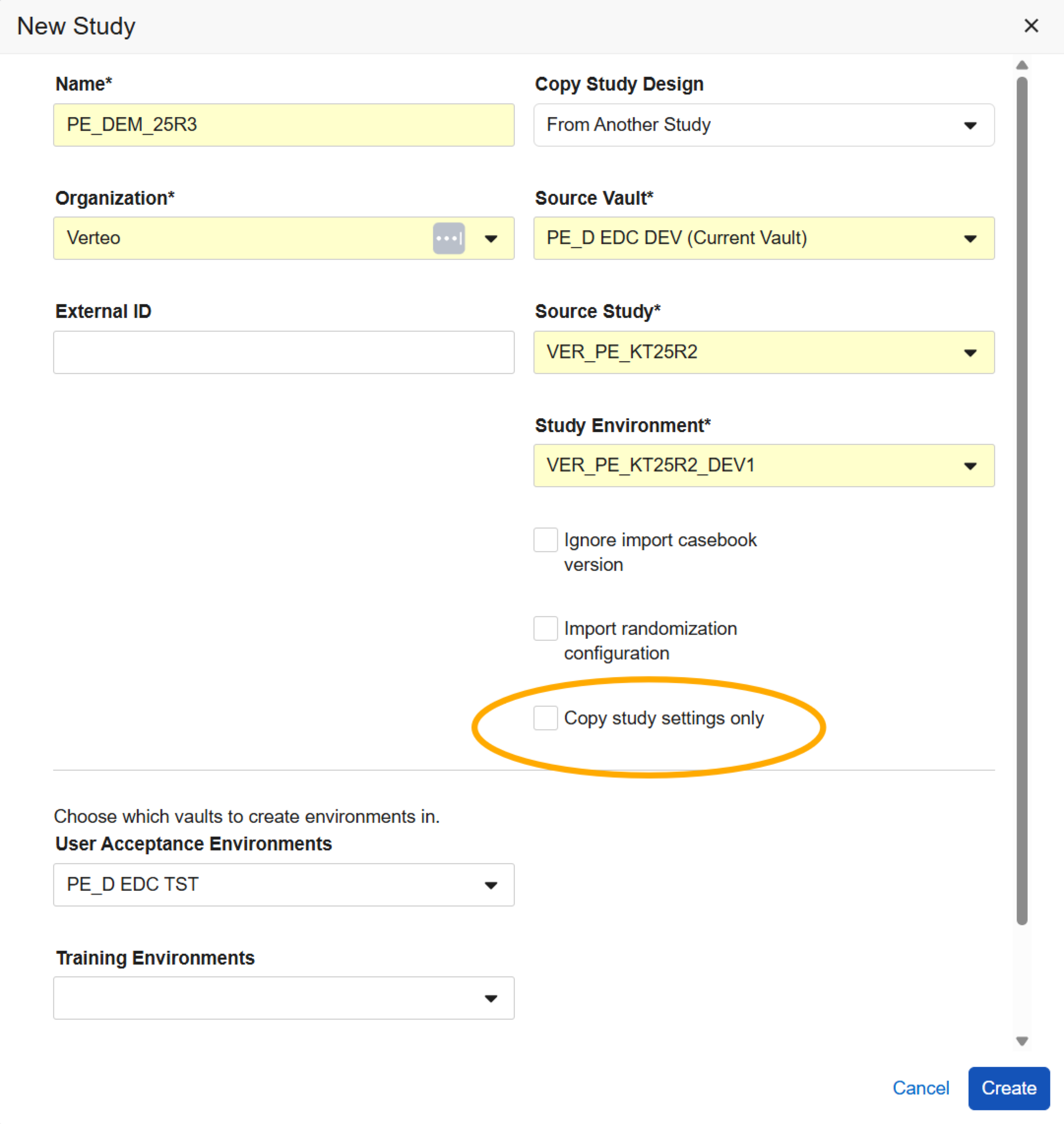
复制研究设置
用例
研究设计人员可通过复制其他研究或库中的研究设置,进一步提升研究配置的复用效率。
说明
创建研究时,新建研究(New Study)对话框新增“仅复制研究设置(Copy study settings only)”复选框。选中此复选框后,系统仅从选定的源 Vault、研究/库和环境中复制研究设置至新研究。取消选中此复选框后,系统将同步复制研究设置与研究设计配置(含事件组、事件、表单、项组、项、代码列表、规则等)。
复制的研究设置将包含以下配置项:
- 研究配置
- 定义默认值
- 研究
- 签名定义
- 实验室 > 研究常规设置
- 工具 > 编码器工具 > 研究设置(不包括表单配置)
选择“仅复制研究设置”时,“忽略导入病例簿版本(Ignore import casebook version)”和“导入随机化配置(Import randomization configuration)”复选框将保持灰色。
此选项仅在创建研究时可用。研究创建后需手动更新设置。
启用和配置
此功能在工作室中自动可用。
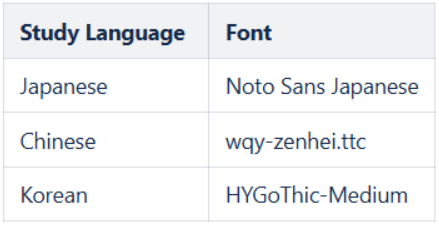
更新了 PDF 中的中文、日语和韩语字体
用例
此功能可修复研究项目中“详细 PDF”和“收尾 PDF”的中日韩字体显示问题,适用于已选择相关语言的研究或用户。
说明
在研究项目中,如果强制实施研究语言设置为“是”且所选研究语言为中文、日语或韩语,或在强制实施研究语言设置为“否”且用户语言为中文、日语或韩语的情况下,系统将确保“详细 PDF”和“收尾 PDF”使用以下字体:
在特定情况下,特定语言字符可能无法显示。在此类情况下,用户可预期以下显示规则:
- 如果研究语言为日语且该字符无日语版本,则显示中文版本。
- 如果研究语言为中文且该字符无中文版本,则显示日语版本。
- 如果研究语言为韩语且该字符无韩语版本,则显示中文版本。
启用和配置
此功能在生成上述语言的“详细 PDF”和“收尾 PDF”时自动可用。请注意,当强制实施研究语言启用时,将显示所选研究语言的对应字体。当强制实施研究语言未启用时,将显示用户语言的对应字体。
研究管理
本部分中的功能适用于系统工具(System Tools)或 EDC 工具(EDC Tools),即 Veeva EDC 的研究级管理区域。
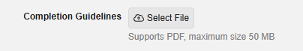
完成指南
用例
通过 EDC 直接访问完成指南,研究中心用户可以提高 EDC 中数据录入的质量和一致性,减少因查询产生的额外沟通成本。
说明
具有编辑研究设置(Edit Study Settings)权限的 DEV/TST 环境的研究设计人员和 PROD 环境的研究管理员可在“EDC 工具 > 研究设置”中上传、查看和删除完成指南。新增完成指南(Completion Guidelines)设置,内含选择文件(Select File)按钮,支持上传不超过 50MB 的 PDF 文件,文件名长度限制为 250 字符。
EDC 工具用户删除 PDF 文件后,该文件将从系统中彻底移除,且无法通过 EDC 恢复,用户需重新上传新的源文件。完成指南不会随研究部署,各环境需单独上传文件。
文件上传完成后,可在数据录入与审查界面右上角的新完成指南选项中访问。有受试者数据访问权限的用户将看到该链接并可点击,文件将在 PDF 阅读器中打开。
启用和配置
此功能在发布后自动可用于 EDC 工具中的配置。研究管理员需先在 EDC 工具中添加完成指南,最终用户方可查看。
Veeva Clinical Data 用户的新区域设置
用例
此功能实现平台级新增语言区域与用户设置的统一管理。
说明
平台级新增的语言区域现已对 Veeva Clinical Data 用户开放。用户管理员在用户记录的区域设置(Locale)下拉菜单中,将看到新增的 213 个选项。
在 25R3 正式发布后,将添加对 VeevaID 用户的功能支持。在此期间,当尝试在 EDC 中使用不受支持的语言环境设置任何 VeevaID 用户时,系统将显示错误提示。
启用和配置
此更新立即可用。
了解详情
培训和用户访问权限报告功能优化
用例
本次更新扩展了用户访问报告(User Access Report)和用户培训报告(User Training Report)的访问权限与功能范围。
说明
系统对以下报告功能进行了扩展:
用户培训报告:通过 EDC 工具访问的用户培训报告现支持按所有中心或选择的中心生成。此外,还新增了该报告的 API 端点。
用户访问报告:我们取消了从系统工具运行用户访问报告的六个月窗口限制。同时新增了该报告的 API 端点。通过 API 启动的作业设有报告生成时长限制,且支持设置具体日期时间。报告生成时长必须介于一小时至六个月之间。
有关 API 端点的更多信息,请阅读 EDC API 开发人员发行说明。
启用和配置
这些更新立即可用。
了解详情
作业研究中心选择功能优化
用例
作业对话框中的研究中心选择功能优化后,可提供一致的操作体验,并帮助数据管理员区分不同研究中心。当两个研究中心名称相同但编号不同时,此功能尤为实用。
说明
运行相关作业时,源研究中心与目标研究中心的选择界面已更新,现同时显示研究中心名称和研究中心编号。对话框中的搜索功能现已新增对研究中心编号的搜索支持。受此更新影响的作业包括:
- 详细 PDF
- 核心列表(EDC 工具和审查标签页)
- SDV 重新分配
- DMR 重新分配
- 重新计算归一化的日期时间值
悬停信息也已更新,纳入了研究中心名称和研究中心编号。
启用和配置
此功能自动可用。
部署前差异(Diff)比对报告
用例
如果研究设计人员在部署前忘记生成工作室比较报告,系统现在可以自动生成差异报告。
说明
部署研究设计更改时,将在部署导入过程之前自动生成“差异”报告(比较报告)。部署历史记录文件中的 Excel 格式文件将在日期时间戳后添加“_pre”后缀。例如:
Diff_StudyName_TST2_3_to_StudyName_DEV1_3_073120251245_pre.xlsx
无论部署成功还是失败,都会生成这些文件。
启用和配置
常规版本发布后,此功能将自动可用。
了解详情
SDE - 在系统文件中支持实验室本地化时区与禁食状态
用例
这些新增内容可在 SDE 导出数据中提供来自 EDC 系统的附加信息。
说明
SDE 的 25R3 版本对实验室系统文件作出了以下更新:
- 为支持先前版本新增的数据元素,我们正在 SYS_LABLOC 文件中添加实验室位置时区(Lab Location Time Zone)(字段名:LABTIMEZONE),并在 SYS_LABRANGES 文件中添加禁食状态(Fasting Status)(字段名:LABTIMEZONE)。
- 在新版 SDE 的 SYS_LABRANGES 文件中,我们已将“女性生理周期(Female Cycle)”列重命名为 LBFEMALECYCLE。
启用和配置
使用新版 SDE 时,这些新列可用。
了解详情
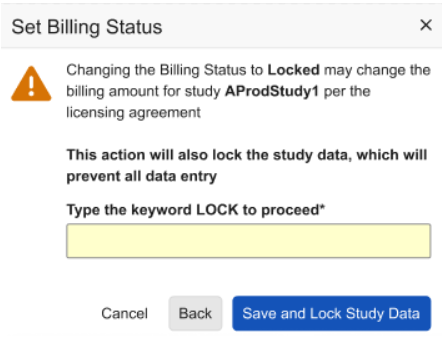
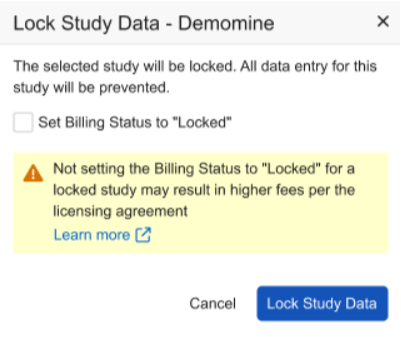
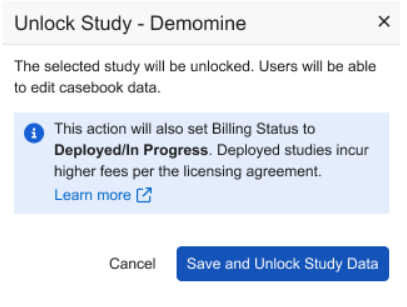
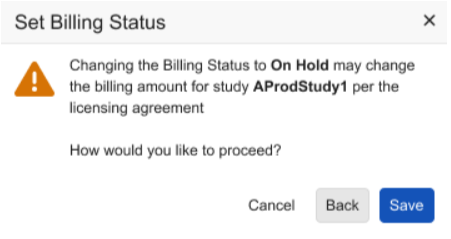
研究锁定和计费增强功能
用例
我们已更新在设置“计费状态(Billing Status)”和锁定研究数据时显示的对话框及确认提示,帮助研究管理员更有效地管控各研究中心的数据录入行为,避免产生额外费用。
说明
选择研究数据锁定(Study Data Lock)时,非 ELA 客户将看到更新后的对话框,其中包含以下自动勾选的复选框选项:将计费状态设为已锁定(Set Billing Status to Locked)。
通过“计费状态”操作锁定研究数据时,系统将提示研究管理员键入确认词 LOCK,以确保执行研究数据锁定操作。
取消选中该复选框时,将向用户显示附加信息和帮助页面链接。
选择研究数据解锁(Study Data Unlock)时,更新后的对话框将提示用户:计费状态将自动更新为已部署/进行中(Deployed/In Progress)。
当将计费状态设置为暂停(On Hold)、已部署/进行中或已停止使用(Decommissioned)时,对话框会显示提示文本,通知研究管理员所选状态可能引发的计费更改。
计费状态选项列表的标签已从数据锁定后(Post-data Lock)(此状态不锁定研究数据)更新为已锁定(Locked)。
启用和配置
常规版本发布后,此功能将自动可用。仅限非 ELA 客户。
了解详情
在“审查”标签页中为正常范围指示值添加了图标
用例
此更新实现了数据录入与审查界面中实验室正常范围指示值的显示一致性。
说明
实验室正常范围指示符图标现也将在数据审查界面的实验室表单中显示。
启用和配置
这些图标将立即在适用实验结果的“审查”标签页中显示。
了解详情
时区标签同步
用例
已更新特定时区标签,以确保与 Vault 平台保持一致,并避免在 ClinOps(CTMS)与 EDC 连接时出现时区不匹配问题。
说明
我们更新了用于研究中心和实验室位置的 timezone__v 的时区选项列表标签,使其与平台(及 CTMS)中 timezone__sys 字段的时区标签保持一致。更新后的时区标签可在这些屏幕和对话框选项列表中查看。
- 新建/编辑研究机构对话框
- 研究中心网格(EDC 工具)
- 研究中心导入文件
- 新建/编辑实验室位置 & 正常范围
- 实验室位置 & 正常范围网格
- 导入实验室位置
客户应更新用于导入 EDC 研究中心和实验室位置的 CSV 文件中的时区。在导入研究中心和实验室位置时,如果未使用更新的时区标签,用户可能会在导入预览中遇到错误提示。此版本发布后,可以导出 CSV 文件并用于后续导入,以确保导入文件将包含更新的标签。
启用和配置
此功能自动可用。
了解详情
在 PPT 研究删除期间禁用审计
用例
此更新优化了删除记录的处理流程,可防止在 TEST 或 PPT Vault(含 PPT 环境所在 Vault)中,以及在删除 PPT 环境后可能出现的性能问题。
说明
删除 PPT 环境后,系统不需要保留 Vault 所有者在“管理-对象审计历史”中看到的特定删除记录。这些记录包括:因先前 PPT 环境删除产生的记录,或因数据复制到已删除 PPT 环境时产生的记录。
原作为 PPT 环境删除操作一部分而保留在“对象审计历史”中的删除记录,现已被清理并从审计记录中移除。请注意,对活动 PPT 环境中的数据的操作和修订始终会被记录在审计跟踪中。
- item2__v
- item_group2__v
- item_history2__v
- item__v
- item_group__v
- item_history__v
- query_message__v
- review_state__v
- execution_data_state__v
- coding_request__v
- rule_result__v
- signature_binding__v
- signature_readiness__v
启用和配置
常规版本发布后,此功能将自动可用。研究最终用户无法测试此功能,并且仅对 Vault 所有者在管理界面中可访问的“对象审计历史”进行了调整。
部署 UI 和处理流程优化
用例
我们对研究部署流程进行了优化,其中包括 UI 改进,以帮助澄清和减少部署失败,并减少联系 Veeva 支持以帮助成功重新部署设计更改的需要。
说明
在研究部署期间,部署包将按病例簿版本及无版本部分的研究设计分组,以一系列较小事务的形式进行处理。部署流程将在后台跟踪成功与失败的设计部分。如果部署时选择了删除研究数据(Delete Study Data)或生成详细 PDF(Generate the Detailed PDF)选项,系统将优先处理这些文件,再导入设计,以减少部署失败。
当部署失败时,日志中将记录导致失败的具体事务。
在工作室的研究环境页面中,UI 更新可通知设计人员和测试人员环境暂时不可用,并提示需重新部署。新的悬停消息将显示红色错误图标以及部署帮助链接。
在工作室中,如果某个环境暂时不可用,则用户无法将病例簿定义复制到其他研究或从其他研究复制。当环境不可用时,用户运行差异报告时将无法选择该环境。
在 EDC 工具中,当尝试对不可用环境执行部署操作时,系统将显示以下错误消息:“此研究的病例本病例簿定义部署失败,并已标记为不可用。”尝试将另一个研究设计恢复到不可用的环境时,下拉菜单将不包含该环境选项列表。在“研究中心”页面中,用户无法通过 UI 或导入界面设置活动版本。如果用户尝试为不可用的环境运行追溯性修订,则将显示一个新对话框。
此外,作为此功能的一部分,如果用户尝试更改 URL 以导航到研究环境,系统将自动重定向至该研究的“研究主页面”。
请注意,此功能不会影响生产环境,因为在将版本部署到 PROD 之前,首先需要成功部署到 TEST。如要重新启用 TEST 环境,用户可以在尝试重新部署新版本之前删除受设计更改影响的数据。
启用和配置
常规版本发布后,此功能将自动可用。
实验室
本部分中的功能是适用于 Veeva EDC 的实验室模块的新功能。
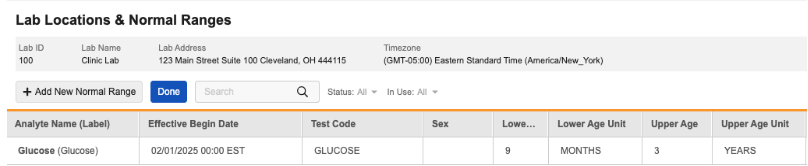
优化正常范围功能中的年龄范围
用例
此功能支持儿科研究的本地实验室正常范围设置,其中年龄下限和上限可能基于不同的单位(例如 9 个月至 3 岁)。同时支持单一年龄正常范围,例如,仅适用于 18 岁受试者的正常范围。
说明
正常范围的年龄单位(Age Unit)字段已拆分为两个独立字段,分别为年龄下限单位(Lower Age Unit)和年龄上限单位(Upper Age Unit)。
版本发布时,只要现有正常范围存在对应的年龄下限/上限值,其“年龄下限单位”和“年龄上限单位”两个字段将自动填充为当前“年龄单位”字段所记录的值。
实验室范围导入
实验室正常范围导入模板现已新增年龄下限单位和年龄上限单位。
研究数据提取
为了适应此更改,SDE 25R3 版本中的 SYS_LABRANGES 数据集将采用新的列结构,如下方截图所示。
旧版 SDE 将继续仅保留已弃用的单一年龄单位字段。添加或编辑实验室正常范围时,此数据将过期。因此,我们建议始终使用 25R3 版本的 SDE 以获取更新后的 SYS_LABRANGES 数据。
实验室参考范围标准报告
标准报告“实验室参考范围标准模板”现已新增“年龄下限单位”和“年龄上限单位”字段。所有已共享该标准报告的用户均可看到此更改。
启用和配置
此功能自动启用。
了解详情
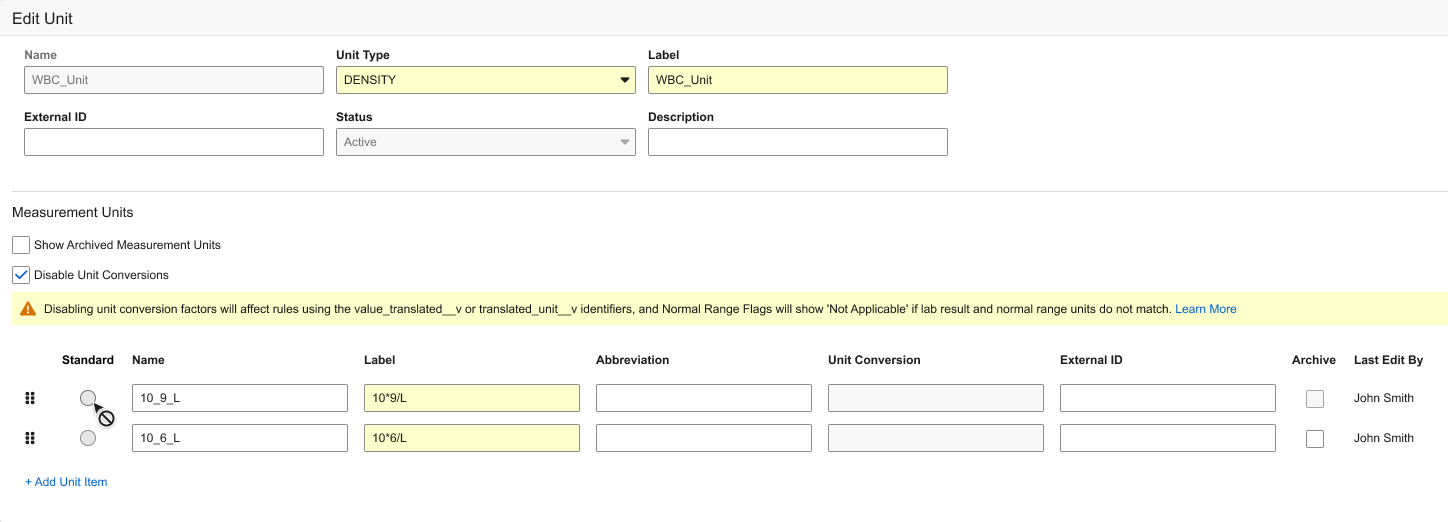
允许禁用实验室单位项定义转换系数
用例
此功能适用于将所有实验室单位转换管理放在 Veeva EDC 系统外进行的申办方,此类操作通常涉及本地实验室数据及非 EDC 系统数据。在 Veeva EDC 中禁用本地实验室单位转换,无需对这些转换进行对账和其他管理。
说明
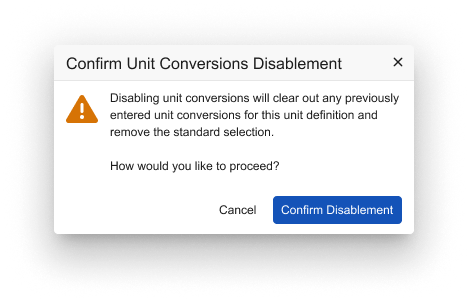
在 Vault 中启用该功能后,创建或编辑实验室单位定义的用户可以选择禁用单位转换(Disable Unit Conversions),此操作这将禁用“标准单位”和“单位转换”字段的输入。
系统将显示提示横幅:“禁用单位转换系数会影响使用 value_translated__v 或 translated_unit__v 标识符的规则,且当实验结果单位与正常范围单位不匹配时,正常范围标志将显示‘不适用’。”
如果之前录入了转换系数,系统将显示确认提示:“禁用单位转换将清除此单位定义下所有已录入的单位转换并移除标准单位选项。是否继续操作?”
确认后,先前录入的转换系数及标准单位选项将被清空。
如果用户稍后取消选择禁用单位转换选项,则列表中首个单位项定义将被标记为标准单位(可以编辑,但用户需要输入新的转换系数)。
导入实验室单位
启用此功能的 Vault 可通过包含禁用单位转换选项列的导入文件版本导入实验室单位。用户可从系统常规设置(System General Settings)中的单位(Units)表下载模板文件。请注意,用户只能在最初创建实验室单位定义记录时设置此值。用户无法通过导入更新现有记录的禁用单位转换字段,并且必须在 UI 中进行更新。
未启用此功能的 Vault 应继续使用不包含此列的模板文件。
工作室
如果研究构建者为未启用单位转换的分析物项目编写规则,且规则中使用了 value_translated__v 或 translated_unit__v 标识符,系统将显示以下警告:“规则表达式包含的分析物使用了已禁用单位转换的单位定义,这些标识符将解析为空值,并导致规则无法按预期求值。考虑从规则中删除这些标识符。”
正常范围评估
如果禁用了分析物的转换系数,并且研究中心录入的单位值与正常范围单位不匹配,将鼠标悬停在上方时将显示新的不适用图标,并显示以下提示框:“当申办方未配置转换系数时,如果实验结果和正常范围单位不同,系统将无法计算标志状态。”
启用和配置
用例获得批准后,必须先由支持人员启用此功能,然后才能将此功能配置到任一实验室单位。要启用此功能,Vault 中使用本地实验室的所有研究都必须使用全局版本。
了解详情
分析物库权威数据源:分析物标签
用例
此更新有助于确保分析物库成为 Clinical Data 所有领域的权威数据来源,尤其是分析物标签。
说明
此功能更新了工作室中的“项属性”面板,以删除为所有实验室面板项配置标签和显示覆盖标签的功能,以确保分析物库是 Clinical Data 所有领域的权威数据来源。
工作室、EDC、CDB 和 Clinical Data 中的所有其他区域,以及 SDS、CDE 和 SDE 文件将使用分析物库中参考分析物指定的标签。
对于分析物库标签与工作室分析物标签项值之间没有任何不匹配的客户,将自动启用此功能。如果客户存在一处或多处分不匹配的情况,该功能将保持关闭状态,Veeva 会在启用功能前与客户联系,共同商讨解决方案。
自定义报告影响
包含项标签的项定义报告将受到此更新的影响。启用此功能后,LBTEST_ 项的项标签将不再在项定义上做标记,且这些报告中的标签信息也将停止更新。因此,我们建议使用“分析物定义”对象而不是“项定义”来获取报告中的这些值。
启用和配置
对于 Vault 中分析物库标签与工作室项属性之间没有不匹配的客户,将自动启用此功能。
了解详情
分析物库权威数据源:分析物精确性与数据长度
用例
此更新可确保本地实验室检查项目的精度和长度值与分析物库中的配置保持一致且清晰明确。
说明
对于使用本地实验室全局版本的研究,工作室项属性面板中不再包含精度和长度字段,因为这些值均由分析物库统一管理。
病例簿设计导出(CDE)也已更新,现可直接引用分析物库中定义的精度和长度值。
默认长度 我们在创建时更新了以下实验室相关项目的默认长度,以尽量减少研究设计人员逐个调整的需要。如果需要,用户仍然可以在工作室中修改这些长度值。
- LBFAST 默认长度:100
- LBFEMALECYCLE 默认长度:100
- LBSEX 默认长度:100
对于数据类型为代码列表或文本的分析物,其默认长度值已从 1500 调整为 100。
自定义报告影响
此版本发布后,实验结果(Lab Result)、正常范围(Normal Range)及正常覆盖(Normal Override)项的精度和长度值将不再存储于项定义中。因此,我们建议使用“分析物定义”对象而不是“项定义”来获取报告中的这些值。
启用和配置
对于所有使用本地实验室全局版本的研究,这些更新将自动启用。
了解详情
本地实验室项属性面板更新
用例
这一功能进一步支持分析物库作为实验室面板项的权威数据来源。
说明
我们添加了为 LBTEST_ 实验室面板项(分析物标签)配置帮助内容(Help Content)和提示标签(Hint Label)的功能。这些信息将在数据录入和审查环节同步显示,帮助研究构建者为用户提供关于分析物的补充说明或指导信息。
我们删除了非 LBTEST 实验室面板项配置帮助内容和提示标签的功能,因为数据录入网格 UI 不支持此类项目的显示。
对于实验室代码列表项(实验结果、正常值和正常值覆盖),控制类型选项已禁用,并将使用选项列表选项。
启用和配置
这些更新立即可用。
角色管理与安全
本节中的功能是对系统工具 > 角色管理(Role Management)和系统工具 > 用户(Users)区域的增强,以及对 Veeva Clinical Data 中的标准研究角色(Study Roles)、安全性和访问控制的更改。
用户定义的权限集行为与管理员 UI 一致
用例
此更改使用户更容易理解 UI 中的权限。
说明
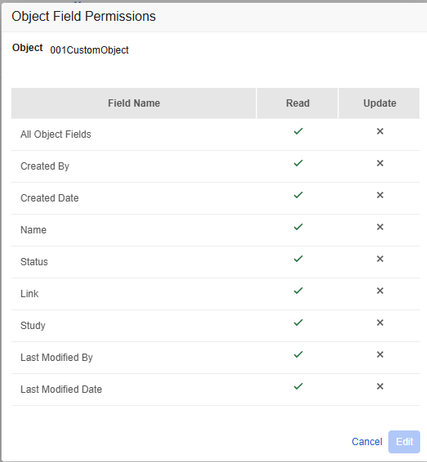
本次发布后,系统工具中针对用户自定义权限集的对象字段权限对话框(Object Field Permissions Dialog)的交互行为已更新,以与管理端(Admin)中的 UI 体验保持一致。其中,“所有对象字段(All Object Fields)”复选框将动态反映其下方所有单个权限的总状态值。
启用和配置
此更新立即可用。
连接与集成
本节中的功能是与 Veeva Clinical Data 的新连接或集成,或对现有连接或集成的增强。
Clinical Operations - EDC 连接:强制要求研究名称唯一
用例
Clinical Operations - EDC 连接将研究名称从 Veeva CTMS 传输到 EDC。在 CTMS 中,研究是一个单一概念;但在 EDC 中,它可能以不同实例形式出现,且带有不同标签(例如“MyStudy_DEV”和“MyStudy_TST”)。在 CTMS 沙盒环境(CTMS Sandbox)与 EDC TST 实例相连的场景下,EDC 生产环境中的研究名称可能通过“Clinical Operations - EDC 连接”功能传输至 EDC TST 实例中。如果之前未在 CTMS 沙盒环境中调整,此操作可能会覆盖正确的 EDC TST 研究名称。这种不正确的命名可能会导致与 EDC 中的进一步研究部署发生冲突。此版本发布后,如果 CTMS 研究名称与任何其他 EDC 环境中的研究名称相同,您将无法在 EDC 中重命名该研究。这将特别防止在 TST 环境中完成“Clinical Operations - EDC 连接”测试后,向 EDC 生产环境部署研究时出现问题。
说明
如果研究名称通过“Clinical Operations - EDC 连接”传输,且 CTMS 中的研究名称与任一其他 EDC 实例中的研究名称相同时,重命名操作将失败,并生成用户异常提示信息。例如,如果 CTMS 沙盒环境连接至 EDC TST 环境,则需将 CTMS 中的研究名称从生产环境研究名称(如“MyStudy”)调整为适用于 EDC 测试实例的独立名称(如“MyStudy_TST”),以确保集成成功。
启用和配置
对于使用 Clinical Operations – EDC 连接的研究,此功能会自动启用。此功能无法仅在 EDC 中单独测试,需要与 Veeva CTMS 进行集成测试。
了解详情
Clinical Operations - EDC 连接:在 EDC 中显示 CTMS 链接
用例
CRA 现在可以使用单独的浏览器标签页在 EDC 和 CTMS 系统之间无缝切换,在保持登录状态的同时,同步检查两个应用程序中的记录。此功能可减少多系统登录操作,帮助 CRA 更有效地管理 EDC 和 CTMS 中的数据。
说明
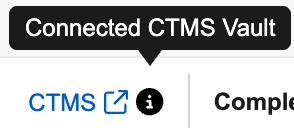
使用“Clinical Operations - EDC 连接”功能的研究,其“审查”标签页下的“研究中心”与“受试者”视图界面右上角均会显示连接入口。
当用户将鼠标悬停在链接上时,链接旁边的信息图标将显示 CTMS Vault 的名称。将鼠标悬停在链接上将显示 CTMS Vault 的 URL。
有权访问这两个系统的用户现在可以使用这个新链接直接在 CTMS 和 EDC 之间切换。此链接可帮助 CRA 从 EDC 中当前查看的研究中心页面,直接跳转至 CTMS 中对应的研究中心页面。
点击 EDC to CTMS 链接后,系统响应如下:
- 如果用户之前有活动的 CTMS 会话,进入新标签页后,则无需再次登录。
- 如果用户最近没有登录 CTMS,则系统会在其点击单击链接后将提示登录。
- 如果用户无权访问 CTMS,则会返回至 CDMS Vault。
- 如果用户无权访问 CTMS 中的研究中心,系统会弹出错误提示“找不到页面”。
启用和配置
对于已启用“Clinical Operations - EDC 连接”功能的新建及现有研究项目,该功能将自动可用。
了解详情
安全集成:执行派生规则以标记需跟进检查的安全病例
用例
对安全病例(Safety Case)内容所做的更改,将触发针对该受试者的检查流程,并向安全系统发送随访(Follow-Up)消息。除了实际数据更改外,此类更改还包括医学编码的关联或修改等操作。在此版本中,任何针对表单上属于安全病例项的跨表单派生规则都将触发对该受试者的检查流程,并向安全系统发送“随访”通知。
此功能可确保表单上的所有数据更改均被记录,以便随访处理。
说明
如果执行的跨表单派生规则针对安全病例中某表单的派生字段,系统将自动标记该受试者需进行随访检查。
启用和配置
对于使用安全-EDC 连接的研究,此功能会自动启用。
Safety-EDC 连接:实现了合并用药药物作用的动态词汇同步
用例
在安全病例启动事件表单类型中,原静态的合并用药药物作用(Concomitant Medication Drug Role)选项列表,现可从 Veeva Safety 系统动态获取。
说明
在“系统工具 > 连接 > 安全”路径下,当通过“Safety-EDC 连接”功能运行扫描 Vault 安全(Scan Vault Safety)作业以同步 EDC 与 Veeva Safety 术语表时,安全病例启动事件表单类型(AE_CM_LINK_DRUG_ROLE)中药物作用的值转换(Value Translations)也将同步更新。
对于现有的连接和研究,管理员必须重新运行术语表专用的扫描 Vault 安全作业,以在 EDC 中显示可用的 Veeva Safety 选项,供后续映射与部署使用。
启用和配置
此功能可立即在使用“Safety-EDC 连接”功能的研究中执行。
安全集成:优化了纳入规则中事件开始日期未知的日期匹配机制
用例
要将更多与安全相关的受试者信息纳入安全病例,可配置基于日期匹配的时效规则——通过比对安全病例启动事件的起止日期进行判定。
在此版本之前,安全病例启动事件(Safety Case Initiation Event) 的起始日期(如严重不良事件起始日期)存在日/月信息缺失,当该日期与受试者其他安全相关信息起止日期的时效规则比对结果不明确时,系统将自动排除相关表单数据。
现在,当安全病例启动事件(如严重不良事件)的起始日期存在日/月信息缺失时,系统将基于配置的时效规则,优先纳入更多安全相关信息。这意味着,如果因日/月信息缺失而无法明确判定相关信息是该纳入还是排除时,系统将默认纳入(除非因其他适用规则或设置导致排除)。
此外,针对研究药物信息,系统现在也支持纳入同日多次配药记录。在此版本之前,如果同日发生多次药物配药,系统仅会选择其中一次配药的研究药物信息用于安全病例传输。所有满足同一纳入标准且同日配药的研究药物记录均会被纳入传输。
说明
在“工作室 > 表单配置 > 纳入标准”中,可配置日期比对规则,以基于安全病例启动事件的起止日期匹配纳入更多安全相关信息。改进后的日期匹配适用于以下纳入标准:针对安全病例启动事件、研究药物、合并用药、病史、用药史、检验结果等安全表单类型,采用“自事件起始日至结束日全部纳入”和事件开始日期“当天/之前的天数”、“当天/之后的天数”纳入标准;针对研究药物安全数据类型,还采用“首次配药”、“最接近的日期/之前”和“最接近的日期/之后”纳入标准。
例如,如果安全病例启动事件的起始日期为 7 月 ?? 日,则 7 月 5 日的“首次配药”记录现在将被纳入传输(此前该记录会被排除)。如果在 7 月 9 日和 14 日还有额外的研究药物配药记录,则根据“最接近的日期/之前”规则,这些记录均会被纳入(而在此发布之前没有传输任何记录)。如果仅知道年份为 2025 年,则选择“最接近的日期/之前”选项时,所有起始日期为 2025 年的信息均会被纳入安全病例。
对于同日配药的研究药物记录传输改进示例:如果安全病例启动事件的起始日期为 7 月 27 日,且有以下研究药物配药记录(起始日期 = 结束日期,即未映射结束日期):
- 7 月 15 日(表单序列 #1)
- 7 月 15 日(表单序列 #2)
- 7 月 20 日(表单序列 #3)
- 7 月 22 日(表单序列 #4)
- 7 月 26 日(表单序列 #5)
- 7 月 26 日(表单序列 #6)
如果纳入规则配置为“首次配药”,则现在 #1 和 #2 均会被纳入。
如果纳入规则配置为“最接近的日期/之前”,则现在 #5 和 #6 均会被纳入。
启用和配置
对于使用 E2BLink 或 Safety-EDC 连接的研究,此功能会自动启用。
注意:对于在研项目,改进后的日期匹配功能可能导致现有安全病例收到随访安全消息。
安全集成:优化了无结束日期病史表单的纳入规则
用例
病史表单可能不会记录结束日期,或者即使记录了,也不会将其映射到安全系统。相反,它映射为持续中(Continuing),并用于正在进行的报告问题。在此版本之前,即使病史记录被标记为“持续中”,缺失病史结束日期映射也会生成验证结果,并在按日期与纳入规则匹配进行评估时排除病史信息。现在,对于没有映射结束日期但被标记为持续中的病史表单,将在日期比对中与无限结束日期进行比对。
说明
在“工作室 > 表单配置 > 纳入规则”中,可配置日期比对规则,以基于安全病例启动事件的起止日期匹配纳入病史信息。如果未映射结束日期但已映射“持续中”且评估结果为真的病史表单参与日期比对,则系统将假定其结束日期为无限期。例如,如果要将安全病例启动事件起始日期前 365 天内发生的所有病史信息纳入病例,现在只要病史结束日期未被映射,在此时间段内开始且被记录为“持续中”的记录也将被纳入。
启用和配置
对于使用 E2BLink 或 Safety-EDC 连接的研究,此功能会自动启用。
Safety-EDC 连接:实现了对自定义安全文本字段的扩展支持
用例
在 Veeva Safety 中,安全病例审查可能需要额外的非标准安全相关 EDC 数据。为支持将大段文本及累积的 EDC 信息传输至 Veeva Safety,现在可始终将重复项组内的项映射至文本类型的自定义安全字段,且 EDC 会自动串联重复项。
说明
如果将重复项组内的 EDC 项映射至文本类型的自定义安全字段,系统将串联重复 EDC 项的值。各项值之间以空格分隔,串联顺序按项组序列号升序排列。串联后的文本长度上限为 32,000 个字符,超出部分将直接截断且无进一步提示。串联后的值将作为文本传输至映射的 Veeva Safety 自定义安全字段。
为此,现在每条记录录入位置(Each Entry In)的表单选择功能也支持将重复项组内的 EDC 项目映射至文本类型的自定义安全字段。
启用和配置
对于使用“Safety-EDC 连接”功能的研究,此功能立即可用。
Safety-EDC 连接:扩展了数据同步周期
用例
Safety-EDC 连接不仅传输安全病例数据,还会同步所有与安全相关但未被纳入“病例”的受试者信息,供 Veeva Safety 审查。在安全病例完成审查后,无需通过连接无限期持续更新所有额外安全相关受试者数据。因此,需要配置受试者所有事件结束后继续更新额外受试者数据的最大天数限制。此最长期限现已从 30 天延长至 500 天。请注意,此设置不会影响安全病例数据的更新,病例数据的更改仍会无限期触发随访消息。
说明
在“工具 > 安全集成 > 安全设置”中,针对非实际安全病例组成部分但与安全相关的受试者数据,其持续更新数据同步期限已从 30 天延长至最长 500 天。默认值仍为 7 天。
启用和配置
此功能对使用 Safety-EDC 连接的研究立即开放配置。
安全集成:增强了后续扫描作业功能
用例
在研究进行过程中,安全随访扫描(Safety Follow-Up Scans)的可靠处理至关重要。为了满足这一需求,我们为安全随访扫描作业添加了更强大的问题检测和故障通知功能。
说明
对于任何失败的安全随访扫描作业,Vault 将向任务所有者及在连接(Connection)设置中通知邮件(Notification Emails)字段定义的所有邮箱地址或邮件列表发送电子邮件通知。
此外,如果安全随访扫描作业所有者不再具备运行该作业的权限,系统将在作业历史记录列表的作业日志中记录失败信息并终止作业,同时按上述方式发送电子邮件警报。
要运行安全随访扫描作业,用户必须处于激活状态、具备研究访问权限、可访问研究中的所有站点,且角色需授予管理安全集成(Manage Safety Integrations)和管理作业(Manage Jobs)权限。
启用和配置
对于使用 Safety-EDC 连接或 E2BLink 链接的研究,此功能会自动启用。
Safety-EDC 连接:将亲子受试者信息关联至相关病例
用例
在试验中,如果受试者的子女在意外妊娠情况下发生严重不良事件,EDC 系统会为子女创建独立的病例簿和安全病例。子女的病例簿中包含人口统计学信息,用于将其安全病例与父母的安全病例。当前增强功能进一步在子女病例簿的安全病例与 Veeva Safety 中父母的相关妊娠或不良事件安全病例之间创建唯一病例链接(Case Link)。即使因编辑或删除导致父母受试者编号更改,病例链接可保留亲子关系。
说明
通过在子女的病例档案中提供父母受试者编号,Veeva EDC 现在还会随病例消息一同传输父母受试者全局标识符(parent_subject_global_id),以同时实现两个目的:一是将病例标识为子女的安全病例,二是在 Veeva Safety 中创建与父母意外妊娠安全病例或父母最近发生的不良事件之间的唯一病例链接。
此功能对 EDC 用户体验没有影响,不能仅在 EDC 中测试,需要与 Veeva Safety 进行集成测试。父母意外妊娠安全病例与子女安全病例之间的正确病例链接必须在 Veeva Safety 中进行追溯验证。
启用和配置
对于使用安全-EDC 连接的研究,此功能会自动启用。
E2BLink:每个研究关联多个“安全病例启动事件”表单
用例
需要触发从 EDC 到安全系统的安全病例传输的多个 EDC 表单 是一种常见情况。例如,某项研究可能根据研究药物的不同设置不同版本的不良事件(AE)表单,或者研究可能设置专门用于跟踪意外妊娠情况的表单。
此版本之前,E2BLink 仅允许配置单个安全病例启动事件(即触发安全病例传输的表单)。这就需要设计一个单独的综合性 AE 表单才能涵盖所有可能的情况。
在此版本中,使用 E2BLink 时,可针对每个研究将多个表单*映射至*安全病例启动事件表单类型,以触发数据传输。通过配置多个 EDC 表单来启动安全病例的传输,研究和库中的 AE 表单设计将具有更高的灵活性。此功能还将涵盖一个关键使用场景:通过单独的表单收集试验受试者意外妊娠的数据,该表单将独立于 AE 表单,触发独立创建一个安全病例。
说明
在“工作室(Studio)”>“安全集成(Safety Integration)”>“表单配置(Form Configuration)”中,用户现在可以使用安全病例启动事件表单类型创建多个表单配置。针对每个研究,用户仍然只能将一个 EDC 表单映射到一个类型表单,例如,一旦药物配药表单映射到某个表单配置,便无法映射到另一个表单配置。
为了考虑安全病例启动事件的可选性,我们为下列安全类型表单添加了一个“纳入标准(Inclusion Criteria)”部分。通过新增的安全病例启动事件纳入标准(Safety Case Initiation Event Which Includes)选择,可以进行相应配置,以便在任意一个或只有选定的安全病例启动事件启动向安全系统的数据传输时,将相应表单纳入安全病例。
- 伴随用药
- 药物史
- 病史
- 研究药物
- 测试结果
该配置默认为任意(Any)。在该附加配置保持不变的情况下,不会导致对现有安全病例进行随访数据传输。
作为此功能的一部分,以下 E2B 字段将移至安全病例启动事件表单类型。在该附加配置保持不变的情况下,配置转移不会导致对现有安全病例进行随访数据传输:
从合并用药表单类型中,以下 E2B 字段现已纳入安全病例启动事件表单类型:
- G.k.1 - 药物作用的特性
- G.k.8 - 对药物采取的行动
- G.k.9.i.2.r.3 - 评估结果
- G.k.9.i.4 - 是否在重新给药时出现反应?
从研究药物表单类型中,以下 E2B 字段现已纳入安全病例启动事件表单类型:
- G.k.8 - 对药物采取的行动
- G.k.9.i.2.r.3 - 评估结果
- G.k.9.i.4 - 是否在重新给药时出现反应
下表描述了这些字段:
| E2B ID | E2B 元素 | 信息 | 是否允许多个? | 必填选择项 |
|---|---|---|---|---|
| G.k.8 | 对药物(研究药物)采取的操作 | 针对每种研究药物。多事件病例:通过“对研究药物采取的措施”行为研究设置进行评估。 | 是(Yes) | 研究药物 |
| G.k.9.i.2.r.3 | (研究药物)评估结果 | 针对每种研究药物及相关事件 | 是(Yes) | 研究药物 |
| G.k.9.i.4 | 是否在重新给药后出现反应(研究药物) | 针对每种研究药物及相关事件 | 是(Yes) | 研究药物 |
| G.k.1 | 药物作用的表征(合并用药) | 研究机构用户对药物的看法。仅在重复项组内,且该组内含与合并用药表单建立表单链接的项。 | 否(No) | 与表单建立链接的项 |
| G.k.8 | 对药物采取的行动(合并用药) | 研究机构用户对药物的看法。仅在重复项组内,且该组内含与合并用药表单建立表单链接的项。 | 否(No) | 与表单建立链接的项 |
| G.k.9.i.2.r.3 | 评估结果 | 研究机构用户对药物的看法。仅在重复项组内,且该组内含与合并用药表单建立表单链接的项。 | 否(No) | 与表单建立链接的项 |
| G.k.9.i.4 | 否在重新给药后出现反应(合并用药) | 研究机构用户对药物的看法。仅在重复项组内,且该组内含与合并用药表单建立表单链接的项。 | 否(No) | 与表单建立链接的项 |
启用和配置
此功能会自动启用,并立即可用于使用 E2BLink 进行研究的配置。实时研究的配置可能会导致对现有安全病例发送随访安全消息。
Safety-EDC 连接:研究药物安全表单类型新增标准安全字段
用例
为了更好地支持器械研究,我们新增了“标准安全(Standard Safety)”字段,用于映射到研究药物安全表单类型。
说明
在“工作室 > 表单配置”中,以下字段现在可用于映射研究药物表单类型:
- 妊娠暴露次数(SD_GESTATION)
- 妊娠暴露单位(SD_GESTATION_UNIT)
- 器械名称(SD_DEVICE_NAME)
- 器械评估情况(SD_DEVICE_EVALUATED)
- 器械使用类型(SD_DEVICE_USAGE_TYPE)
- 器械植入日期(SD_IMPLANTED_DATE)
- 器械取出日期(SD_EXPLANTED_DATE)
- 器械使用时长(SD_DEVICE_AGE)
- 器械使用时长单位(SD_DEVICE_AGE_UNIT)
- 附加信息编码(SD_ADDITIONAL_INFO_CODED)- 如果每条记录录入位置设置为表单,则此字段允许映射 EDC 中重复和非重复项组的项。
如果表单配置将每条记录录入位置设置为重复项组,则所有项必须与起始日期(SD_START_DATE)项位于同一个 EDC 重复项组内。
如果在多个 EDC 表单中记录了关于研究药物或器械的不同答案,EDC 将传输最后修改的值。这是为了确保符合 Veeva 安全系统中符合 E2B 标准的产品信息要求。
启用和配置
此功能对使用 Safety-EDC 连接的研究立即开放配置。
安全集成:当被分类为“未给药”时隐藏研究药物
用例
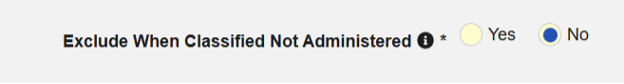
不良事件可能在研究药物给药前就被记录下来。在此版本之前,即使研究药物尚未配药,其详细信息仍会随安全病例一同传输,且药物角色会被标记为“未给药”(E2B代码=“4”)。现在,研究药物安全类型中新增了一个表单配置选项,若药物尚未给药,则可抑制其信息的传输。这将减少安全系统在处理安全病例时的干扰信息。
说明
在 E2BLink 中,如果研究药物信息嵌入在“安全病例启动事件”(例如,不良事件表单)中,并且使用“每条记录录入位置:表单中的重复项组(Each Entry In: Repeating item group in form)”时,新设置将在“纳入标准”标签页中提供。
对于所有现有研究和表单配置,此设置将默认设置为“否”;而对于新研究和新表单配置,则默认设置为“是”。
启用和配置
如需在有限发布版本中进行测试,请联系支持团队以启用此功能。
对于使用 Safety-EDC 连接功能或 E2BLink 的研究,此功能在常规版本中自动提供配置选项。实时研究的配置可能会导致对现有安全病例发送随访安全消息。
Safety-EDC 连接:允许“死亡日期”未知或提供具体时间
用例
Veeva Safety 系统中的死亡日期(Date of Death)允许录入完整或部分日期,包括使用未知的日期部分,以及指定日期和时间。此版本优化了 Safety-EDC 连接功能,使其在传输完整日期的基础上,还能处理这些特殊情况。
说明
在“工作室 > 表单配置 > 如果死亡”中,死亡日期字段现在允许映射包含未知日期部分的日期和日期时间项。这些未知的日期部分也将通过连接进行传输。
启用和配置
此功能对使用 Safety-EDC 连接的研究立即开放配置。
EDC API
EDC API 的新功能如下。请参阅我们的开发者门户的发行说明,了解更详细的功能信息。
EDC API 功能
该版本为 EDC 开发者提供了以下功能:
- 管理试验方案偏离
- 启动和管理 Vault 级作业
- 支持最小重复表单数量
EDC 临床报告
以下是 Veeva EDC Clinical Reporting(临床报告)应用程序的新功能。
试验方案偏离列表和导出
用例
临床报告中的试验方案偏离(PD)通过新增的方案偏离页面和标准列表,优化了审查机制。
说明
新增的 PD 核心列表可展示 Veeva EDC 中定义的 PD。这些核心列表可供下载,并可纳入数据提取文件和 SFF 文件中。
启用和配置
对于已在工作室中启用了方案偏离功能的临床报告研究,此功能将自动可用。
临床报告:系统列表更新
用例
纳入这些标识符后,客户可在下游系统中使用 GUID 进行深度链接,以及与其他 Veeva 提供的数据集进行更高级的关联。
说明
本次发布为系统(SYS)列表添加了系统全局唯一标识符(GUID),以使临床报告的 SYS 列表与 SDE(研究数据提取)更好地保持一致。
SYS_Sites添加了Site.IDSYS_Subjects添加了Subject.IDSYS_Events添加了Event.IDSYS_Forms添加了Form.IDSYS_Links添加了Form.IDSYS_PD添加了PD.PID
除“SYS_LINKS.csv”文件(其中为 FORMID)外,SFF 中所有字段的命名均为 SYSID。
数据导出中包含的 SYS 列表(包括 SFF)将在发布时自动更新,并且不会显示更改检测。
在此版本中,我们还在查询列表和 CQL 中添加了“查询开启至关闭(Query Open To Close)”功能。对现有导出定义的更改将显示受影响导出的更改检测标记。
启用和配置
发布后,此功能会自动用于临床报告研究。
临床数据库(CDB)和 EDC 临床报告
以下是 Veeva CDB 应用程序和/或 EDC 临床报告(即用于数据清理和报告的 Veeva Clinical Data 解决方法)的新功能。
可用性:临床数据库(CDB)仅对 CDB 许可证持有者提供。请联系 Veeva 服务代表了解详细信息。
第三方数据包智能再处理
用例
对第三方数据(3PD)进行不必要的再处理会浪费系统资源,导致批处理时间延长。
说明
生产环境研究中,我们将对第三方数据的每日再处理流程新增前置检查,系统会先判断上一次重处理是否触发了 D-002、 D-003 或 D-004 警告。当研究中心、受试者和事件(分别)存在于第三方数据包中但主数据源中缺失时,这些警告会提醒用户。
再处理可在主数据源更新并纳入新增研究中心、受试者或事件后,确保第三方数据顺利加载。如果没有警告,则无需再处理数据包,从而节省资源。
启用和配置
版本发布时,此功能将自动可用。请注意,只有正式研究才能自动再处理第三方数据。
了解详情
限制将第三方数据作为 Veeva EDC 研究的主要来源
用例
此次更新确保在使用 Veeva EDC 收集研究数据的项目中,第三方数据供应商无法错误地将自身数据标记为该研究的主数据。
说明
新增的验证机制可确保:针对设计为从 Veeva EDC 导入数据的研究项目,系统将禁止将第三方数据作为主数据源进行导入。
启用和配置
版本发布时,此功能将自动可用。
按审查列表中的观察状态筛选
用例
现在,在审查列表中针对数据所撰写的观察记录,可根据观察状态对列表进行筛选,仅显示符合条件的行。
说明
审查列表新增筛选选项,支持按观察状态(全部、未解决、待处理、已关闭、无观察记录)对行数据进行过滤。
启用和配置
版本发布时,此功能将自动可用。
列出已定义的快速查询
用例
当列表具有明确的“目的”时,可配置“列表定义查询(Listing Defined query)”选项,从而在多个数据管理员之间实现重复使用和标准化。数据管理者仍然可以选择创建自定义消息,或使用“确认值(Confirm Value)”快速查询。借助新的列表定义查询功能,研究团队可以提供一种方法来为研究中的每个列表设置通用查询的语言,从而提高研究中心的响应效率和理解能力。
说明
“查看列表”和“公共自定义列表”现在支持定义新的快速查询类型,以规范从列表生成的查询消息。
此选项在列表的“属性”对话框的新“查询”区域中可用。配置后,打开查询时,“列表定义选项”将作为查询类型之一可供选择。
启用和配置
此功能在发布时自动可用于启用“快速查询”功能的研究。
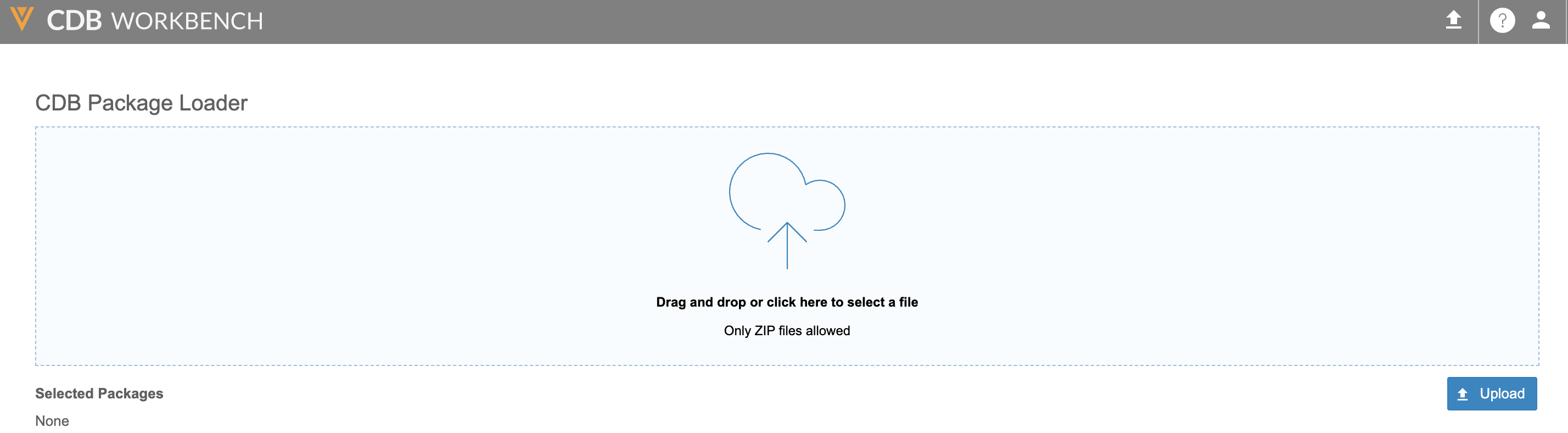
拖放上传第三方数据包
用例
该功能提供简化界面,支持将第三方及 OpenEDC 数据传输至 CDB 工作台。
说明
工作台顶部导航栏新增选项,允许拥有上传第三方数据包(Upload 3rd Party Data Packages)权限的用户通过拖拽本地 ZIP 文件的方式,将数据上传至工作台。
标准数据管理员、首席数据管理员、CDB 数据提供者和超级用户角色将被授予新权限。
启用和配置
版本发布时,此功能将自动可用。
了解详情
CDB 试验方案偏离管理
用例
CDB 工作台支持基于第三方数据创建方案偏离,例如通过将录入数据与参考数据(如禁用药物清单)自动比对生成偏离,或从列表批量创建。
数据管理员现在可以在查看 CDB 数据时创建协议 PD,并使用列表装饰功能查看列表中的偏离内容。研究团队可以通过配置 PD 检查规则,实现自动识别与解决数据问题时自动生成/关闭偏离,以减少手动操作。
说明
现在可以在 CDB 工作台中为研究创建方案偏离(PD)。所有在 Veeva EDC 数据上创建的 PD(包括手动创建和自动生成的)均会在 EDC 的“审查方案偏离(Review Protocol Deviations)”页面中显示。CDB 中的编辑仅限于将 PD 设置为设为非活动。
PD 可基于 EDC 和第三方数据,在受试者、事件、表单或项层级进行创建。
新增 PD 核心列表功能,包括:提供全部 PD 列表,以及按不同数据来源分类的专用列表。这些核心列表可供下载,并可纳入数据提取文件和 SFF 文件中。
PD CQL 语法新增以下属性:
- 源系统
- 源名称
- 源 ID
- 数据源
启用和配置
在 EDC 工作室中为研究启用“方案偏离管理”功能后,该功能自动可用。
在查询和观察消息中动态包含列值
用例
在编写查询或观察记录时,尤其是批量操作、在列表定义查询中或通过检查时,可将代表列表行数据的标记符嵌入消息中。这使用户能够动态地将数据值插入消息中,从而更好地根据研究中心自定义消息,或在观察记录中纳入重要上下文信息。
此功能使数据管理员能够在单次批量操作中创建大量独特,且数据丰富的查询。对于检查,这允许研究自动打开查询,这些查询在消息中包含特定的相关数据点。
说明
CDB 工作台现在允许将列表中的数据项值自动纳入查询或观察消息中,从而允许通过纳入列表的数据来更好地自定义消息。
启用和配置
版本发布时,此功能将自动可用。
支持在 TST 研究中测试 SFF
用例
此功能允许 CDB 工作台研究在 TST 环境中测试 SFF 提取。
说明
测试研究环境现在支持选择测试研究文件格式(SFF)API。启用 SFF 进行测试后,在以下两种情况下此功能将被禁用:
- 自上次数据包下载起已超过 30 天
- 如果用户从未下载过数据包
用户可以重新启用 SFF,但这需要生成一个新的完整导出数据包。
启用和配置
发布后,此功能会自动用于 CDB 工作台研究。
了解详情
CDB 工作台:系统列表更新
用例
纳入这些标识符后,客户可在下游系统中使用 GUID 进行深度链接,以及与其他 Veeva 提供的数据集进行更高级的关联。
说明
本次发布为系统(SYS)列表添加了系统全局唯一标识符(GUID),以使 CDB SYS 列表与 SDE(研究数据提取)更好地保持一致。
SYS_Sites添加了Site.IDSYS_Subjects添加了Subject.IDSYS_Events添加了Event.IDSYS_Forms添加了Form.IDSYS_Links添加了Form.IDSYS_PD添加了PD.PID
除“SYS_LINKS.csv”文件(其中为 FORMID)外,SFF 中所有字段的命名均为 SYSID。
数据导出中包含的 SYS 列表(包括 SFF)将在发布时自动更新,并且不会显示更改检测。
在此版本中,我们还在查询列表和 CQL 中添加了 @QRY.OpenToClose。对现有导出定义的更改将显示受影响导出的更改检测标记。
启用和配置
发布后,此功能会自动用于 CDB 工作台研究。
参考数据导入:将最大列数增加到 35 列
用例
参考数据被导入到 CDB 研究中,以便自定义列表能够引用诸如禁用药物清单或始终归类为严重不良事件的术语等内容。此功能优化支持在参考数据导入中包含更多项数据。
说明
导入的参考数据现在最多可以包含 35 列。
启用和配置
版本发布时,此功能将自动可用。
CDB API
以下是 CDB API 的新功能。请参阅我们的开发者门户的发行说明,了解更详细的功能信息。
CDB API 功能
该版本为 CDB 开发者提供了以下功能:
- 研究文件格式包版本控制
- 研究文件格式:确保表单提交日期一致
EDC 迁移器
本部分中的功能是针对 Veeva EDC 迁移器的新功能。
支持迁移禁食状态和女性生理周期数据
用例
25R2 EDC 版本在实验室正常值范围管理中新增了对“禁食状态”和“女性生理周期”参数的本地实验室支持。此版本将该支持扩展到从其他 EDC 系统迁移的研究。
说明
此功能支持迁移包含“禁食状态”和“女性生理周期”参数的实验室源数据。对于在工作室中启用了“禁食状态”和/或“女性生理周期”的实验室表单,EDC 数据迁移工具将针对 25R2 版本引入的新实验室表头提供映射与验证支持,包括 YAML 构建器(YAML Builder)映射支持。
启用和配置
此功能对迁移中的研究立即可用。
YAML Builder 支持项单位
用例
之前的增强功能支持“单位”项的映射,但需要手动操作。通过此更新,YAML 构建器会自动插入这些映射。
说明
YAML 构建器会将单位项的映射关系插入到对应表单的 YAML 文件中。
启用和配置
此功能对迁移中的研究立即可用。
支持表单和项链接
用例
此功能大幅减少了在迁移研究中创建链接所需的手动操作量。
说明
EDC 数据迁移工具现可通过链接(Links)CSV 文件创建表单间(form-to-form)及项到表单(item-to-form)的关联关系。
使用单一链接 CSV 文件即可同时处理表单间和项到表单的链接配置。在文件中,父表单链接所需列的列标题添加了“_REF”后缀。关联其他父表单所需列的列标题添加了“_LINK”后缀。必填列若未填写数据将触发错误提示。
启用和配置
需在研究设计中预先配置表单链接关系,并将外部链接 CSV 文件与临床源数据一并提交。
了解详情
实验室数据应用程序功能优化
用例
我们引入了两个实验室增强功能,以下两种迁移场景:一是源数据中实验室收集日期/时间(Collection Datetime)被录入后又被删除(显示为空值)的情况;二是迁移研究中使用实验室正常值范围覆盖。
说明
EDC 数据迁移工具现在可以成功发送空的实验室收集日期/时间值。在这些情况下,生成的实验室收集表单会显示表头信息,但在提供有效时间值之前,实验结果字段将保持不可编辑状态。这与未提供或删除了收集日期/时间的手动录入表单表现一致。此外,当迁移研究使用实验室正常范围覆盖时,覆盖原因现在会包含在审计跟踪中。
启用和配置
这些更新在具有本地实验室数据的迁移研究中立即可用。
了解详情
支持从 InForm™ 迁移实验室数据
用例
YAML 构建器现在支持在将研究从 Inform 迁移到 Veeva EDC 时映射实验室数据。
说明
迁移用户现在可以使用 YAML 构建器为包含实验室数据且源自 Inform 的研究创建映射文件。
启用和配置
此功能立即可用。