执行 SDV
临床试验监查员(CRA)可以在表单提交后执行源数据验证(SDV),以确保研究中心收集的所有数据都是准确的。SDV 涉及将源数据与在 Veeva EDC 中输入的数据进行手动比较。你可以在审查(Review)选项卡中执行 SDV。有关 DMR 的帮助,请参见执行 DMR。
先决条件
要使用附加审查功能(对不需要审查的事件日期和条目执行 DMR),研究设计者必须对你的研究启用此功能。
在对研究数据执行 SDV 之前,需要进行以下配置:
- 研究设计者使用 SDV 审查任务创建至少一个审查计划。
- 首席数据管理员将审查计划分配给研究中心。
默认情况下,具有标准 CDMS 临床试验监查员(CDMS Clinical Research Associate)研究角色的用户可以执行上述操作。如果贵组织使用自定义研究角色,则你的角色必须拥有以下权限:
| 类型 | 权限标签 | 控制 |
|---|---|---|
| “标准”选项卡 | 审查(Review)选项卡 | 能够访问审查选项卡 |
| 功能权限 | 查看 SDV | 能够查看 SDV 状态 |
| 功能权限 | 编辑 SDV | 能够执行 SDV |
如果你的“研究”包含受限数据,你必须具有“受限数据访问(Restricted Data Access)”权限才能查看该数据。
了解有关“研究角色”的更多信息。
SDV 要求
根据 Vault 的配置和研究设计,某个研究或研究中心可能只包含 SDV 或 DMR,或同时包含 SDV 和 DMR。申办方可以通过审查计划定义在给定研究或研究中心中需要执行 SDV 的字段。详细信息请参阅创建审查计划。如果没有审查计划,则研究或研究中心中所有条目的要求模式将设置为无需审查。研究或研究中心中的所有表单和条目均需执行 SDV 和 DMR。
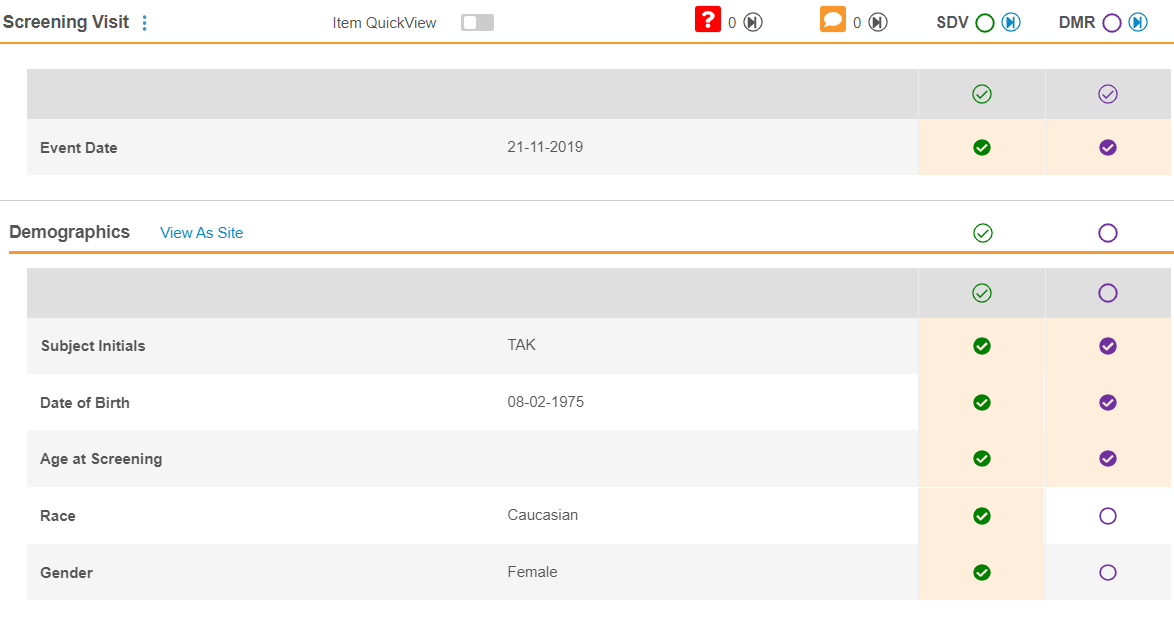
Vault 在事件 & 表单列表面板中显示 SDV 和 DMR 状态。
在内容(Content)面板中查看表单时,可以单击 SDV 和 DMR 状态图标完成审查。
如何执行 SDV
可以通过单击内容面板中的 SDV 状态图标来执行 SDV 或 DMR。在执行 SDV 时,Vault 会以黄色突出显示未保存审查的条目。必须单击保存(Save)以便 Vault 保存 SDV 或 DMR 更改并更新事件和表单审查状态。你可以单击放弃更改(Discard Changes)来删除上次保存后的审查更改。
对事件执行 SDV
要对整个事件执行 SDV,请执行以下操作:
- 在审查选项卡中导航到包含事件的病例手册。
- 单击以在计划(Schedule)面板中打开要审查的事件。
- 单击事件标题中的 SDV 图标完成审查。
- 可选:单击下一个 SDV 任务(Next SDV Task)快速移动到下一个开放的 SDV 任务。
- 点击保存。
对事件执行 SDV 会将 SDV 应用于事件日期、访视方法(如果已配置)和关联表单。
对事件日期执行 SDV
对事件日期执行 SDV,请执行以下操作:
- 在审查选项卡中导航到包含事件的病例手册。
- 单击以在计划(Schedule)面板中打开要审查的事件。
- 单击事件日期的 SDV 图标完成审查。
- 可选:单击下一个 SDV 任务(Next SDV Task)快速移动到下一个开放的 SDV 任务。
- 点击保存。
对表单执行 SDV
要对整个表单执行 SDV,请执行以下操作:
- 在审查选项卡中导航到包含表单的病例手册。
- 单击以在计划(Schedule)面板中打开要审查的表单。
- 单击表单标题中的 SDV 图标完成审查。
- 可选:单击下一个 SDV 任务(Next SDV Task)快速移动到下一个开放的 SDV 任务。
- 点击保存。
对条目组执行 SDV
要对条目组执行 SDV,请执行以下操作:
- 在审查选项卡中导航到包含条目的病例手册。
- 单击以在计划(Schedule)面板中打开包含条目组的表单。
- 在内容(Content)面板中,找到要执行 SDV 的条目。
- 单击 SDV 图标完成审查。
- 可选:单击下一个 SDV 任务(Next SDV Task)快速移动到下一个开放的 SDV 任务。
- 点击保存。
对条目执行 SDV
要对条目执行 SDV,请执行以下操作:
- 在审查选项卡中导航到包含条目的病例手册。
- 单击以在计划(Schedule)面板中打开包含条目的表单。
- 在内容(Content)面板中,找到要执行 SDV 的条目。
- 单击 SDV 图标完成审查。
- 可选:单击下一个 SDV 任务(Next SDV Task)快速移动到下一个开放的 SDV 任务。
- 点击保存。
完成 SDV
上次更新时间:24R1
本视频讲解如何在 EDC 的“审查”选项卡中完成源数据验证(SDV)。
附加审查
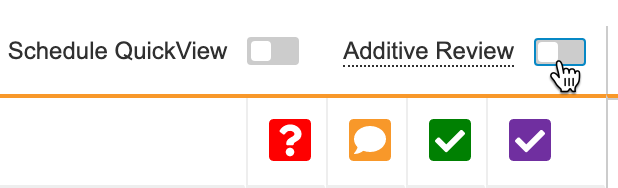
有时可能需要对审查计划不要求 SDV 的事件日期或条目执行额外的 DMR。可以使用附加审查(Additive Review)功能来跟踪这些审查。
如果打开附加审查模式,它将适用于整个研究中心,而不仅仅是正在查看的病例手册。但是,附加审查是用户特定的,这意味着它只适用于启用它的用户。进入附加审查模式后,Vault 将在 24 小时内保持附加审查模式,或者直到关闭附加审查模式。
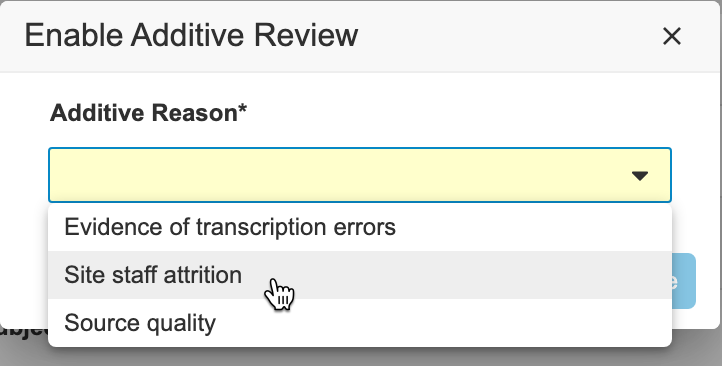
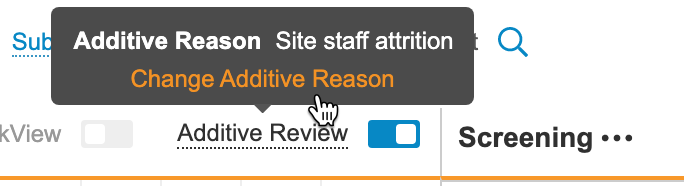
在启用附加审查模式期间,你可以对病例手册中的任何事件日期或条目执行 SDV,并记录审查原因。保存审查时,Vault 会显示一个加号()图标。将鼠标悬停在该图标上可以显示附加原因。
可以在进行所需及可选的 SDV 时同时执行附加审查。
要执行附加审查,请执行以下操作:
- 在审查选项卡中导航到要审查的病例手册。
- 点击保存。这将启动附加审查模式。
- 可选:要更改附加原因,请执行以下操作:
- 执行必要的 SDV。请参阅上述每个数据级别的说明。
- 完成后,单击保存(Save)。
Vault 将向你发送一封包含附加审查摘要的电子邮件,其中包括以下列:
- 研究
- 国家/地区
- 研究中心
- 受试者
- 受试者状态
- 事件组
- 事件日期
- 表单标签
- 表单序列
- 项组标签
- 条目组序列号
- 项标签
- 审查计划
- 上次审查者
- 上次审查日期
- 附加原因
- 列表的上次运行
附加审查
上次更新时间:23R1
本视频演示如何在“审查”选项卡中执行附加审查。
如何清除已完成的 SDV
清除 SDV 即表示需要重新执行 SDV,或者表示 SDV 已失效。要清除 SDV,请再次单击图标或链接(针对条目组)。每个条目的图标将返回到其未选中状态。
SDV 状态图标
Vault 使用以下图标来表示 SDV 审查状态:
| 图标 | 名称 | 含义 |
|---|---|---|
| SDV 完成 | 选中图标表示所需的 SDV 已完成 |
|
|
|
SDV 可选完成 | 附加了“可选”的选中图标表示 SDV 是可选的并且已完成 |
|
|
SDV 可选 | 附加了“可选”的未选中图标表示 SDV 是可选的并且未完成 |
| 需要 SDV | 未选中图标表示需要 SDV 并且未完成 |
|
| 无图标 | 不需要执行 SDV | 无图标表示事件、表单或条目不需要执行 SDV。 |
Vault 在“事件和表单列表(Event & Form List)”面板中使用不同的图标来表示 SDV 的必要性和完整性。
| 图标 | 名称 | 含义 |
|---|---|---|
| SDV 未开始 | 所需条目或事件日期的 SDV 已完成 0%(未开始)。 |
|
| SDV 进行中 | 事件或表单的 SDV 正在进行中,但需要 SDV 的条目或事件日期的 SDV 并未全部完成。 |
|
| SDV 完成 | 所需条目或事件日期的 SDV 全部已完成。 |
|
| 已计划 | 该事件仍处于计划状态,因此没有与之或与其表单关联的审查状态。 |